
- •Ответы к экзамену по Химии:
- •1)Основные химические законы и понятия.
- •2)Строение атомов. Модель атома по Резенфорду, по Бору.
- •3)Волновые свойства электрона. Принцип неопределённости Гейзенберга.
- •4)Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
- •5)Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Порядок заполнения атомных орбиталей электронами.
- •6)Периодический закон д.И. Менделеева. Структура периодической системы.
- •7)Развитие периодического закона. Энергия ионизации, сродство к электрону, электроотрицательность.
- •8)Химическая связь и валентность.
- •9)Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
- •10)Ионная связь. Типы ковалентных молекул.
- •11)Межмолекулярные взаимодействия, их типы, характеристика.
- •12)Донорно-акцепторная связь. Водородная связь.
- •13)Металлическая связь. Структура твёрдых тел.
- •14)Элементы химической термодинамики. Первое начало термодинамики.
- •15)Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствия из него.
- •16)Элементы второго начала термодинамики. Энтропия.
- •17)Энергия Гиббса. Направленность химических процессов.
- •18)Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции.
- •19)Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
- •20)Цепные реакции. Гомогенный катализ.
- •21)Скорость гетерогенных реакций. Гетерогенный катализ.
- •22)Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твёрдых тел, жидкостей в жидкостях.
- •23)Первые и второй закон Рауля. Осмотическое давление. Закон Вант-Гоффа.
- •24)Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
- •25)Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
- •26)Диссоциация воды. Водородный показатель.
- •27)Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей.
- •28)Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов.
- •29)Теория гальванических элементов.
- •30)Уравнение Нернста. Концентрационные гальванические элементы. Поляризация и деполяризация. Элемент Лекланше.
- •31)Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея.
- •32)Электролиз растворов с нерастворимыми электродами. Электролиз расплавов.
- •33)Электролиз растворов с растворимым анодом, его применение: гальваностегия, гальванопластика, электролитическое рафинирование.
- •34)Аккумуляторы. Устройство, принцип действия свинцового аккумулятора.
- •35)Топливные элементы.
- •36)Коррозия металлов. Виды коррозионных разрушений. Электрохимическая коррозия.
- •37)Химическая коррозия. Электрокоррозия. Скорость коррозии.
- •38)Методы защиты металлов от коррозии.
- •39)Классификация металлов. Кристаллическая структура, физические свойства металлов.
- •40)Получение металлов из руд. Способы получения металлов высокой чистоты.
- •41)Общие химический свойства металлов.
- •42)Лёгкие конструкционные материалы. Алюминий. Свойства, получение, применение в технике, важнейшие соединения.
- •43)Медь. Свойства, получение, применение в технике, важнейшие соединения.
- •44)Олово. Железо. Свойства, получение, применение, важнейшие соединения.
- •45)Высокомолекулярные соединения, их виды, способы получения вмс.
- •46)Получение высокомолекулярных веществ с помощью поликонденсации.
- •47)Применение полимеров. Основные полимеры, получаемые полимеризацией.
- •48)Основные полимеры, получаемые поликонденсацией. Фенолоформальдегидные смолы, полиамиды, полиэфирные смолы.
41)Общие химический свойства металлов.
Ответ: Химические свойства металлов (смотри лабораторную работу №2 «Отношение металлов к воде, кислотам и щелочам”).
Металлы взаимодействуют с простыми и сложными веществами. Во всех реакциях металлы (простые вещества) выполняют роль восстановителей, при этом они окисляются до положительно заряженных ионов (катионов):
Металлы обладают разной химической активностью. Это проявляется как при окислении металлов газообразными или твердыми веществами (хлором, кислородом, серой), так и в реакциях с водой и водными растворами кислот, солей, щелочей. Поведение металлов в разбавленных водных растворах прогнозируется на основе ряда активности металлов. Этот ряд был составлен в результате многочисленных экспериментов русским ученым Николаем Николаевичем Бекетовым в 1865 году и назван им «вытеснительным рядом». Позднее ряд Н.Н. Бекетова получил теоретическое подтверждение на основе сравнения ЭДС гальванического элемента, составленного из пар разных металлов. Каждый металл (а точнее система металл0/металлn+, то есть металл, погруженный в раствор электролита, обычно соли, содержащий его катионы) характеризуется определенной величиной стандартного электродного потенциала. Ряд металлов, расположенных в порядке возрастания величин стандартных электродных потенциалов, называется электрохимическим рядом напряжений металлов.
Ряд активности (или электрохимический ряд напряжений) металлов отражает химическую (восстановительную) активность металлов в разбавленных водных растворах при комнатной температуре (25 OС). Чем более отрицателен электродный потенциал металла, то есть чем левее он расположен в ряду активности, тем больше его восстановительная способность. Более конкретные выводы таковы: 1)все металлы, стоящие левее водорода в ряду активности, т.е. имеющие отрицательный стандартный потенциал (стандартный потенциал водорода принят за 0), вытесняют водород из растворов кислот (за исключением азотной HNO3), т.е. восстанавливают катионы водорода; 2)металл, расположенный левее в ряду активности, вытесняет из растворов солей (восстанавливает) любой металл, стоящий в ряду активности правее; 3)восстанавливать водород из чистой воды (нейтральная среда) могут при комнатной температуре только наиболее активные (щелочные и щелочно-земельные) металлы, стоящие в самом начале ряда. Положение металлов в электрохимическом ряду напряжений позволяет объяснять коррозионное поведение металлов в различных агрессивных средах, а также прогнозировать электродные процессы при электролизе растворов электролитов.
Сильные восстановители:
Me0-ne->Men+.
1)Реакции с
неметаллами: С
кислородом: 2Mg+O2->2MgO;
С серой:
Hg+S->HgS; С галогенами:
Ni+Cl2->Ni+2Cl2;
С азотом:3Ca+N2->Ca3N2;
С фосфором:
3Ca+2P->Ca3P2.
С водородом (реагируют только
щёлочные и щёлочно-земельные металлы):
2Li+H2->2LiH;
Ca+H2->CaH2.
2)Реакции с кислотами. Металлы, стоящие
в электрохимическом ряду напряжений
до H восстанавливают
кислоты-неокислители до водорода:
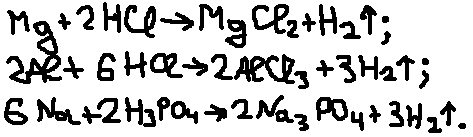 3)Взаимодействие с водой. Активные
(щёлочные и щёлочно-земельные металлы)
образуют растворимое основание и
водород:
3)Взаимодействие с водой. Активные
(щёлочные и щёлочно-земельные металлы)
образуют растворимое основание и
водород:
 Металлы
средней активности окисляют водой при
нагревании до оксида:
Металлы
средней активности окисляют водой при
нагревании до оксида:
![]() Неактивные (Au, Ag,
Pt) – не реагируют. Вытеснение
более активными металлами менее активных
металлов из растворов их солей:
Неактивные (Au, Ag,
Pt) – не реагируют. Вытеснение
более активными металлами менее активных
металлов из растворов их солей:
![]() .
.
