
- •Ответы к экзамену по Химии:
- •1)Основные химические законы и понятия.
- •2)Строение атомов. Модель атома по Резенфорду, по Бору.
- •3)Волновые свойства электрона. Принцип неопределённости Гейзенберга.
- •4)Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
- •5)Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Порядок заполнения атомных орбиталей электронами.
- •6)Периодический закон д.И. Менделеева. Структура периодической системы.
- •7)Развитие периодического закона. Энергия ионизации, сродство к электрону, электроотрицательность.
- •8)Химическая связь и валентность.
- •9)Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
- •10)Ионная связь. Типы ковалентных молекул.
- •11)Межмолекулярные взаимодействия, их типы, характеристика.
- •12)Донорно-акцепторная связь. Водородная связь.
- •13)Металлическая связь. Структура твёрдых тел.
- •14)Элементы химической термодинамики. Первое начало термодинамики.
- •15)Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствия из него.
- •16)Элементы второго начала термодинамики. Энтропия.
- •17)Энергия Гиббса. Направленность химических процессов.
- •18)Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции.
- •19)Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
- •20)Цепные реакции. Гомогенный катализ.
- •21)Скорость гетерогенных реакций. Гетерогенный катализ.
- •22)Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твёрдых тел, жидкостей в жидкостях.
- •23)Первые и второй закон Рауля. Осмотическое давление. Закон Вант-Гоффа.
- •24)Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
- •25)Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
- •26)Диссоциация воды. Водородный показатель.
- •27)Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей.
- •28)Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов.
- •29)Теория гальванических элементов.
- •30)Уравнение Нернста. Концентрационные гальванические элементы. Поляризация и деполяризация. Элемент Лекланше.
- •31)Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея.
- •32)Электролиз растворов с нерастворимыми электродами. Электролиз расплавов.
- •33)Электролиз растворов с растворимым анодом, его применение: гальваностегия, гальванопластика, электролитическое рафинирование.
- •34)Аккумуляторы. Устройство, принцип действия свинцового аккумулятора.
- •35)Топливные элементы.
- •36)Коррозия металлов. Виды коррозионных разрушений. Электрохимическая коррозия.
- •37)Химическая коррозия. Электрокоррозия. Скорость коррозии.
- •38)Методы защиты металлов от коррозии.
- •39)Классификация металлов. Кристаллическая структура, физические свойства металлов.
- •40)Получение металлов из руд. Способы получения металлов высокой чистоты.
- •41)Общие химический свойства металлов.
- •42)Лёгкие конструкционные материалы. Алюминий. Свойства, получение, применение в технике, важнейшие соединения.
- •43)Медь. Свойства, получение, применение в технике, важнейшие соединения.
- •44)Олово. Железо. Свойства, получение, применение, важнейшие соединения.
- •45)Высокомолекулярные соединения, их виды, способы получения вмс.
- •46)Получение высокомолекулярных веществ с помощью поликонденсации.
- •47)Применение полимеров. Основные полимеры, получаемые полимеризацией.
- •48)Основные полимеры, получаемые поликонденсацией. Фенолоформальдегидные смолы, полиамиды, полиэфирные смолы.
3)Волновые свойства электрона. Принцип неопределённости Гейзенберга.
Ответ:
Луи де Бройль в 1924г. сказал: частицы
которые ранее считались корпускулярными
– обладают также, и волновыми свойствами.
Длина волны:
![]() ,
,
![]() -
импульс,
-
импульс,
![]() У
тела с большой массой – волновой характер
не ощутим т.к.
У
тела с большой массой – волновой характер
не ощутим т.к.
![]() -
очень мала. А)ПУМ
=3,0*10-25
Аo. б)электрон
=2,4
Аo. Электрон в вакууме
– имеет двойственную природу: на ряду
с корпускулярными свойствами – он
обладает и волновыми свойствами, потому
его называют: не частицей и не волной,
а квантовым объектом, или микрочастицей.
-
очень мала. А)ПУМ
=3,0*10-25
Аo. б)электрон
=2,4
Аo. Электрон в вакууме
– имеет двойственную природу: на ряду
с корпускулярными свойствами – он
обладает и волновыми свойствами, потому
его называют: не частицей и не волной,
а квантовым объектом, или микрочастицей.
Нельзя
одновременно точно определить: и
координату, и импульс электрона. Можно
определить лишь – относительную
вероятность нахождения электрона: в
том, или ином месте атома:
![]() ,
где:
,
где:
![]() -
неопределённость (ошибка в определении)
величины импульса;
-
неопределённость (ошибка в определении)
величины импульса;
![]() - неопределённость (ошибка в определении)
в величине координат (в месте нахождения
электронов).
- неопределённость (ошибка в определении)
в величине координат (в месте нахождения
электронов).
4)Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
Ответ:
Волновое уравнение Шредингера
(1926г.) – это дифференциальное уравнение
в частных производных – для одного
электрона атома водорода, в трёхмерном
пространстве:
![]() ,
где: x, y, z
– координаты; E – полная
энергия электрона; Eп –
потенциальная энергия электрона;
,
где: x, y, z
– координаты; E – полная
энергия электрона; Eп –
потенциальная энергия электрона;
![]() -
волновая функция (характеризует амплитуду
трёхмерной волны) физического смысла
– не имеет, а физический смысл – имеет
величина
-
волновая функция (характеризует амплитуду
трёхмерной волны) физического смысла
– не имеет, а физический смысл – имеет
величина
![]() -
она характеризует плотность вероятности
нахождения электрона – в том, или ином
месте атома.
-
она характеризует плотность вероятности
нахождения электрона – в том, или ином
месте атома.
 Выводы: 1)Электрон в атоме – волновой
объект – поэтому атом вследствие
волнового характера электрона – не
имеет: точных геометрических размеров,
и неизменной формы. Хотя электрон – и
волновой объект, но потеря атомов
электрона (ионизация атома) – происходит
в виде: единого, и неделимого электрона
– как частицы. Строение электронных
оболочек атома. Следствием решения
уравнения Шредингера – являются 3
квантовых числа, которые характеризуют
поведение электронов – в атоме.
Выводы: 1)Электрон в атоме – волновой
объект – поэтому атом вследствие
волнового характера электрона – не
имеет: точных геометрических размеров,
и неизменной формы. Хотя электрон – и
волновой объект, но потеря атомов
электрона (ионизация атома) – происходит
в виде: единого, и неделимого электрона
– как частицы. Строение электронных
оболочек атома. Следствием решения
уравнения Шредингера – являются 3
квантовых числа, которые характеризуют
поведение электронов – в атоме.
Главное
квантовое число “n” –
характеризует общую энергию электрона,
или его энергетический уровень, и
определяет размеры атомной орбитали
(чем больше “n” – тем
больше размер орбитали, тем дальше
электрон находится от ядра, тем большей
энергией он обладает). “n”
– принимает значение:
![]() При
n=1 возможно 1 (одно) решение
уравнения Шредингера; n=2
возможно 4 решения уравнения; n=3
возможно 9 решений уравнений; т.е. при n
– возможно n2 решений.
Эти решения – представляют собой:
орбитальные волновые функции, или
орбитали электрона. Орбиталь (“электронное
облако”) – можно представить как
некоторую область вокруг ядра, куда
электрон имеет доступ – но не всегда
её (область) – заполняет. Совокупность
орбиталей – с одинаковым n
называется – уровнем. n
– совпадает с номером периода данного
элемента в таблице Менделеева. Таким
образом, число орбиталей, на уровне:
При
n=1 возможно 1 (одно) решение
уравнения Шредингера; n=2
возможно 4 решения уравнения; n=3
возможно 9 решений уравнений; т.е. при n
– возможно n2 решений.
Эти решения – представляют собой:
орбитальные волновые функции, или
орбитали электрона. Орбиталь (“электронное
облако”) – можно представить как
некоторую область вокруг ядра, куда
электрон имеет доступ – но не всегда
её (область) – заполняет. Совокупность
орбиталей – с одинаковым n
называется – уровнем. n
– совпадает с номером периода данного
элемента в таблице Менделеева. Таким
образом, число орбиталей, на уровне:
![]()
Орбитальное
квантовое число “l (эль)”
– характеризует форму электронного
облака (но только – для атома водорода).
Для всех других атомов l
(эль) – характеризует также и энергию.
В этих атомах электроны данного уровня
– группируются в подуровни – разные
по энергии. Каждому значение l
(эль) – соответствует свой энергетический
подуровень. l(эль) –
принимает значение:
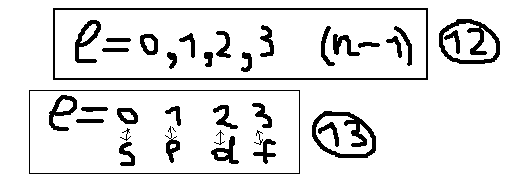 Например:
n=1; l(эль)=0
(s-). Nорб.=12=1
(одна s- орбиталь).
Например:
n=1; l(эль)=0
(s-). Nорб.=12=1
(одна s- орбиталь).
 2)n=2;
l(эль)=0,1 (s-,
и p-). Nорби.=22=4
(одна s-орбиталь + 3p
– орбитали).
2)n=2;
l(эль)=0,1 (s-,
и p-). Nорби.=22=4
(одна s-орбиталь + 3p
– орбитали).![]() -
p-орбиталь.
-
p-орбиталь.
 3)n=3;
l(эль)=0,1,2 (s-,
p-, d-)
Nорб.=32=9 (одна s+3p+5d
орбиталей)
3)n=3;
l(эль)=0,1,2 (s-,
p-, d-)
Nорб.=32=9 (одна s+3p+5d
орбиталей)
![]() 4)n=4;
l(эль)=0,1,2,3 (s-,
p-, d-, f-).
Nорб.=42=16 (1s+3p+5d+7f
орбиталей).
4)n=4;
l(эль)=0,1,2,3 (s-,
p-, d-, f-).
Nорб.=42=16 (1s+3p+5d+7f
орбиталей).
![]() По
энергии: Es<Ep<Ed<Ef.
По
энергии: Es<Ep<Ed<Ef.
Магнитное
квантовой число
![]() – характеризует ориентацию электронного
облака в пространстве – относительно
магнитного поля, и определяет вытянутость
электронного облака – вдоль оси.
Приинимает значение:
– характеризует ориентацию электронного
облака в пространстве – относительно
магнитного поля, и определяет вытянутость
электронного облака – вдоль оси.
Приинимает значение:
![]() =-
=-![]() (минус эль) 0 (ноль)
(плюс эль). Число значение
для
подуровня – равно числу орбиталей для
этого подуровня. а)
=0
(s-);
=0
(минус эль) 0 (ноль)
(плюс эль). Число значение
для
подуровня – равно числу орбиталей для
этого подуровня. а)
=0
(s-);
=0
![]() б)
=1
(p-);
=-1,0,1
б)
=1
(p-);
=-1,0,1
![]() в)
=2
(d-);
=-2,-1,0,1,2
в)
=2
(d-);
=-2,-1,0,1,2
![]()
![]()
Спиновое
квантовое число (ms)
– характеризует внутреннее движение
электрона – спин, и определяет направление
вращения электрона – вокруг собственной
оси. Принимает – только два значения:
ms=1/2,
и -1/2.
 Заполнение орбитали электронами –
определяется 3-мя основными положениями:
а)принципом Паули; б)принципом наименьшей
энергии; в)правилом Гунда.
Заполнение орбитали электронами –
определяется 3-мя основными положениями:
а)принципом Паули; б)принципом наименьшей
энергии; в)правилом Гунда.
