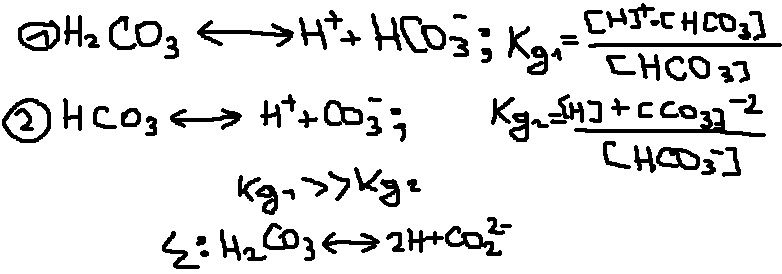- •Ответы к экзамену по Химии:
- •1)Основные химические законы и понятия.
- •2)Строение атомов. Модель атома по Резенфорду, по Бору.
- •3)Волновые свойства электрона. Принцип неопределённости Гейзенберга.
- •4)Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
- •5)Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Порядок заполнения атомных орбиталей электронами.
- •6)Периодический закон д.И. Менделеева. Структура периодической системы.
- •7)Развитие периодического закона. Энергия ионизации, сродство к электрону, электроотрицательность.
- •8)Химическая связь и валентность.
- •9)Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
- •10)Ионная связь. Типы ковалентных молекул.
- •11)Межмолекулярные взаимодействия, их типы, характеристика.
- •12)Донорно-акцепторная связь. Водородная связь.
- •13)Металлическая связь. Структура твёрдых тел.
- •14)Элементы химической термодинамики. Первое начало термодинамики.
- •15)Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствия из него.
- •16)Элементы второго начала термодинамики. Энтропия.
- •17)Энергия Гиббса. Направленность химических процессов.
- •18)Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции.
- •19)Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
- •20)Цепные реакции. Гомогенный катализ.
- •21)Скорость гетерогенных реакций. Гетерогенный катализ.
- •22)Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твёрдых тел, жидкостей в жидкостях.
- •23)Первые и второй закон Рауля. Осмотическое давление. Закон Вант-Гоффа.
- •24)Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
- •25)Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
- •26)Диссоциация воды. Водородный показатель.
- •27)Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей.
- •28)Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов.
- •29)Теория гальванических элементов.
- •30)Уравнение Нернста. Концентрационные гальванические элементы. Поляризация и деполяризация. Элемент Лекланше.
- •31)Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея.
- •32)Электролиз растворов с нерастворимыми электродами. Электролиз расплавов.
- •33)Электролиз растворов с растворимым анодом, его применение: гальваностегия, гальванопластика, электролитическое рафинирование.
- •34)Аккумуляторы. Устройство, принцип действия свинцового аккумулятора.
- •35)Топливные элементы.
- •36)Коррозия металлов. Виды коррозионных разрушений. Электрохимическая коррозия.
- •37)Химическая коррозия. Электрокоррозия. Скорость коррозии.
- •38)Методы защиты металлов от коррозии.
- •39)Классификация металлов. Кристаллическая структура, физические свойства металлов.
- •40)Получение металлов из руд. Способы получения металлов высокой чистоты.
- •41)Общие химический свойства металлов.
- •42)Лёгкие конструкционные материалы. Алюминий. Свойства, получение, применение в технике, важнейшие соединения.
- •43)Медь. Свойства, получение, применение в технике, важнейшие соединения.
- •44)Олово. Железо. Свойства, получение, применение, важнейшие соединения.
- •45)Высокомолекулярные соединения, их виды, способы получения вмс.
- •46)Получение высокомолекулярных веществ с помощью поликонденсации.
- •47)Применение полимеров. Основные полимеры, получаемые полимеризацией.
- •48)Основные полимеры, получаемые поликонденсацией. Фенолоформальдегидные смолы, полиамиды, полиэфирные смолы.
24)Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
Ответ: Однако имеются вещества
растворы которых не подчиняются законом
Рауля и Вант-Гоффа. Это кислоты, основания
и соли, их особенности: 1)они проводят
электрический ток только будучи
растворителем или расплавленными,
поэтому их называют электролитами.
2)для их раствора:
![]() всегда
больше чем это овтечает концентратору
раствора (для не электролитов). Для того,
чтобы распространить законы Рауля и
Вант-Гоффа на рост этих веществ Вант-Гофф
ввёл поправочный коэффициент I
(изотонический коэффициент или коэффициент
Вант-Гоффа).
всегда
больше чем это овтечает концентратору
раствора (для не электролитов). Для того,
чтобы распространить законы Рауля и
Вант-Гоффа на рост этих веществ Вант-Гофф
ввёл поправочный коэффициент I
(изотонический коэффициент или коэффициент
Вант-Гоффа).

Основы теории электролитической
диссоциации: Без водной соли кислота,
основание – электрический ток не
проводят. Почти не проводит ток и чистая
вода. Очевидно, что при растворении в
воде подобные вещества подвергаются
каким-то изменениям, которые обуславливают
электропроводность полученного раствора.
Аррениус в 1887г. Придумал теории
электролитической диссоциации: Молекулы
электролита в воде или других полярных
растворителях распадаются, диссоциируют
на положительно и отрицательно заряженные
ионы, это явление он назвал электролитической
диссоциацией. Положительно заряженные
ионы – катионы: K+
(H+; Na+…).
Отрицательно заряженные ионы – анионы
A- (OH-;
Cl-…). Растворы и
расплавленные электролиты относительно
к проводникам второго рода, электролиты
которые обуславливают наличие: K+,
A-. Однако теории
Аррениуса исключает: возможность
химического взаимодействия ионов с
молекулами раствора, поэтому она не
могла объяснить причину диссоциации,
её движущую силу. Теория Аррениуса
противоречит химической теории Менделеева
в основе которой лежало представление,
только о химическом взаимодействии
молекулярных растворителей вещества
с молекулярным раствором. Это кажущееся
противоречие преодолел И.А. Каблуков
который выдвинул теорию сольватации
ионов. Сольватация – это взаимодействие
ионов электрически с полярными молекулами
электролита. (Если растворитель вода
то процесс называется – гидротацией).
I – показывает во сколько
раз увеличивается число частиц в растворе
в результате происхождения полной или
неполной ионизации вещества.

25)Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
Ответ: Одни электролиты в воде
диссоциируются полностью, а другие
частично и раствор устанавливает
равновесие между ионами и недоссициируемыми
молекулами. Показателем полной диссоциации
является степень диссоциации
![]() :
:
![]() зависит
от природы электролиты от концентрации
и температуры (чем меньше концентрация
и температура, тем
больше).
По величине
электролиты делятся на сильные и слабые.
А)Сильные электролиты: 1 раствор
диссоциируется на ионы полностью. К ним
относятся почти все соли, сильные
кислоты, сильные основания – гидрооксиды,
щелочные металлы (NaOH,
Ca(OH)2.
Процесс диссоциации этих электролитов
не обратим: HCl->H+Cl.
Б)Слабые электролиты: В водном растворе
диссоциируются лишь частично
<1
(100%) и в растворе устанавливается
равновесие между ионами и недиссоциируемыми
молекулами. 1)органические кислоты,
2)слабые неогранические кислоты, 3)слабые
и мало растворённые в воде основании
(NH4OH),
4)мало растворённые в воде соли, 5)вода.
Процесс диссоциации электролита обратим:
зависит
от природы электролиты от концентрации
и температуры (чем меньше концентрация
и температура, тем
больше).
По величине
электролиты делятся на сильные и слабые.
А)Сильные электролиты: 1 раствор
диссоциируется на ионы полностью. К ним
относятся почти все соли, сильные
кислоты, сильные основания – гидрооксиды,
щелочные металлы (NaOH,
Ca(OH)2.
Процесс диссоциации этих электролитов
не обратим: HCl->H+Cl.
Б)Слабые электролиты: В водном растворе
диссоциируются лишь частично
<1
(100%) и в растворе устанавливается
равновесие между ионами и недиссоциируемыми
молекулами. 1)органические кислоты,
2)слабые неогранические кислоты, 3)слабые
и мало растворённые в воде основании
(NH4OH),
4)мало растворённые в воде соли, 5)вода.
Процесс диссоциации электролита обратим:
![]() Между степенью диссоциации
и коэффициентом “I” –
существует соотношение:
Между степенью диссоциации
и коэффициентом “I” –
существует соотношение:
![]() ,
где: n – число электролитов.
,
где: n – число электролитов.

Константа диссоциации слабых электролитов
(Кд): К равновесию которое устанавливает
раствор слабого электролита между
молекулами и ионами можно применить
законы химического равновесия и записать
выражение для константы, равновесия,
которая называется константой диссоциации
(Кд):
![]() Кд
– зависит от природы электролита и
растворителя температуры, но не зависит
от концентрации, чем больше (Кд) тем
легче электролит диссоциируется между
и кд существует соотношением:
Кд
– зависит от природы электролита и
растворителя температуры, но не зависит
от концентрации, чем больше (Кд) тем
легче электролит диссоциируется между
и кд существует соотношением:
![]() Многооснование
кислоты и основание двух валентных
металлов диссоциации ступенчато: H2CO3
Многооснование
кислоты и основание двух валентных
металлов диссоциации ступенчато: H2CO3