
- •Ответы к экзамену по Химии:
- •1)Основные химические законы и понятия.
- •2)Строение атомов. Модель атома по Резенфорду, по Бору.
- •3)Волновые свойства электрона. Принцип неопределённости Гейзенберга.
- •4)Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
- •5)Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Порядок заполнения атомных орбиталей электронами.
- •6)Периодический закон д.И. Менделеева. Структура периодической системы.
- •7)Развитие периодического закона. Энергия ионизации, сродство к электрону, электроотрицательность.
- •8)Химическая связь и валентность.
- •9)Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
- •10)Ионная связь. Типы ковалентных молекул.
- •11)Межмолекулярные взаимодействия, их типы, характеристика.
- •12)Донорно-акцепторная связь. Водородная связь.
- •13)Металлическая связь. Структура твёрдых тел.
- •14)Элементы химической термодинамики. Первое начало термодинамики.
- •15)Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствия из него.
- •16)Элементы второго начала термодинамики. Энтропия.
- •17)Энергия Гиббса. Направленность химических процессов.
- •18)Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции.
- •19)Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
- •20)Цепные реакции. Гомогенный катализ.
- •21)Скорость гетерогенных реакций. Гетерогенный катализ.
- •22)Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твёрдых тел, жидкостей в жидкостях.
- •23)Первые и второй закон Рауля. Осмотическое давление. Закон Вант-Гоффа.
- •24)Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
- •25)Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
- •26)Диссоциация воды. Водородный показатель.
- •27)Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей.
- •28)Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов.
- •29)Теория гальванических элементов.
- •30)Уравнение Нернста. Концентрационные гальванические элементы. Поляризация и деполяризация. Элемент Лекланше.
- •31)Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея.
- •32)Электролиз растворов с нерастворимыми электродами. Электролиз расплавов.
- •33)Электролиз растворов с растворимым анодом, его применение: гальваностегия, гальванопластика, электролитическое рафинирование.
- •34)Аккумуляторы. Устройство, принцип действия свинцового аккумулятора.
- •35)Топливные элементы.
- •36)Коррозия металлов. Виды коррозионных разрушений. Электрохимическая коррозия.
- •37)Химическая коррозия. Электрокоррозия. Скорость коррозии.
- •38)Методы защиты металлов от коррозии.
- •39)Классификация металлов. Кристаллическая структура, физические свойства металлов.
- •40)Получение металлов из руд. Способы получения металлов высокой чистоты.
- •41)Общие химический свойства металлов.
- •42)Лёгкие конструкционные материалы. Алюминий. Свойства, получение, применение в технике, важнейшие соединения.
- •43)Медь. Свойства, получение, применение в технике, важнейшие соединения.
- •44)Олово. Железо. Свойства, получение, применение, важнейшие соединения.
- •45)Высокомолекулярные соединения, их виды, способы получения вмс.
- •46)Получение высокомолекулярных веществ с помощью поликонденсации.
- •47)Применение полимеров. Основные полимеры, получаемые полимеризацией.
- •48)Основные полимеры, получаемые поликонденсацией. Фенолоформальдегидные смолы, полиамиды, полиэфирные смолы.
22)Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твёрдых тел, жидкостей в жидкостях.
Ответ:
Растворимость – это способность
одного вещества растворяться в другом,
количественно растворимость определяется
концентрацией насыщенности раствора.
По растворимости все вещества делятся
на 3 группы: а)легко растворимые >1 в
100 г. H2O;
б)труднорастворимые 1-0,001г в 100 г. H2O;
в)практически нерастворимые <0,001г в
100 г. H2O.
Абсолютно нерастворимых веществ в
природе не существует. Растворимость
газа в жидкости: Увеличивается с
повышением раствора и понижением
температуры T (к). Зависимость
температуры от давления определяется
в Генри. C=K*P.
При постоянной температуре растворимость
t газа в жидкости прямо
пропорционально растворимости газа в
жидкости. Где: С – растворимость (г/л);
P – давление, K
– коэффициент Генри. Растворимость
жидкости в жидкостях: Жидкость в жидкости
может растворяться: а)не ограничено
(спирт+вода); б)ограничено (вода+вино);
в)совсем не растворяет (вода+бензол).
Растворимость твёрдых тел в жидкостях:
Как правило увеличивается с повышением
температуры (t), (но бывают
исключения) и практически не зависит
от p (давления). Для удобства
растворимость твёрдых тел изображают
в виде кривых растворимости:

23)Первые и второй закон Рауля. Осмотическое давление. Закон Вант-Гоффа.
Ответ:
Первый закон Рауля:
 При
растворении какого-либо нелетучего
вещества в растворителе, активная
поверхность испаренная уменьшается
из-за того, что часть её будет занята
молекулами растворителя вещества. В
результате будет уменьшаться испарение
растворителя, а значит будет и уменьшаться
пропорционально давление его парод над
раствором. p0 –
давление паров растворителя над чистым
раствором, p – давление
паров растворителя над раствором, p0-p
- понижение давления насыщенности пара
растворителя над раствором, p-p0
– относительное понижение давления. 1
закон Рауля: относительное понижение
давления насыщенности пара растворителя
над раствором прямо пропорционально
молярной доле раствора вещества:
При
растворении какого-либо нелетучего
вещества в растворителе, активная
поверхность испаренная уменьшается
из-за того, что часть её будет занята
молекулами растворителя вещества. В
результате будет уменьшаться испарение
растворителя, а значит будет и уменьшаться
пропорционально давление его парод над
раствором. p0 –
давление паров растворителя над чистым
раствором, p – давление
паров растворителя над раствором, p0-p
- понижение давления насыщенности пара
растворителя над раствором, p-p0
– относительное понижение давления. 1
закон Рауля: относительное понижение
давления насыщенности пара растворителя
над раствором прямо пропорционально
молярной доле раствора вещества:
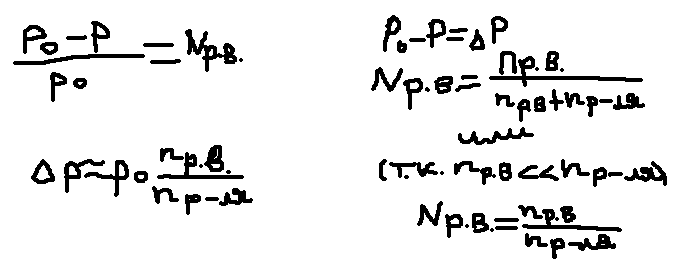 Задача: Расчёт растворимости насыщенности
водяного парад на 9% раствора глюкозы
при 100 OС.
Задача: Расчёт растворимости насыщенности
водяного парад на 9% раствора глюкозы
при 100 OС.
 2
Закон Рауля: Всякая жидкость начинает
кипеть при той температуре, при которой
давление её насыщенности пара достигает
величины внешнего давления (так H2O
при 760 мм. рт. ст. кипит при 100 OC
потому, что при этой температуре давление
её насыщенности пара как раз равна 760
мм. рт. ст). Если растворять в воде
какое-нибудь нелетучее вещество, то
давление её пара понизится (1 закон
Рауля). Чтобы достичь давления пара над
раствором 860 мм. рт.ст. раствор нужно
нагреть до температуры более 100 OС.
Отсюда следует, что растворы всегда
кипят при более высокой температуре,
чем чистый раствор, а замеряют при более
низкой температуре чем чистый раствор.
Повышение температуры кипения:
2
Закон Рауля: Всякая жидкость начинает
кипеть при той температуре, при которой
давление её насыщенности пара достигает
величины внешнего давления (так H2O
при 760 мм. рт. ст. кипит при 100 OC
потому, что при этой температуре давление
её насыщенности пара как раз равна 760
мм. рт. ст). Если растворять в воде
какое-нибудь нелетучее вещество, то
давление её пара понизится (1 закон
Рауля). Чтобы достичь давления пара над
раствором 860 мм. рт.ст. раствор нужно
нагреть до температуры более 100 OС.
Отсюда следует, что растворы всегда
кипят при более высокой температуре,
чем чистый раствор, а замеряют при более
низкой температуре чем чистый раствор.
Повышение температуры кипения:
![]() .
Понижение температуры замерзания:
.
Понижение температуры замерзания:
![]() 2
закон Рауля: повышение температуры
кипения или понижение температуры
кристаллического раствора, прямо
пропорционально молярной концентрации
растворителя вещества:
2
закон Рауля: повышение температуры
кипения или понижение температуры
кристаллического раствора, прямо
пропорционально молярной концентрации
растворителя вещества: ,
где: Кэ – эбулиоскопическая постоянная,
Кк – криоскопическая постоянная.
,
где: Кэ – эбулиоскопическая постоянная,
Кк – криоскопическая постоянная.
 Кэ, Кк – зависят только от природы
растворителя но не зависят от природы
раствора вещества. Для воды: Кэ=0,52 OC;
Кк=1,86 OC.
Примеры: Задача №1: Определить температуру
замерзания антифриза.
Кэ, Кк – зависят только от природы
растворителя но не зависят от природы
раствора вещества. Для воды: Кэ=0,52 OC;
Кк=1,86 OC.
Примеры: Задача №1: Определить температуру
замерзания антифриза.
 Задача №2: При растворении 2,76 гр. Глицерина
в 200 гр. Воды температура замерзания
понизилась на 0,28 OС.
Определить молярную массу глицерина.
Задача №2: При растворении 2,76 гр. Глицерина
в 200 гр. Воды температура замерзания
понизилась на 0,28 OС.
Определить молярную массу глицерина.
![]()
Осмотическое давление. Закон Вант-Гоффа:
Осмос – это диффузия молекулы растворителя
в растворе через полупроникцаемости
перегородку (то есть проницаемости для
молекулы растворителя, но не проницаемости
для молекул раствора вещества). Раствор
сахара в воде:

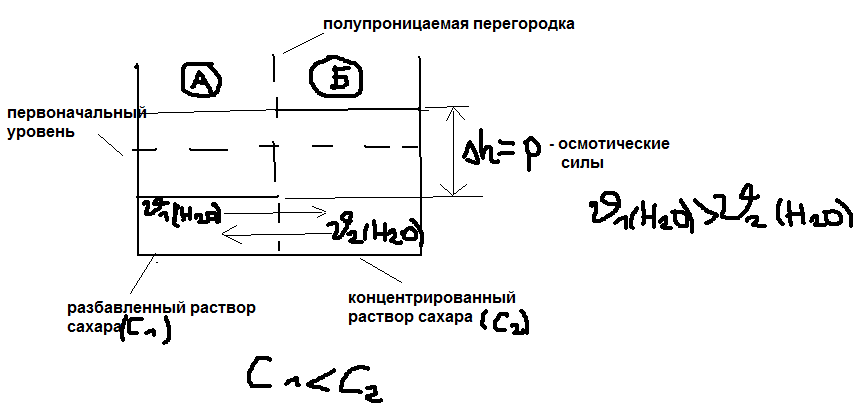 Осмотические силы отнесённые к единицам
площади их действия называются
осмотическим давлением: P/S=Pосм.
Закон Вант-Гофа: Осмотическое давление
равно тому давление, которое оказывал
бы раствор вещества, если бы оно находилось
в газообразном состоянии и занимало
объём раствора.
Осмотические силы отнесённые к единицам
площади их действия называются
осмотическим давлением: P/S=Pосм.
Закон Вант-Гофа: Осмотическое давление
равно тому давление, которое оказывал
бы раствор вещества, если бы оно находилось
в газообразном состоянии и занимало
объём раствора.
 Если: Pосм=атм, V=литры,
Pосм.=мм.рт.ст., V-мл,
R=62400 мм.рт.ст.*мл/моль*К,
то: R=0,082 л*атм/моль*К (чаще
всего). Pосм.=Па, V=м3,
R=8,314 Дж/моль. Пример: Ст=1
моль/л, Pосм.=1*0,082*273=22,4 атм.
Осмос играет большую роль в биологических
процессах обеспечивает поступление
воды в клетки и другие структуры. Растворы
с одинаковым Pосм. Называются
изотоническими. Если Pосм.
1-ми внутриклеточными то называются
гипертоническими, а ниже – гипотоническими.
Гипертонический раствор сахара (сиропы)
и NaCl используются для
консервирования продуктов т.к. вызывают
удаление воды из микроорганизмов, то
есть их обезвоживание и гибель.
Если: Pосм=атм, V=литры,
Pосм.=мм.рт.ст., V-мл,
R=62400 мм.рт.ст.*мл/моль*К,
то: R=0,082 л*атм/моль*К (чаще
всего). Pосм.=Па, V=м3,
R=8,314 Дж/моль. Пример: Ст=1
моль/л, Pосм.=1*0,082*273=22,4 атм.
Осмос играет большую роль в биологических
процессах обеспечивает поступление
воды в клетки и другие структуры. Растворы
с одинаковым Pосм. Называются
изотоническими. Если Pосм.
1-ми внутриклеточными то называются
гипертоническими, а ниже – гипотоническими.
Гипертонический раствор сахара (сиропы)
и NaCl используются для
консервирования продуктов т.к. вызывают
удаление воды из микроорганизмов, то
есть их обезвоживание и гибель.
