
- •Ответы к экзамену по Химии:
- •1)Основные химические законы и понятия.
- •2)Строение атомов. Модель атома по Резенфорду, по Бору.
- •3)Волновые свойства электрона. Принцип неопределённости Гейзенберга.
- •4)Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
- •5)Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Порядок заполнения атомных орбиталей электронами.
- •6)Периодический закон д.И. Менделеева. Структура периодической системы.
- •7)Развитие периодического закона. Энергия ионизации, сродство к электрону, электроотрицательность.
- •8)Химическая связь и валентность.
- •9)Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
- •10)Ионная связь. Типы ковалентных молекул.
- •11)Межмолекулярные взаимодействия, их типы, характеристика.
- •12)Донорно-акцепторная связь. Водородная связь.
- •13)Металлическая связь. Структура твёрдых тел.
- •14)Элементы химической термодинамики. Первое начало термодинамики.
- •15)Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствия из него.
- •16)Элементы второго начала термодинамики. Энтропия.
- •17)Энергия Гиббса. Направленность химических процессов.
- •18)Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции.
- •19)Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
- •20)Цепные реакции. Гомогенный катализ.
- •21)Скорость гетерогенных реакций. Гетерогенный катализ.
- •22)Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твёрдых тел, жидкостей в жидкостях.
- •23)Первые и второй закон Рауля. Осмотическое давление. Закон Вант-Гоффа.
- •24)Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
- •25)Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
- •26)Диссоциация воды. Водородный показатель.
- •27)Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей.
- •28)Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов.
- •29)Теория гальванических элементов.
- •30)Уравнение Нернста. Концентрационные гальванические элементы. Поляризация и деполяризация. Элемент Лекланше.
- •31)Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея.
- •32)Электролиз растворов с нерастворимыми электродами. Электролиз расплавов.
- •33)Электролиз растворов с растворимым анодом, его применение: гальваностегия, гальванопластика, электролитическое рафинирование.
- •34)Аккумуляторы. Устройство, принцип действия свинцового аккумулятора.
- •35)Топливные элементы.
- •36)Коррозия металлов. Виды коррозионных разрушений. Электрохимическая коррозия.
- •37)Химическая коррозия. Электрокоррозия. Скорость коррозии.
- •38)Методы защиты металлов от коррозии.
- •39)Классификация металлов. Кристаллическая структура, физические свойства металлов.
- •40)Получение металлов из руд. Способы получения металлов высокой чистоты.
- •41)Общие химический свойства металлов.
- •42)Лёгкие конструкционные материалы. Алюминий. Свойства, получение, применение в технике, важнейшие соединения.
- •43)Медь. Свойства, получение, применение в технике, важнейшие соединения.
- •44)Олово. Железо. Свойства, получение, применение, важнейшие соединения.
- •45)Высокомолекулярные соединения, их виды, способы получения вмс.
- •46)Получение высокомолекулярных веществ с помощью поликонденсации.
- •47)Применение полимеров. Основные полимеры, получаемые полимеризацией.
- •48)Основные полимеры, получаемые поликонденсацией. Фенолоформальдегидные смолы, полиамиды, полиэфирные смолы.
19)Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
Ответ:
Изучив более 4 тысяч реакций Вант-Гофф
выявил правило: При неизменной концентрации
скорость большей химической реакции
увеличивается в 2-4 раза при повышении
температуры на каждые 10 OС.
 Пример 1: Некоторые реакции при 0 OC
протекают со скоростью 1 моль/литр. Какой
она будет при 100 OС?
Пример 1: Некоторые реакции при 0 OC
протекают со скоростью 1 моль/литр. Какой
она будет при 100 OС?
 Удобно пользоваться не скоростью, а
временем реакции, а т.к. время обратно
пропорционально скорости, то выражение
(1) можно записать:
Удобно пользоваться не скоростью, а
временем реакции, а т.к. время обратно
пропорционально скорости, то выражение
(1) можно записать:
![]() .
Пример 2: При 120 OС
некоторая реакция закончилась за 10 мин,
за какое время оно закончится если её
проводить при 150 OС
(Y=2).
.
Пример 2: При 120 OС
некоторая реакция закончилась за 10 мин,
за какое время оно закончится если её
проводить при 150 OС
(Y=2).
 В чём причина такого резкого возрастания
скорости при увеличении температуры.
Причина заключается в том, что с повышением
температуры возрастает число молекул
обладающих энергией превышающую. Eакт,
хотя общее число молекул остаётся
неизменным. Зависимость константы от
температуры определяется по формуле:
В чём причина такого резкого возрастания
скорости при увеличении температуры.
Причина заключается в том, что с повышением
температуры возрастает число молекул
обладающих энергией превышающую. Eакт,
хотя общее число молекул остаётся
неизменным. Зависимость константы от
температуры определяется по формуле:
![]() ,
где: A – предэкспоненционеный
множитель (учитывающий число соударения
молекул).
,
где: A – предэкспоненционеный
множитель (учитывающий число соударения
молекул).
Химическое
равновесие в гомогенных системах:
Отмеченные выше все реакции делятся
на: 1)необратимые – могут быть доведены
или самопроизвольно доходят до конца
(когда полностью расходуется одно из
исходных веществ):
![]() 2)обратимые
– это реакции одновременно протекающие
в двух противоположных направлениях
при данных условиях:
2)обратимые
– это реакции одновременно протекающие
в двух противоположных направлениях
при данных условиях:
 При неизменной концентрации: К1/K2=const.
При неизменной концентрации: К1/K2=const.
![]() ,
где: кр – константа равновесия –
она не зависит от концентрации, но
зависит от tO
и p. Выражение для кp
записывают только концентрацию
газообразных, парообразных и растворимых
веществ, а концентрация жидких, твёрдых
– не учитывают т.к. их концентрация в
процессе реакции практически не меняется.
Пример:
,
где: кр – константа равновесия –
она не зависит от концентрации, но
зависит от tO
и p. Выражение для кp
записывают только концентрацию
газообразных, парообразных и растворимых
веществ, а концентрация жидких, твёрдых
– не учитывают т.к. их концентрация в
процессе реакции практически не меняется.
Пример:
 Если:
Kp>1 – преобладает прямая
реакция; Kp<1 – преобладает
обратная реакция; Kp=1 –
равновесие.
Если:
Kp>1 – преобладает прямая
реакция; Kp<1 – преобладает
обратная реакция; Kp=1 –
равновесие.
Принцип
Ле-Шателье (1884 г.): Если на систему
находящуюся в равновесии подействовать
из вне (то есть изменить или концентрацию
или температуру или давление), то
равновесие смещается в сторону той
реакции, которая препятствует этому
воздействию (то есть в системе возникают
процессы уменьшенного внешнего
воздействия).
![]() а)влияние изменений с (Т и P=const).
При увеличении концентрации сходного
начального продукта – равновесие
смещается в сторону образования конечного
продукта и наоборот. б)влияние изменения
температуры T (C
и P=const). При
повышении T равновесие
смещается в сторону эндотермической
реакции, а при понижении – в сторону
экзотермической. В)влияние изменения
P (C и T=const).
При увеличении P путём
сжатия системы равновесие смещается в
сторону реакции идущей с пониженным
давлением т.е. в сторону меньшего числа
молекул газообразных и парообразных
веществ и наоборот. Концентрация жидких
и твёрдых веществ не учитываются т.к.
они – не сжимаются.
а)влияние изменений с (Т и P=const).
При увеличении концентрации сходного
начального продукта – равновесие
смещается в сторону образования конечного
продукта и наоборот. б)влияние изменения
температуры T (C
и P=const). При
повышении T равновесие
смещается в сторону эндотермической
реакции, а при понижении – в сторону
экзотермической. В)влияние изменения
P (C и T=const).
При увеличении P путём
сжатия системы равновесие смещается в
сторону реакции идущей с пониженным
давлением т.е. в сторону меньшего числа
молекул газообразных и парообразных
веществ и наоборот. Концентрация жидких
и твёрдых веществ не учитываются т.к.
они – не сжимаются.
20)Цепные реакции. Гомогенный катализ.
Ответ:
Цепные реакции – это такие реакции,
в которых одна активная частица может
вызвать не одно химическое взаимодействие,
а несколько, передать свою энергию
возбуждённым другим частицам. Активный
частицы могут быть: а)возбуждённый атом;
б)ион; в)радикалы (осколки молекул имеющих
холостые электроны). Разберём цепные
реакции на примере: H2+Cl2=2HCl.
В закрытом затемнённом сосуде смесь H2
и Cl2 может
находиться бесконечно долго не реагируя
между собой. Однако если в сосуде ввести
небольшое количество паров Na,
как реакция начнёт протекать в форме
взрыва (по цепному механизму). Цепные
реакции протекают в три стадии: 1)в начале
реакции зарождения цепи; 2)рост цепи;
3)обрыв цепи. 1)Начало цепи: Сl2+Na->NaCl+Cl*.
Очень аткивный атом Na
реагирующий с молекулой Cl
при этом освобождается активный атом
Cl. 2)Рост цепи: ClO+H2->HCl+HO;
HO+Cl2->HCl+ClO;
ClO+H2->HCl+HO;
…………………. Активный атом Cl
взаимодействуя с молекулой H2
образуется HCl и высвобождает
активный атом HO,
который реагирует с молекулой Cl
и высвобождает активный атом ClO
и т.д. 3)Обрыв цепи: Происходит при
исчезновении активного центра, который
может потерять свою избыточную энергию
в следующих случаях: 1)столкновение
активной частицы друг с другом
(самоуничтожение).
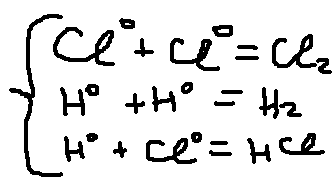 2)Столкновение
со стенкой. Активный части ударяются
об стенку передавая свою избыточную
энергию молекулам стенки. 3)Столкновение
с частицами примесей не вступающих в
реакцию. Пример: антидетанационных
добавление в моторное топливо:
2)Столкновение
со стенкой. Активный части ударяются
об стенку передавая свою избыточную
энергию молекулам стенки. 3)Столкновение
с частицами примесей не вступающих в
реакцию. Пример: антидетанационных
добавление в моторное топливо:

Гомогенный
катализ: Катализ – это явление изменения
скорости химической реакции под действием
вещества называемое катализ. Катализатор
– это вещество изменяющее скорость
реакции, но само после реакции остающееся
без изменения. Катализ бывает:
1)положительный (приводит к ускорению
реакции); 2)отрицательный (приводит к
замедлению реакции). Различают следующие
типы катализа: 1)Гомогенный – катализ
и реагенты находятся в одной фазе (ж+ж,
г+г); 2)Гетерогенный – катализ и реагенты
находятся в разных фазах (г+т, ж+г);
3)биокатализ – протекает в растительном
и животном мире под действием ферментов,
катализ белкового происхождения. В
большинстве случаев действие катализа
объясняется тем, что он снижает Eактивации,
в результате чего молекулярная энергия
которая была недостаточна для результата
столкновения, становится активными.
А)Гомогенный катализ – он осуществляется
через промежуточные реакции с катализатором
в результате чего происходит замена
одной медленной реакции (с высокой Eапт)
несколькими у которых Eапт
меньше, то есть скорость выше. Пример:
A+B=AB.

