
- •2.Возбудитель коклюша и паракоклюша. Характеристика, принципы диагностики, специфическая профилактика. Возбудитель Коклюша
- •Диагностика коклюша и паракоклюша
- •Профилактика коклюша и паракоклюша
- •Что происходит?
- •Диагностика и лечение
- •Определение герпес-вирусных инфекций.
- •Актуальность герпес-вирусных инфекций.
- •Характеристика возбудителей герпес-вирусных инфекций.
- •Основные проявления эпидемического процесса герпес-вирусных инфекций.
- •Общая характеристика патогенеза и клинических проявлений герпес-вирусных инфекций.
- •Простой герпес новорожденных.
- •Врожденный простой герпес.
- •Диагностика герпес-вирусных инфекций.
- •Профилактика герпес-вирусных инфекций.
- •Лечение герпес-вирусных инфекций.
- •Что происходит?
- •Диагностика и лечение
- •Профилактика
- •Определение сибирской язвы.
- •Актуальность сибирской язвы.
- •Характеристика возбудителя сибирской язвы.
- •Основные проявления эпидемического процесса сибирской язвы.
- •Патоморфогенез сибирской язвы.
- •Клиника, классификация сибирской язвы:
- •Диагностика сибирской язвы.
- •Лечение сибирской язвы.
- •Профилактика сибирской язвы.
- •Характеристика возбудителя
- •Симптомы вирусного гепатита в
- •Диагностика вирусного гепатита в
- •Лечение вирусного гепатита в
- •Прогноз при вирусном гепатите в
- •Профилактика вирусного гепатита в
- •Источники заражения
- •Чем это проявляется?
- •Диагностика
Диагностика коклюша и паракоклюша
Используется клинико-эпидемиологический принцип; посевы слизи из зева — метод «кашлевых пластинок», «заглоточный тампон». В качеств экспресс-диагностики используют иммунофлюоресцентный метод, позвояющий обнаружить возбудителя коклюша непосредственно в мазках из слизи носоглотки практически у всех больных в начале заболевания. Серодиагностика - используй РА, РСК, РПГА, имеют значение для ретроспективной диагностики, часто отрицательны у детей первых 2 лет жизни. Первую сыворотку надо брать не позже 3 недели заболевания, 2-ю — через 1-2 недели.
Профилактика коклюша и паракоклюша
Своевременное проведение противоэпидемических мероприятий:
пациент изолируется на 30 дней или 25 дней при наличии 2-х отрицательных результатов с 15 дня болезни;
дети до 7 лет, бывшие в контакте и не болевшие, разобщаются в течении 14 дней с момента контакта.
при множественных случаях в детском учреждении — перевод на круглосуточное пребывание.
Активная иммунизация АКДС по календарю. Эффективность заметна после 60% охвата, но особенно после 96%. Ранняя изоляция первого случая предотвращает вспышку. При заносе коклюша в школы изолируется только первый заболевший, а при возникновении других случаев болезни изоляция проводится только по клиническим показаниям. Роль иммунопрофилактики важна, но относительно, так как: сохраняется сезонность; периодичность подъемов в очагах, и очаговость; не распознанные и атипичные случаи болезни.
3. Гонококки. Характеристика, принципы диагностики гонореи. Гонококки (лат. Neisseria gonorrhoeae) — вид грамотрицательных диплококков рода Neisseria. Вызывают гонорею — антропонозную венерическую инфекцию, характеризующуюся гнойным воспалением слизистых оболочек, чаще мочеполовой системы.
Нейссерии – грамотрицательные аэробные кокки, относящиеся к роду Neisseria, включающему 8 видов: Neisseria meningitidis, Neisseria gonorrhoeae, N. flava, N. subflava, N. perflava, N. sicca.
Морфология: неподвижные неспорогенные грамотрицательные диплококки, образующие капсулу, полиморфны – встречаются в виде мелких или крупных форм а так же в виде палочек, хорошо окрашиваются анилиновыми красителями (метиленовым синим, бриллиантовым зелёным и т. д.), под действием пенициллина образуют L-формы, могут менять свойства и превратиться в грамположительную форму.
Культуральные свойства: аэробы, хемоорганотрофы; для роста требуют свежеприготовленные влажные среды с добавлением нативных белков крови, сыворотки или асцитической жидкости. Не вызывают гемолиза на средах, содержащих кровь; на средах с добавлением молока, желатина и картофеля не растут. На плотных питательных средах через 24ч, при содержании протеина II образуют слегка мутные бесцветные колонии, не содержащие его образуют круглые прозрачные колонии в виде капель росы, на жидких питательных средах растут диффузно и образуют плёнку, через несколько часов оседающую на дно.
Биохимическая активность: крайне низкая – разлагают только глюкозу, продуцируют каталазу и цитохромоксидазу, протеолитическая активность отсутствует, H2S, аммиака, индола не образует.
Антигенная структура: Содержит А и К антигены, ЛПС обладают сильной иммуногенностью, основную антигенную нагрузку несут пили и белки мембраны. Наружная мембрана содержит протеины I, II, III классов, проявляющих сильные иммуногеннные свойства
Факторы патогенности: капсула, пили, эндотоксин, белки мембраны
Капсула обладает антифагоцитарным действием. Пили обеспечивают адгезию к эпителию. Клеточная стенка содержит эндотоксин. Поверхностный белок I класса – обеспечивает устойчивость к бактерицидным факторам слизистых оболочек. Класса II – (протеины мутности, ОРА-протеины) обуславливают прикрепление к эпителию, препятствуют фагоцитозу. N. синтезируют IgA протеазу, расщепляющую Ig.
Резистентность: очень неустойчивы в окружающей среде, чувствительны к действию антисептиков, высокочувствительны к пенициллинам, тетрациклину, стрептомицину. Способны к утилизации пенициллинов при приобретении бета-лактамаз.
Патогенез: Входные ворота – цилиндрический эпителий мочеполовых путей. Гонококки прикрепляются к эпителию посредством поверхностных белков, вызывают гибель и слущивание клеток, захватываются клетками, где размножаются, попадают на БМ, после чего попадают на соед. ткань и вызывают воспаление или попадают в кровь с возможным дессиминированием.
Иммунитет – почти отсутствует.
Микробиологическая диагностика:
Бактериоскопическое исследование: Материалом для исследования служит гнойное отделяемое из уретры, влагалища, примой кишки, глотки, сыворотки крови. Готовят мазки, окраска по Граму, При «+» результате – обнаруживают гонококки – грам- диплококки бобовидной формы., находятся внутри лейкоцитов. Положительный диагноз ставится при острой форме гонореи до применения антибиотиков.
Бактериологическое исследование. Материал засевают на чашки Петри со специальными питательными средами — КДС, сывороточным агаром. Среда КДС содержит питательный агар с добавлением в определенной концентрации казеина, дрожжевого экстракта и сыворотки крови. Посевы инкубируют при 37°С в течение 24—72 ч. Гонококки образуют круглые прозрачные колонии, напоминающие капли росы, в отличие от более мутных колоний стрептококков или пигментированных колоний стафилококков, которые также могут расти на этих средах. Подозрительные колонии пересевают в пробирки на соответствующие среды для получения чистых культур, которые идентифицируют по сахаролитическим свойствам на средах «пестрого» ряда (полужидкий агар с сывороткой и углеводом). Гонококк ферментирует только глюкозу с образованием кислоты.
Серодиагностика. В некоторых случаях ставят РСК Борде — Жангу. В качестве антигена используют взвесь убитых гонококков. Реакция Борде—Жангу имеет вспомогательное значение при диагностике гонореи. Она положительна при хронической и осложненной гонорее.
Лечение: антибиотикотерапия (пенициллин, тетрациклин, канамицин), иммунотерапия. Гонококковая вакцина - взвесь гонококков, убитых нагреванием, используется для вакцинотерапии хронической гонореи.
4. Менингококк. Характеристика, принципы диагностики. Менингококковая инфекция — острая инфекционная болезнь, характеризующаяся поражением слизистой оболочки носоглотки, оболочек головного мозга и септицемией; антропоноз.
Таксономия: возбудитель Neisseria meningitidis (менингококк) относится к отделу Gracilicutes, семейству Neisseriaceae, роду Neisseria.
Морфологические свойства. Мелкие диплококки. Характерно расположение в виде пары кофейных зерен, обращенных вогнутыми поверхностями друг к другу. Неподвижны, спор не образуют, грамотрицательные,имеют пили, капсула непостоянна.
Культуральные свойства. Относятся к аэробам, культивируются на средах, содержащих нормальную сыворотку или дефибринированную кровь лошади, растут на искусственных питательных средах, содержащих специальный набор аминокислот. Элективная среда должна содержать ристомицин. Повышенная концентрация СО2 в атмосфере стимулирует рост менингококков.
Антигенная структура: Имеет несколько АГ: родовые, общие для рода нейссерии (белковые и полисахаридные, которые представлены полимерами аминосахаров и сиаловых кислот); видовой (протеиновый);группоспецифические (гликопротеидный комплекс); типоспецифические (белки наружной мембраны), которые разграничивают серотипы внутри серогрупп В и С. По капсульным АГ выделяют девять серогрупп (А, В, С,D, X, Y, Z, W135 и Е). Капсульные АГ некоторых серогрупп иммуногенны для человека. Штаммы серогруппы А вызывают эпидемические вспышки. В, С и Y - спорадические случаи заболевания. На основании различий типоспецифических АГ выделяют серотипы, которые обозначают арабскими цифрами (серотипы выявлены в серогруппах В, С, Y, W135). Наличие АГ серотипа 2 рассматривается как фактор патогенности. Во время эпидемий преобладают менингококки групп А и С, которые являются наиболее патогенными.
Биохимическая активность: низкая. Разлагает мальтозу и глюк. до кислоты, не образует индол и сероводород. Ферментация глюк. и мальтозы – диф.-диагностический признак. Не образует крахмалоподобный полисахарид из сахарозы. Обладает цитохромоксидазой и каталазой. Отсутствие β-галактозидазы, наличие γ-глютаминтрансферазы.
Факторы патогенности: капсула – защищает от фагоцитоза. AT, образующиеся к полисахаридам капсулы, проявляют бактерицидные свойства. Токсические проявления менингококковой инфекции обусловлены высокотоксичным эндотоксином. Для генерализованных форм менингококковой инфекции характерны кожные высыпания, выраженное пирогенное действие, образование AT. Пили, белки наружной мембраны,наличие гиалуронидазы и нейраминидазы. Пили являются фактором адгезии к слизистой оболочке носоглотки и тканях мозговой оболочки. Менингококки выделяют IgA-протеазы, расщепляющие молекулы IgA, что защищает бактерии от действия Ig.
Резистентность. Малоустойчив во внешней среде, чувствителен к высушиванию и охлаждению. В течение нескольких минут погибает при повышении температуры более 50 °С и ниже 22 °С. Чувствительны к пенициллинам, тетрациклинам, эритромицину, устойчивы к ристомицину и сульфамидам. Чувствительны к 1 % раствору фенола, 0,2 % раствору хлорной извести, 1 % раствору хлорамина.
Эпидемиология, патогенез и клиника. Человек — единственный природный хозяин менингококков. Носоглотка служит входными воротами инфекции, здесь возбудитель может длительно существовать, не вызывая воспаления (носительство). Механизм передачи инфекции от больного или носителя воздушно-капельный.
Инкубационный период составляет 1—10 дней (чаще 2—3 дня). Различают локализованные (назофарингит) и генерализованные (менингит, менингоэнцефалит) формы менингококковой инфекции. Из носоглотки бактерии попадают в кровяное русло (менингококкемия) и вызывают поражение мозговых и слизистых оболочек с развитием лихорадки, геморрагической сыпи, воспаления мозговых оболочек.
Иммунитет. Постинфекционный иммунитет при генерализованных формах болезни стойкий, напряженный.
Микробиологическая диагностика: Материал для исследования - кровь, спинномозговая жидкость, носоглоточные смывы.
Бактериоскопический метод – окраска мазков из ликвора и крови по Граму для определения лейкоцитарной формулы, выявления менингококков и их количества. Наблюдают полинуклеарные лейкоциты, эритроциты, нити фибрина, менингококки – грам«-», окружены капсулой.
Бактериологический метод – выделение чистой культуры. Носоглоточная слизь, кровь, ликвор. Посев на плотные, полужидкие питательные среды, содержащие сыворотку, кровь. Культуры инкубируют в течение 20 ч. При 37С с повышенным содержанием СО2. Оксидазаположительные колонии – принадлежат в данному виду. Наличие N.meningitidis подтверждают образованием уксусной кислоты при ферментации глюк. и мальтозы. Принадлежность к серогруппам – в реакции агглютинации (РА).
Серологический метод – используют для обнаружения растворимых бактериальных АГ в ликворе, или АТ в сыворотке крови. Для обнаружения АГ применяют ИФА, РИА. У больных, перенесших менингококк – в сыворотке специфические АТ: бактерицидные, агглютинины, гемагглютинины.
Лечение. В качестве этиотропной терапии используют антибиотики - бензилпенициллин (пенициллины, левомицетин, рифампицин), сульфамиды.
Профилактика. Специфическую профилактику проводят менингококковой химической полисахаридной вакциной серогруппы А и дивакциной серогрупп А и С по эпидемическим показаниям. Неспецифическая профилактика сводится к соблюдению санитарно-противоэпидемического режима в дошкольных, школьных учреждениях и местах постоянного скопления людей.
5 Возбудители брюшного тифа и паратифов. Характеристика, принципы диагностики. Брюшной тиф и паратифы А и В — острые кишечные инфекции, характеризующиеся поражением лимфатического аппарата кишечника, выраженной интоксикацией. Их возбудителями являются соответственноSalmonella typhi, Salmonella paratyphi А и Salmonella schottmuelleri.
Таксономическое положение. Возбудители брюшного тифа и паратифов А и В относятся к отделу Gracilicutes, семейству Enterobacteriaceae, роду Salmonella.
Морфологические и тинкториальные свойства. Сальмонеллы — мелкие грамотрицательные палочки с закругленными концами. В мазках располагаются беспорядочно. Не образуют спор, имеют микрокапсулу, перитрихи.
Культуральные свойства. Сальмонеллы — факультативные анаэробы. Оптимальными для роста являются температура 37С. Растут на простых питательных средах. Элективной средой для сальмонелл является желчный бульон.
Биохимическая активность сальмонелл достаточно высока, но они не сбраживают лактозу. S.typhi менее активна, чем возбудители паратифов.
Антигенные свойства и классификация. Сальмонеллы имеют О- и H-антигены, состоящие из ряда фракций. Каждый вид обладает определенным набором антигенов. Все виды сальмонелл, имеющие общую так называемую групповую фракцию О-антигена, объединены в одну группу. Таких групп в настоящее время насчитывается около 65. S.typhi и некоторые другие сальмонеллы имеют Vi-антиген (разновидность К-антигена), с этим антигеном связывают вирулентность бактерий, их устойчивость к фагоцитозу.
Факторы патогенности. Сальмонеллы образуют эндотоксин, обладающий энтеротропным, нейротропным и пирогенным действием. С белками наружной мембраны связаны адгезивные свойства, наличие микрокапсулы обусловливает устойчивость к фагоцитозу.
Резистентность. Сальмонеллы довольно устойчивы к низкой т-ре. Очень чувствительны к дезинфицирующим веществам, высокой температуре, ультрафиолетовым лучам. В пищевых продуктах (мясе, молоке) сальмонеллы могут не только долго сохраняться, но и размножаться.
Эпидемиология. Брюшной тиф и паратиф А — антропонозные инфекции; источником заболевания являются больные люди и бактерионосители. Источником паратифа В могут быть также сельскохозяйственные животные. Механизм заражения фекально-оральный. Среди путей передачи преобладает водный.
Патогенез. Возбудители попадают в организм через рот, достигают тонкой кишки, где в ее лимфатических образованиях размножаются и затем попадают в кровь (стадия бактериемии). С током крови они разносятся по всему организму, внедряясь в паренхиматозные органы (селезенку, печень, почки, костный мозг). При гибели бактерий освобождается эндотоксин, вызывающий интоксикацию. Из желчного пузыря, где С. могут длительно сохраняться, они вновь попадают в те же лимфатические образования тонкой кишки. В результате повторного поступления С. может развиться аллергическая реакция, проявляющаяся в виде воспаления, а затем некроза лимфатических образований. Сальмонеллы выводятся из организма с мочой и калом.
Клиника. Клинически брюшной тиф и паратифы неразличимы. Инкубационный период составляет 12 дней. Болезнь начинается остро: с повышения температуры тела, появления слабости, утомляемости; нарушаются сон и аппетит. Для брюшного тифа характерны помутнение сознания, бред, галлюцинации, сыпь. Очень тяжелыми осложнениями являются прободение стенки кишки, перитонит, кишечное кровотечение, возникающие в результате некроза лимфатических образований тонкой кишки.
Иммунитет. После перенесенной болезни иммунитет прочный и продолжительный.
Микробиологическая диагностика. Основной метод диагностики — бактериологический: посев и выделение S. typhi из крови (гемокультура), фекалий (копрокультура), мочи (уринокультура), желчи, костного мозга. РИФ для обнаружения антигена возбудителя в биологических жидкостях. Серологический метод обнаружения О- и Н- антител в РПГА. Бактерионосителей выявляют по обнаружению Vi-антител в сыворотке крови с помощью РПГА и положительному результату бактериологического; выделения возбудителя. Для внутривидовой идентификации применяют фаготипирование.
Лечение. Антибиотики. Иммуноантибиотикотерапия.
Профилактика. Санитарно-гигиенические мероприятия. Вакцинация - брюшнотифозная химическая и брюшнотифозная спиртовая вакцина, обогащенная Vi-антигеном. Для экстренной профилактики - брюшнотифозный бактериофаг.
6. Шигеллы. Классификация. Характеристика, принципы диагностики, специфическая профилактика. Шигеллы (лат. Shigella) — род грамотрицательных палочковидных бактерий, не образующих спор. По происхождению близки к Escherichia coli иSalmonella. Для человека и приматов являются возбудителями болезней из группы шигеллёзов[1].
Своё научное название, Shigella, род получил в честь Киёси Сиги (1871—1951), японского врача и микробиолога, впервые выделившего возбудителя бактериальной дизентерии.
Род Shigella включает 4 вида: S. dysenteriae — 12 сероваров, S.flexneri — 9 сероваров, S. boydii — 18 сероваров, S. sonnei — 1 серовар.
Морфология. Шигеллы представлены неподвижными палочками. Спор и капсул не образуют.
Культуральные свойства. Хорошо культивируются на простых питательных средах. На плотных средах образуют мелкие гладкие, блестящие, полупрозрачные колонии; на жидких — диффузное помутнение. Жидкой средой обогащения является селенитовый бульон. У S. sonnei отмечена при росте на плотных средах S-R-диссоциация.
Биохимическая активность: слабая; отсутствие газообразования при ферментации глюкозы, отсутствие продукции сероводорода, отсутствие ферментации лактозы.
Резистентность. Наиболее неустойчив во внешней среде вид S. dysenteriae. Шигеллы переносят высушивание, низкие температуры, быстро погибают при нагревании. S. sonnei в молоке способны не только длительно переживать, но и размножаться. У S. dysenteriae отмечен переход в некультивируемую форму.
Антигенная структура. Соматический О-антиген, в зависимости от строения которого происходит их подразделение на серовары, a S. flexneri внутри сероваров подразделяется на подсеровары. S. sonnei обладает антигеном 1-й фазы, который является К-антигеном.
Факторы патогенности. Способность вызывать инвазию с последующим межклеточным распространением и размножением в эпителии слизистой толстого кишечника. Функционирование крупной плазмиды инвазии, которая имеется у всех 4 видов шигелл. Плазмида инвазии детерминирует синтез белков, входящих в состав наружной мембраны, которые обеспечивают процесс инвазии слизистой. Продуцируют шига и шигаподобные белковые токсины. Эндотоксин защищает шигеллы от действия низких значений рН и желчи.
Эпидемиология: Заболевания - шигеллезы, антропонозы с фекально-оральным механизмом передачи. Заболевание, вызываемое S. dysenteriae, имеет контактно-бытовой путь передачи. S. flexneri — водный, a S. sonnei — алиментарный.
Патогенез и клиника: Инфекционные заболевания, характеризующиеся поражением толстого кишечника, с развитием колита и интоксикацией.
Шигеллы взаимодействуют с эпителием слизистой толстой кишки. Прикрепляясь инвазинами к М-клеткам, шигеллы поглощаются макрофагами. Взаимодействие шигелл с макрофагами приводит к их гибели, следствием чего является выделение ИЛ-1, который инициирует воспаление в подслизистой. При гибели шигелл происходит выделение шига токсинов, действие которых приводит к появлению крови в испражнениях.
Иммунитет. Секреторные IgA, предотвращающие адгезию, и цитотоксическая антителозависимая активность лимфоцитов.
Микробиологическая диагностика.
Бактериологический: материалом для исследования - испражнения. Для посева отбираются гнойно-кровяные образования из кала, которые при диагностике заболевания высеваются на лактозосодержащие дифференциальные питательные плотные среды. В случае выявления бактерионосителей посев испражнений проводится в селенитовый бульон с выделением возбудителя на плотных лактозосодержащих дифференциальных питательных средах. Среди выросших на этих средах отбирают лактозонегативные колонии, которые идентифицируют до вида и серовара, а выделенные культуры S. flexneri — до подсероваров, S.sonnei — до хемоваров. В качестве вспомогательного используют серологический метод с постановкой РНГА.
Лечение и профилактика: Для лечения - бактериофаг орального применения, антибиотики после определения антибиотикограммы; в случае возникновения дисбактериоза — препараты пробиотиков для коррекции микрофлоры. Не специфическая профилактика.
7. Возбудители эшерихиозов. Характеристика. Роль кишечной палочки в норме и патологии. Микробиологическая диагностика эшерихиозов. Эшерихиозы - инфекционные болезни, возбудителем которых является Escherichia coli.
Различают энтеральные (кишечные) и парентеральные эшерихиозы. Энтеральные эшерихиозы — острые инфекционные болезни, характеризующиеся преимущественным поражением ЖКТ. Они протекают в виде вспышек, возбудителями являются диареегенные штаммы E.coli. Парентеральные эшерихиозы — болезни, вызываемые условно-патогенными штаммами E.coli — представителями нормальной микрофлоры толстой кишки. При этих болезнях возможно поражение любых органов.
Таксономическое положение. Возбудитель — кишечная палочка — основной представитель рода Escherichia, семейства Enterobacteriaceae, относящегося к отделу Gracilicutes.
Морфологические и тинкториальные свойства. E. coli — это мелкие грамотрицательные палочки с закругленными концами. В мазках они располагаются беспорядочно, не образуют спор, перитрихи. Некоторые штаммы имеют микрокапсулу, пили.
Культуральные свойства. Кишечная палочка — факультативный анаэроб, оптим. темп. для роста - 37С. E. coli не требовательна к питательным средам и хорошо растет на простых средах, давая диффузное помутнение на жидких и образуя колонии на плотных средах. Для диагностики эшерихиозов используют дифференциально-диагностические среды с лактозой — Эндо, Левина.
Ферментативная активность. E. coli обладает большим набором различных ферментов. Наиболее отличительным признаком E. coli является ее способность ферментировать лактозу.
Антигенная структура. Кишечная палочка обладает соматическим О-, жгутиковым Н- и поверхностным К-антигенами. О-антиген имеет более 170 вариантов, К-антиген — более 100, Н-антиген — более 50. Строение О-антигена определяет принадлежность к серогруппе. Штаммы E. coli, имеющие присущий им набор антигенов (антигенную формулу), называются серологическими вариантами (серовары).
По антигенным, токсигенным, свойствам различают два биологических варианта E. coli: 1) условно-патогенные кишечные палочки; 2) «безусловно» патогенные, диареегенные.
Факторы патогенности. Образует эндотоксин, обладающий энтеротропным, нейротропным и пирогенным действием. Диареегенные эшерихии продуцируют экзотоксин вызывающий значительное нарушение водно-солевого обмена. Кроме того, у некоторых штаммов, как и возбудителей дизентерии, обнаруживается инвазивный фактор, способствующий проникновению бактерий внутрь клеток. Патогенность диареегенных эшерихий - в возникновении геморрагии, в нефротоксическом действии. К факторам патогенности всех штаммов E.coli относятся пили и белки наружной мембраны, способствующие адгезии, а также микрокапсула, препятствующая фагоцитозу.
Резистентность. E. coli отличается более высокой устойчивостью к действию различных факторов внешней среды; она чувствительна к дезинфектантам, быстро погибает при кипячении.
Роль E. coli. Кишечная палочка — представитель нормальной микрофлоры толстой кишки. Она является антагонистом патогенных кишечных бактерий, гнилостных бактерий и грибов рода Candida. Кроме того, она участвует в синтезе витаминов группы В, Е и К, частично расщепляет клетчатку.
Штаммы, обитающие в толстой кишке и являющиеся условно-патогенными, могут попасть за пределы ЖКТ и при снижении иммунитета и их накоплении стать причиной различных неспецифических гнойно-воспалительных болезней (циститов, холециститов) - парентеральных эшерихиозов.
Эпидемиология. Источник энтеральных эшерихиозов - больные люди. Механизм заражения — фекально-оральный, пути передачи — алиментарный, контактно-бытовой.
Патогенез. Полость рта. Попадает в тонкую кишку, адсорбируется в клетках эпителия с помощью пилей и белков наружной мембраны. Бактерии размножаются, погибают, освобождая эндотоксин, который усиливает перистальтику кишечника, вызывает диарею, повышение температуры тела и другие симптомы общей интоксикации. Выделяет экзотоксин - тяжелая диарея, рвоту и значительное нарушение водно-солевого обмена.
Клиника. Инкубационный период составляет 4 дня. Болезнь начинается остро, с повышения температуры тела, болей в животе, поноса, рвоты. Отмечаются нарушение сна и аппетита, головная боль. При геморрагической форме в кале обнаруживают кровь.
Иммунитет. После перенесенной болезни иммунитет непрочный и непродолжительный.
Микробиологическая диагностика. Основной метод — бактериологический. Определяют вид чистой культуры (грамотрицательные палочки, оксидазоотрицательные, ферментирующие глюкозу и лактозу до кислоты и газа, образующие индол, не образующие сероводород) и принадлежность к серогруппе, что позволяет, отличить условно-патогенные кишечные палочки от диареегенных. Внутривидовая идентификация, имеющая эпидемиологическое значение, заключается в определении серовара с помощью диагностических адсорбированных иммунных сывороток.
8.Возбудители сальмонеллезов. Характеристика. Микробиологическая диагностика сальмонеллезов. Острая кишечная зоонозная инфекция, вызываемая сероварами сальмонелл, характеризующаяся поражением ЖКТ.
Морфологические свойства: подвижные, грам«-» палочки, капсулы нет. Хорошо растут на простых питательных и желчесодержащих средах. На плотных – образуют колонии в R-и S-формах, на жидких – помутнение. На лактозособержащих средах образуют бесцветные колонии.
Биохимическая активность: ферментация глюк. до кислоты и газа, отсутствие ферментации лактозы, продукция сероводорода, отсутствие индолообразования.
Антигенная структура: соматический О-антиген, жгутиковый Н-антиген, Некоторые – К-антиген. Род Salmonella состоит из двух видов — вида S. enterica, в который включены все сальмонеллы, являющиеся возбудителями человека и теплокровных животных, и вида S. bongori, который подразделяется на 10 сероваров.
Вид S. enterica разделен на 6 подвидов, которые подразделены на серовары. Некоторые серовары сальмонелл, в частности S. typhi, имеют полисахаридный Vi-антиген, являющийся разновидностью К-антигена.
Эпидемиология. Возбудителями сальмонеллеза является большая группа сальмонелл, входящая в подвид enterica. Наиболее часто возбудителями сальмонеллезов у человека являются серовары S. Typhimurium, S. Dublin,S. Choleraesuis. Основные факторы передачи — мясо, молоко, яйца, вода.
Патогенез и клиника. Заболевание протекает в локальной форме гастроэнтерита, ведущий синдром - диарейный. Инвазировав слизистую тонкого кишечника через М-клетки и проникнув в подслизистую, сальмонеллы захватываются макрофагами, переносясь ими в пейеровы бляшки, где формируют первичный очаг инфекции. При этом выделяются эндотоксин и белковый энтеротоксин. Энтеротоксин активирует поступление в просвет кишечника большого количества жидкости, К, Na. Понос, рвота.
Иммунитет: Ненапряженный, серовароспецифический, опосредован секреторным IgA, который предотвращает процесс пенетрации сальмонеллами слизистой тонкого кишечника. В крови могут определяться антитела.
Микробиологическая диагностика. Бактериологическому исследованию подвергают рвотные массы, промывные воды желудка, испражнения, желчь, мочу, кровь. При идентификации выделенных культур необходим широкий набор диагностических О- и Н- сывороток.
Для серологического исследования применяют РНГА, ИФА. Важное диагностическое значение имеет нарастание титра антител в динамике заболевания.
Лечение. Применяется патогенетическая терапия, направленная на нормализацию водно-солевого обмена. При генерализованных формах — этиотропная антибиотикотерапия.
Сальмонеллезные групповые, адсорбированные О- и Н-агглютинирующие сыворотки. Применяются для установления серогрупп и сероваров сальмонелл в реакции агглютинации.
Сальмонеллезные О- и Н-монодиагностикумы представляют собой взвеси сальмонелл, убитых нагреванием (О-диагностикумы) или обработкой формалином (Н-диагностикумы). Применяются для серодиагностики брюшного тифа.
Профилактика. Специфическая профилактика сальмонеллеза у с/х животных и птиц. Неспецифическая профилактика - проведение ветеринарно-санитарных мероприятий.
9. Возбудители холеры. Характеристика. Микробиологическая диагностика. Возбудитель – Vibrio cholerae, серогрупп О1 и О139, характеризуется токсическим поражением тонкого кишечника, нарушением водно-солевого баланса.
Морфологические и культуральные свойства. Вибрион имеет один полярно расположенный жгутик. Под действием пенициллина образуются L-формы. Грамотрицательны, спор не образуют. Факультативный анаэроб. Не требователен к питательным средам. Температурный оптимум 37C.
На плотных средах вибрионы образуют мелкие круглые прозрачные S-колонии с ровными краями. На скошенном агаре образуется желтоватый налет. В непрозрачных R-колониях бактерии становятся устойчивыми к действию бактериофагов, антибиотиков и не агглютинируются О-сыворотками.
Биохимические свойства. Активны: сбраживают до кислоты глюкозу, мальтозу, сахарозу, маннит, лактозу, крахмал. Все вибрионы делятся на шесть групп по отношению к трем сахарам (манноза, сахароза, арабиноза). Первую группу, к которой относятся истинные возбудители холеры, составляют вибрионы, разлагающие маннозу и сахарозу и не разлагающие арабинозу: разлагают белки до аммиака и индола. H2S не образуют.
Антигенная структура. Термостабильный О-антиген и термолабильный Н-антиген. Н-АГ являются общими для большой группы вибрионов.
Возбудители классической холеры и холеры Эль-Тор объединяются в серогруппу 01. Антигены серогруппы 01 включают в различных сочетаниях А-, В- и С-субъединицы. Сочетание субъединиц АВ называется сероваром Огава, сочетание АС — сероваром Инаба, сочетание ABC — Гикошима. R-формы колоний утрачивают О-АГ.
Резистентность. Вибрионы плохо переносят высушивание. Долго сохраняются в водоемах, пищевых продуктах. Биовар Эль-Тор более устойчив в окружающей среде, чем классический вибрион.
Эпидемиология. Острая кишечная инфекция с фекально-оральным механизмом передачи. Путь передачи - водный, пищевой. Источник инфекции — больной человек или вибрионоситель.
Факторы патогенности. Пили адгезии; фермент муциназа, разжижающий слизь и обеспечивающий доступ к эпителию. Эпителиальные клетки выделяют щелочной секрет, который в сочетании с желчью является прекрасной питательной средой для размножения вибрионов. Токсинообразование вибрионов, которые вырабатывают эндо- и экзотоксины. Экзотоксин (энтеротоксин) холероген — термолабильный белок, чувствителен к протеолитическим ферментам. Холероген содержит 2 субъединицы: А и В. А активизирует внутриклеточную аденилатциклазу, происходит повышение выхода жидкости в просвет кишечника. Диарея, рвота. Фермент нейраминидаза усиливает связывание холерного экзотоксина с эпителием слизистой кишечника. Эндотоксин запускает каскад арахидоновой кислоты, которая запускает синтез простагландинов (Е, F). Они вызывают сокращение гладкой мускулатуры тонкого кишечника и подавляют иммунный ответ, чем обусловлены диарея.
Клинические проявления. Инкубационный период 2—3 дня. Боль в животе, рвота, диарея.
Иммунитет. Гуморально-клеточный. При выздоровлении возникает напряженный непродолжительный иммунитет.
Микробиологическая диагностика. Выделение и идентификация возбудителя. Материал для исследования - выделения от больных (кал, рвота), вода.
Для экспресс-диагностики используют РИФ, ПЦР. Бактериоскопический метод в настоящее время не используется.
Лечение: а) регидратация (восполнение потерь жидкости и электролитов введением изотонических, растворов, а также плазмозаменяющих жидкостей внутривенно) антибактериальная терапия (тетрациклины, фторхинолоны).
Профилактика. Санит.-гиг. мероприятия. Экстренная профилактика антибиотиками широкого спектра действия, а также вакцинопрофилактика. Современная вакцина представляет собой комплексный препарат, состоящий из холероген-анатоксина и химического О-антигена, обоих биоваров и сероваров Огава и Инаба. Прививка обеспечивает выработку вибриоцидных антител и антитоксинов в высоких титрах.
10. Возбудители хламидиозов. Характеристика. Микробиологическая диагностика. Таксономия: порядок Chlamydiales, семейство Chlamydaceae, род Chlamydia. Род представлен видами С.trachomatis, C.psittaci,C.pneumoniae.
Болезни, вызываемые хламидиями, называют хламидиозами. Заболевания, вызываемые C. trachomatis u C. pneumoniae, — антропонозы. Орнитоз, возбудителем которого является С. psittaci, — зооантропонознаяинфекция.
Морфология хламидий: мелкие, грам «-» бактерии, шаровидной формы. Не образуют спор, нет жгутиков и капсулы. Клеточная стенка: 2-х слойная мембрана. Имеют гликолипиды. По Граму – красный цвет. Основной метод окраски – по Романовскому – Гимзе.
2 формы существования: элементарные тельца (неактивные инфекционные частицы, вне клетки); ретикулярные тельца (внутри клеток, вегетативная форма).
Культивирование: Можно размножать только в живых клетках. В желточном мешке развивающихся куриных эмбрионов, организме чувствительных животных и в культуре клеток
Ферментативная активность: небольшая. Ферментируют пировиноградную кислоту, синтезируют липиды. Не способны синтезировать высокоэнергетические соединения.
Антигенная структура: Антигены трех типов: родоспецифический термостабильный липополисахарид (в клеточной стенке). Выявляют с помощью РСК; видоспецифический антиген белковой природы (в наружной мембране). Обнаруживают с помощью РИФ; вариантоспецифический антиген белковой природы.
Факторы патогенности. С белками наружной мембраны хламидий связаны их адгезивные свойства. Эти адгезины обнаруживают только у элементарных телец. Хламидии образуют эндотоксин. У некоторых хламидий обнаружен белок теплового шока, способный вызывать аутоиммунные реакции.
Резистентность. Высокая к различным факторам внешней среды. Устойчивы к низким температурам, высушиванию. Чувствительны к нагреванию.
С. trachomatis - возбудитель заболеваний мочеполовой системы, глаз и респираторного тракта человека.
Трахома — хроническое инфекционное заболевание, характеризующееся поражением конъюнктивы и роговицы глаз. Антропоноз. Передается контактно- бытовым путем.
Патогенез: поражает слизистую оболочку глаз. Он проникает в эпителий конъюнктивы и роговицы, где размножается, разрушая клетки. Развивается фолликулярный кератоконъюнктивит.
Диагностика: исследование соскоба с конъюнктивы. В пораженных клетках при окраске по Романовскому—Гимзе обнаруживают цитоплазматические включения фиолетового цвета, расположенные около ядра — тельца Провачека. Для выявления специфического хламидийного антигена в пораженных клетках применяют также РИФ и ИФА. Иногда прибегают к культивированию хламидий трахомы на куриных эмбрионах или культуре клеток.
Лечение: антибиотики (тетрациклин) и иммуностимуляторы (интерферон).
Профилактика: Неспецифическая.
Урогенитальный хламидиоз — заболевание, передающееся половым путем. Это — острое/хроническое инфекционное заболевание, которое характеризуется преимущественным поражением мочеполового тракта.
Заражение человека происходит через слизистые оболочки половых путей. Основной механизм заражения — контактный, путь передачи — половой.
Иммунитет: клеточный, с сыворотке инфицированных – специфические антитела. После перенесенного заболевания - не формируется.
Диагностика: При заболеваниях глаз применяют бактериоскопический метод — в соскобах с эпителия конъюнктивы выявляют внутриклеточные включения. Для выявления антигена хламидии в пораженных клетках применяют РИФ. При поражении мочеполового тракта может быть применен биологический метод, основанный на заражении исследуемым материалом (соскобы эпителия из уретры, влагалища) культуры клеток.
Постановка РИФ, ИФА позволяют обнаружить антигены хламидии в исследуемом материале. Серологический метод - для обнаружения IgM против С. trachomatis при диагностике пневмонии новорожденных.
Лечение. антибиотики (азитромицин из группы макролидов), иммуномодуляторы, эубиотики.
Профилактика. Только неспецифическая (лечение больных), соблюдение личной гигиены.
Венерическая лимфогранулема — заболевание, передающееся половым путем, характеризуется поражением половых органов и регионарных лимфоузлов. Механизм заражения — контактный, путь передачи — половой.
Иммунитет: стойкий, клеточный и гуморальный иммунитет.
Диагностика: Материал для исследования - гной, биоптат из пораженных лимфоузлов, сыворотка крови. Бактериоскопический метод, биологический (культивирование в желточном мешке куриного эмбриона), серологический (РСК с парными сыворотками положительна) и аллергологический (внутрикожная проба с аллергеном хламидии) методы.
Лечение. Антибиотики — макролиды и тетрациклины.
Профилактика: Неспецифическая.
С. pneumoniae - возбудитель респираторного хламидиоза, вызывает острые и хронические бронхиты и пневмонии. Антропоноз. Заражение – воздушно-капельным путем. Попадают в легкие через верхние дыхательные пути. Вызывают воспаление.
Диагностика: постановка РСК для обнаружения специфических антител (серологический метод). При первичном заражении учитывают обнаружение IgM. Применяют также РИФ для обнаружения хламидийногоантигена и ПЦР.
Лечение: Проводят с помощью антибиотиков (тетрациклины и макролиды).
Профилактика: Неспецифическая.
С. psittaci - возбудитель орнитоза — острого инфекционного заболевания, которое характеризуется поражением легких, нервной системы и паренхиматозных органов (печени, селезенки) и интоксикацией.
Зооантропоноз. Источники инфекции – птицы. Механизм заражения – аэрогенный, путь передачи – воздушно- капельный. Возбудитель – через слиз. оболочки дыхат. путей, в эпителий бронхов, альвеол, размножается, воспаление.
Диагностика: Материал для исследования - кровь, мокрота больного, сыворотка крови для серологического исследования.
Применяют биологический метод — культивирование хламидий в желточном мешке куриного эмбриона, в культуре клеток. Серологический метод. Применяют РСК, РПГА, ИФА, используя парные сыворотки крови больного. Внутрикожная аллергическая проба с орнитином.
Лечение: антибиотики (тетрациклины, макролиды).
11. Стафилококки. Характеристика. Микробиологическая диагностика. Таксономия: относятся к отделу Firmicutes, семейству Мicrococcacae, роду Staphylococcus. К данному роду относятся 3 вида: S.aureus, S.epidermidis и S.saprophyticus.
Морфологические свойства: Все виды стафилококков представляют собой округлые клетки. В мазке располагаются несимметричными гроздьями. Клеточная стенка содержит большое количество пептидогликана, связанных с ним тейхоевых кислот, протеин А. Грамположительны. Спор не образуют, жгутиков не имеют. У некоторых штаммов можно обнаружить капсулу. Могут образовывать L-формы.
Культуральные свойства: Стафилококки — факультативные анаэробы. Хорошо растут на простых средах. На плотных средах образуют гладкие, выпуклые колонии с различным пигментом, не имеющим таксономического значения. Могут расти на агаре с высоким содержанием NaCl. Обладают сахаролитическими и протеолитическими ферментами. Стафилококки могут вырабатывать гемолизины, фибринолизин, фосфатазу, лактамазу, бактериоцины, энтеротоксины, коагулазу.
Стафилококки пластичны, быстро приобретают устойчивость к антибактериальным препаратам. Существенную роль в этом играют плазмиды, передающиеся с помощью трансдуцирующих фагов от одной клетки к другой. R-плазмиды детерминируют устойчивость к одному или нескольким антибиотикам, за счет продукции бета-лактамазы.
Антигенная структура. Около 30 антигенов, представляющих собой белки, полисахариды и тейхоевые кислоты. В составе клеточной стенки стафилококка содержится протеин А, который может прочно связываться с Fc-фрагментом молекулы иммуноглобулина, при этом Fab-фрагмент остается свободным и может соединяться со специфическим антигеном. Чувствительность к бактериофагам (фаготип) обусловлена поверхностными рецепторами. Многие штаммы стафилококков являются лизогенными (образование некоторых токсинов происходит с участием профага).
Факторы патогенности: Условно – патогенные. Микрокапсула защищает от фагоцитоза, способствует адгезии микробов; компоненты клеточной стенки – стимулируют развитие воспалительных процессов. Ферменты агрессии: каталаза – защищает бактерии от действия фагоцитов, бета-лактамаза – разрушает молекулы антибиотиков.
Резистентность. Устойчивость в окружающей среде и чувствительность к дезинфектантам обычная.
Патогенез. Источником инфекции стафилококков - человек и некоторые виды животных (больные или носители). Механизмы передачи — респираторный, контактно-бытовой, алиментарный.
Иммунитет: Постинфекционный – клеточно-гуморальный, нестойкий, ненапряженный.
Клиника. Около 120 клинических форм проявления, которые имеют местный, системный или генерализованный характер. К ним относятся гнойно-воспалительные болезни кожи и мягких тканей (фурункулы, абсцессы), поражения глаз, уха, носоглотки, урогенитального тракта, пищеварительной системы (интоксикации).
Микробиологическая диагностика. Материал для исследования – гной, кровь, моча, мокрота, испражнения.
Бактериоскопический метод: из исследуемого материала (кроме крови) готовят мазки, окрашивают по Граму. Наличие грам«+» гроздевидных кокков, располагающихся в виде скоплений.
Бактериологический метод: Материал засевают петлей на чашки с кровяным и желточно-солевым агаром для получения изолированных колоний. Посевы инкубируют при 37С в течение суток. На следующий день исследуют выросшие колонии на обеих средах. На кровяном агаре отмечают наличие или отсутствие гемолиза. На ЖСА S. aureus образует золотистые круглые выпуклые непрозрачные колонии. Вокруг колоний стафилококков, обладающих лецитиназной активностью, образуются зоны помутнения с перламутровым оттенком. Для окончательного установления вида стафилококка 2—3 колонии пересевают в пробирки со скошенным питательным агаром для получения чистых культур с последующим определением их дифференциальных признаков. S.aureus – «+»: образование плазмокоагулазы, лецитиназы. Ферментация: глюк, маннита, образование а-токсина.
Для установления источника госпитальной инфекции выделяют чистые культуры стафилококка от больных и бактерионосителей, после чего проводят их фаготипирование с помощью набора типовых стафилофагов. Фаги разводят до титра, указанного на этикетке. Каждую из исследуемых культур засевают на питательный агар в чашку Петри газоном, высушивают, а затем петлей каплю соответствующего фага наносят на квадраты (по числу фагов, входящих в набор), предварительно размеченные карандашом на дне чашки Петри. Посевы инкубируют при 37 °С. Результаты оценивают на следующий день по наличию лизиса культуры.
Серологический метод: в случаях хронической инфекции, определяют титр анти-а-токсина в сыворотке крови больных. Определяют титр АТ к риботейхоевой кислоте ( компонент клеточной стенки).
Лечение и профилактика. Антибиотики широкого спектра действия (пенициллины, устойчивые к бета-лактамазе). В случае тяжелых стафилококковых инфекций, не поддающихся лечению антибиотиками, может быть использована антитоксическая противостафилококковая плазма или иммуноглобулин, иммунизированный адсорбированным стафилококковым анатоксином. Выявление, лечение больных; проведение планового обследования медперсонала, вакцинация стафилококковым анатоксином. Стафилококковый анатоксин: получают из нативного анатоксина путем осаждения трихлоруксусной кислотой и адсорбцией на гидрате оксида алюминия.
Стафилококковая вакцина: взвесь коагулазоположительных стафилококков, инактивированных нагреванием. Применяют для лечения длительно текущих заболеваний.
Иммуноглобулин человеческий противостафилококковый: гамма-глобулиновая фракция сыворотки крови, содержит стафилококковый анатоксин. Готовят из человеч. крови, с высоким содержанием антител. Применяется для специфического лечения.
12. Стрептококки. Характеристика, принципы лабораторной диагностики. Таксономия. Стрептококки относятся к отделу Firmicutes, роду Streptococcus. Род состоит из более чем 20 видов, среди которых есть представители нормальной микрофлоры человеческого тела и возбудители тяжелых инфекционных эпидемических болезней человека.
Морфологические и культуральные свойства. Стрептококки — это мелкие шаровидные клетки, располагающиеся цепочками, грамположительные, спор не образуют, неподвижные. Большинство штаммов образует капсулу, состоящую из гиалуроновой кислоты. Клеточная стенка содержит белки (М-, Т- и R-антигены), углеводы (группоспецифические) и пептидогликаны. Легко переходят в L-формы. Возбудители растут на средах, обогащенных углеводами, кровью, сывороткой, асцитической жидкостью. На плотных средах обычно образуют мелкие серые колонии. Капсульные штаммы стрептококков группы А образуют слизистые колонии. На жидких средах стрептококки обычно дают придонный рост. Стрептококки — факультативные анаэробы. По характеру роста на кровяном агаре они делятся на культуральные варианты: а-гемолитические (зеленящие), в-гемолитические (полный гемолиз) и негемолитические.
Резистентность. Чувствительны к физическим и химическим факторам окружающей среды, могут длительно сохранять жизнеспособность при низких температурах. Устойчивость к антибиотикам приобретается медленно.
Патогенность. На основе полисахаридного антигена делятся на серогруппы (А, В, С...О). Стрептококки группы А вырабатывают более 20 веществ, обладающих антигенностью и агрессивностью. На поверхности клетки имеется белковый антиген М, который тесно связан с вирулентностью (препятствует фагоцитозу). Этот белок определяет типовую принадлежность стрептококков. К факторам патогенности относят стрептокиназу (фибринолизин), ДНКазу, гиалуронидазу, эритрогенин. Наиболее патогенны для человека гемолитические стрептококки группы А, называемые S. pyogenes. Этот вид вызывает у человека многие болезни: скарлатину, рожу, ангину, острый эндокардит, послеродовой сепсис, хронический тонзиллит, ревматизм.
Иммунитет: постинфекционный нестойкий, ненапряженный.
Микробиологическая диагностика. Материал для исследования – гной, моча, кровь, мокрота.
Бактериоскопический метод: окраска по Граму мазков из патологического материала. При положительном результате обнаруживают цепочки грам«+» кокков.
Бактериологический метод: Исследуемый материал засевают на кровяной агар в чашку Петри. После инкубации при 37 °С в течение 24 ч отмечают характер колоний и наличие вокруг них зон гемолиза. Из части материала, взятого из колоний, готовят мазок, окрашивают по Граму и микроскопируют. Для получения чистой культуры 1—3 подозрительные колонии пересевают в пробирки со скошенным кровяным агаром и сахарным бульоном. На кровяном агаре Streptococcus pyogenes образует мелкие мутноватые круглые колонии. В бульоне стрептококк дает придонно-пристеночный рост в виде хлопьев, оставляя среду прозрачной. По характеру гемолиза на кровяном агаре стрептококки делятся на три группы: 1) негемолитические; 2) а-гемолитические 3) β-гемолитические, образующие вокруг колонии полностью прозрачную зону гемолиза. Заключительным этапом бактериологического исследования является идентификация выделенной культуры по антигенным свойствам. По данному признаку все стрептококки делят на серологические группы (А, В, С, Dи т. д.). Серогруппу определяют в реакции преципитации с полисахаридным преципитиногеном С. Серовар определяют в реакции агглютинации. Выявленную культуру стрептококка проверяют на чувствительность к антибиотикам методом дисков.
Серодиагностика: устанавливают наличие специфических антигенов в крови больного с помощью РСК или реакции преципитации. Антитела к О-стрептолизину определяют для подтверждения диагноза ревматизма.
Лечение: Антибиотики широкого спектра действия (пенициллины, устойчивые к в-лактамазе). При выделении стрептококка А – пенициллин. Химиотерапия антибиотиками, к которым выявлена чувствительность микроба – левомицетин, рифампицин.
Профилактика: специфической – нет. Неспецифическая - выявление, лечение больных; проведение планового обследования медперсонала, вакцинация стрептококковый бактериофаг (жидкий) – фильтрат фаголизата стрептококка. Применятся наружно, внутрикожно, в/м., О-стрептолизин сухой (лиофильно высушенный фильтрат бульонной культуры стрептококка – активного продуцента О-стрептолизина. Применяется для постановки серологических реакций – определения анти-О-стрептолизина в сыворотке крови больных).
13. Клостридии. Характеристика. Методы лабораторной диагностики. Клостри́дии (лат. Clostridium) — род грамположительных, облигатно анаэробных бактерий, способных продуцировать эндоспоры[1]. Отдельные клетки — удлинённые палочки, название рода происходит от др.-греч. κλωστήρ «веретено». Многие виды, которые были отнесены к клостридиям по этому морфологическому признаку, позже были реклассифицированы. Эндоспоры могут располагаться центрально, эксцентрально и терминально. Диаметр эндоспор часто превышает диаметр клетки.
Клостридии — это также форма бактериальных клеток, у которых центрально расположенная спора имеет диаметр больший, чем диаметр самой клетки, из-за чего клетка «раздувается» и приобретает веретенообразную форму.
Клостридии входят в состав нормофлоры желудочно-кишечного тракта и женских половых путей. Иногда их обнаруживают в полости рта и на коже.
Бактерии рода Клостридий вырабатывают наиболее сильные из известных ядов — ботулотоксин (C. botulinum), тетаноспазмин (C. tetani), ε-токсинC. perf. и другие.
К роду Clostridium относятся подвижные палочки (реже неподвижные); образуют овальные или круглые эндоспоры, придающие клеткам веретенообразную форму (от гр. kloster - веретено). С возрастом могут изменять отношение к окрашиванию по Граму, но на ранних стадиях культивирования всегда грамположительны. Хемоорганотрофы; одни виды проявляют сахаролитическую, другие - протеолитическую активность (возможно сочетание этих свойств либо их полное отсутствие). Наиболее характерные признаки - способность вызывать масляно-кислое брожение и анаэробный распад углеводов с образованием масляной кислоты и газов (СО2, водород, иногда метан). Восстанавливают сульфиты до сульфидов Большинство видов - строгие анаэробы; также имеются аэротолерантные виды или отдельные штаммы.
Род включает виды, обитающие в почве, на дне пресных и солёных водоёмов, в кишечнике человека и животных; некоторые виды патогенны, а некоторые нашли применение в промышленном производстве некоторых органических кислот и спиртов. Современная систематика выделяет 5 групп микроорганизмов, разделяемых по расположению спор, способности гидролизовать желатин и особым требованиям для роста. По экологическим свойствам выделяют 3 группы клостридий: возбудители бродильных процессов (с преобладанием сахаролитических свойств); возбудители процессов гниения (с преобладанием протеолитических свойств); патогенные виды (могут быть протеолитическими и сахаролитическими). Последнюю группу составляют возбудители травматических клостридиозов (газовой гангрены, столбняка); возбудителиэнтеральных клостридиозов и непатогенные виды вызывающие патологические процессы в ассоциациях с другими патогенными клостридия.м Клостридиозы, как правило, имеют экзогенное происхождение. Из более чем 80 видов менее 20 выделяют при различных поражениях человека;
КЛОСТРИДИИ СТОЛБНЯКА. Clostridium tetani.
Морфология. Гр+ прямые палочки длиной 4-8 мкм и толщиной 0,3-0,8 мкм, располагаются одиночно или цепочками. Образуют споры круглой формы, расположенные терминально, превышают поперечник бактерии вид барабанной палочки. Перитрихи, капсулу не образуют.
Строгие анаэробы, культивируются в бескислородных условиях на сахарном кровяном агаре, образуют прозрачные или несколько сероватые колонии с зоной гемолиза. В высоком столбике агара С.tetani дают колонии двух видов: похожие на пушинку с плотным центром (S-форма) и чечевицеподобные (R-форма). В среде Китта–Тароцци эти анаэробы образуют равномерную муть.
С.tetani не обладают сахаролитическими ферментами, не образуют каталазу и оксидазу, протеолитические свойства слабо выражены.
Антигены. С.tetani имеют О- и Н-АГ. По Н-Аг делятся на 10 сероваров, но все они продуцируют идентичный по АГ свойствам экзотоксин.
Экология и распространение. Обитают в кишечнике животных и человека. С испражнениями вегетативные клетки попадают в почву, где образуют споры. Столбняк развивается при попадании клостридий в рану (особенно опасны рваные и колотые раны, в которых создаются анаэробные условия). У новорожденных заражение – через пупочный канатик, а у рожениц – через слизистую оболочку матки.
Патогенность и патогенез. С.tetani продуцируют сильные токсины, они представляют собой белок, освобождающийся при аутолизе бактерий. По механизму действия различают тетаноспазмин (поражение нервной ткани спазматическое сокращение поперечно-полосатой мускулатуры), и тетанолизин (лизис эритроцитов).
В анаэробных условиях споры прорастают, микроорганизмы размножаются и выделяют токсины. Токсины поступают в кровь, достигают нервной ткани и поражают её, появляются клинические симптомы болезни. Столбняк развивается по нисходящему типу: первые симптомы – тонические сокращения жевательных и мимических мышц («сардоническая» улыбка), затем – тоническое напряжение и спазм мышц затылка, спины, тело во время приступа вид дуги. Смерть – от асфиксии и поражения жизненно важных центров при полном сохранении сознания.
Лабораторная диагностика. Возбудитель обычно обнаруживают в месте проникновения в организм больного. Поэтому наиболее рационально исследование различного материала, взятого в месте ранения. В тех случаях, когда входные ворота неизвестны, следует тщательно осмотреть больного для выявления ссадин, царапин, катаральных и воспалительных процессов; необходимо обратить внимание на старые рубцы после ранений, т.к. возбудитель может долго в них сохраняться, в некоторых случаях исследуют слизь из носа, бронхов, глотки, налёт с миндалин, а также выделения из влагалища и матки (при послеродовом столбняке или аборте). При бактериологическом исследовании трупов также принимают во внимание возможность генерализации инфекции. Для анализа забирают кровь (10 мл) и кусочки печени и селезёнки(20-30 г).
Выделение возбудителя проводят по стандартной схеме. Исследованию подлежит материал от больного или трупа, перевязочный и шовный хирургический материал, а также почва, пыль и воздух.
Биологическая проба. При исследовании материала от больного или трупа параллельно бактериологическому анализу проводят обнаружение столбнячного анатоксина в биологической пробе на мышах. Для этого материал измельчают, добавляют двойной объём физиологического раствора, инкубируют в течение часа при комнатной температуре, фильтруют; часть фильтрата смешивают с противостолбнячной сывороткой из расчёта 0,5 мл сыворотки на 1мл экстракта и инкубируют 40 мин. Затем одной группе животных вводят экстракт без предварительной инкубации с сывороткой, а другой группе - проинкубированную смесь; при наличии Clostridium tetani у животных первой группы развиваются симптомы столбняка.
Профилактика и лечение. Специфическую профилактику проводят путем активной иммунизации АКДС и АДС, иммунизируют детей с 3-месячного возраста по схеме. Антитоксический иммунитет создается у людей, работающих в зонах с высоким инфицированием почвы спорами С.tetani.
Людям, получившим травмы, сразу ПХОР вводят столбнячный анатоксин (для стимуляции активного иммунитета) и противостолбнячный Ig для создания быстрого пассивного иммунитета.
Антитоксическую противостолбнячную сыворотку (или Ig) используют и для лечения (в больших дозах). Более эффективен противостолбнячный Ig, полученный от людей, иммунизированных анатоксином. Одновременно применяют антибиотики для предупреждения вторичной инфекции.
КЛОСТРИДИИ АНАЭРОБНОЙ РАНЕВОЙ ИНФЕКЦИИ
Анаэробная раневая инфекция – полимикробное заболевание. В его возникновении и развитии принимают участие несколько видов клостридий в ассоциации с аэробными бактериями (стафилококками, стрептококками и др., легко инфицирующими раны). Основными возбудителями анаэробной раневой инфекции являются С.perfringens, С.novyi, С.septicum. В патогенезе заболевания участвуют и другие клостридий – С.histolyticum, С.sordellii и др.
Основной возбудитель анаэробной раневой инфекции С.perfringens чаще других обнаруживается в патологических очагах. Вызывает газовую гангрену, пищевую токсикоинфекцию, если попадает в пищевые продукты и размножается в них.
Морфология, физиология. Крупные Гр+ палочки с субтерминально расположенными спорами.
С.perfringens имеет размеры 0,6-1,0х1-1,5 мкм, не обладает жгутиками. В организме животных и человека образует капсулу, которая утрачивается при пересевах на питательные среды. С.novyi – наиболее крупные из всех возбудителей анаэробной инфекции палочки, прямые или слегка изогнутые. Капсул не образуют, имеют жгутики, как и все остальные возбудители этого заболевания. С.septicum– полиморфные, в культурах могут иметь нитевидные формы.
Культивируют клостридий в средах, разработанных для размножения анаэробных споровых микроорганизмов. Чувствительность к кислороду у этих бактерий различна. Если С. perfringens (равно как и С. histolyticum и С. sordellii) могут расти и в присутствии небольшого количества кислорода, то С.novyi и С.septicum не выносят даже малого количества кислорода (строгие анаэробы).
Клостридии дифференцируют по культуральным признакам. На сахарно-кровяном агаре С. perfringens образует гладкие сероватые с ровными краями и плотным возвышением в центре колонии; С. novyi – шероховатые колонии с признаками гемолиза; С. septicum образует сплошной нежный налет, переплетающиеся нити на фоне гемолиза, С. histolyticum – небольшие блестящие колонии с ровными краями и небольшой зоной гемолиза вокруг, С. sordellii–сероватые колонии с небольшим гемолизом.
В жидких средах клостридии дают диффузное помутнение, затем хлопьями оседают на дно пробирки. С. perfringens в среде Китта–Тароцци растет с обильным газообразованием, но более характерен тест в молоке, которое при культивировании микроорганизма быстро и интенсивно свертывается. Образуется при этом губка, пронизанная пузырьками газов, подбрасывается под самую пробку пробирки.
В столбике агара колонии С. perfringens выглядят либо в виде комочков ваты (R-форма), либо в виде чечевицы (S-форма). С. novyi образует колонии, похожие на нежные хлопья ваты, С. septicum – чечевицеобразные колонии.
Ферментативная активность клостридий различна у отдельных видов, что используется в дифференциации. С. perfringens обладает большим набором сахаролитических ферментов сбраживает многие углеводы с образованием кислоты и газов, протеолитические ферменты разжижают желатину, свернутую сыворотку. При росте в питательном бульоне образуется масляная, уксусная кислоты и большое количество газов (СО2, H2S).
14 . Возбудители туберкулеза. Характеристика. Методы лабораторной диагностики. Туберкулез—хроническое заболевание человека, сопровождающееся поражением органов дыхания, лимфатических узлов, кишечника, костей и суставов, глаз, кожи, почек и мочевыводящих путей, половых органов, центральной нервной системы.
Болезнь вызывается 3 видами микобактерий: Mycobacterium tuberculosis — человеческий вид, Mycobacterium bovis — бычий вид, Mycobacterium africanum — промежуточный вид.
Таксономия. Отдел Firmicutes, род Mycobacterium. Родовой признак — кислото, спирто- и щелочеустойчивость.
Морфология, тинкториальные и культуральные свойства. Выраженный полиморфизм. Они имеют форму длинных, тонких (М.tuberculosis) или коротких, толстых (M.bovis), прямых или слегка изогнутых палочек с гомогенной или зернистой цитоплазмой; грамположительны, неподвижны, спор не образуют, имеют микрокапсулу. Для их выявления применяют окраску по Цилю—Нильсену. Микобактерии могут образовывать различные морфовары (L-формы бактерий), которые длительно персистируют в организме и индуцируют противотуберкулезный иммунитет.
Возбудители туберкулеза характеризуются медленным ростом, требовательны к питательным средам. М.tuberculosis относятся к аэробам, глицеринзависимы. На жидких питательных средах дают рост в виде сухой пленки кремового цвета. При внутриклеточном развитии, а также при росте на жидких средах выявляется характерный корд-фактор, благодаря которому микобактерии растут в виде «жгутов». На плотных средах рост в виде кремового, сухого чешуйчатого налета с неровными краями (R-формы). По мере роста колонии приобретают бородавчатый вид. Под влиянием антибактериальных средств возбудители изменяют культуральные свойства, образуя гладкие колонии (S-формы). M.bovis —растут на средах медленнее, чем M.tuberculosis, пируватзависимы; на плотных питательных средах образуют мелкие шаровидные, серовато-белые колонии (S-формы).
Ферментная активность. Высокая каталазная и пероксидазная активность. Каталаза термолабильна. М.tuberculosis в большом количестве синтезирует ниацин (никотиновая кислота), который накапливается в культуральной среде и определяется в пробе Конно.
Химический состав: Основными химическими компонентами микобактерии являются белки, углеводы и липиды. Липиды (фосфатиды, корд-фактор, туберкулостеариновая кислота) - обусловливают устойчивость к кислотам, спиртам и щелочам, препятствуют фагоцитозу, нарушают проницаемость лизосом, вызывают развитие специфических гранулем, разрушают митохондрии клеток. Микобактерии индуцируют развитие реакции гиперчувствительности IV типа (туберкулин).
Факторы патогенности: основные патогенные свойства обусловлены прямым или иммунологически опосредованным действием липидов и липидсодержащих структур.
Антигенная структура: В ходе заболевания к антигенам образуются антипротеиновые, антифосфатидные и антиполисахаридные антитела, свидетельствующие об активности процесса.
Резистентность. Наличие липидов - устойчивы к действию неблагоприятных факторов. Высушивание мало влияет. Погибают при кипячении.
Эпидемиология. Основной источник инфекции — человек, больной туберкулезом органов дыхания, выделяющий микробы в окружающую среду с мокротой. Основные пути передачи инфекции — воздушно-капельныйи воздушно-пылевой.
Патогенез и клиника. Возникновению заболевания способствуют различные иммунодефициты. Инкубационный период составляет от 3—8 нед. до 1 года и более. В развитии болезни выделяют первичный, диссеминированный и вторичный туберкулез, который является результатом эндогенной реактивации старых очагов. В зоне проникновения микобактерий возникает первичный туберкулезный комплекс, состоящий из воспалительного очага, пораженных регионарных лимфатических узлов и измененных лимфатических сосудов между ними. Диссеминация микробов может происходить бронхо-, лимфо- и гематогенно. В основе специфического воспаления при туберкулезе лежит реакция гиперчувствительности IV типа, что препятствует распространению микробов по организму.
Различают 3 клинические формы: первичная туберкулезная интоксикация у детей и подростков, туберкулез органов дыхания, туберкулез других органов и систем. Основными симптомами легочного туберкулеза являются субфебрильная температура тела, кашель с мокротой, кровохарканье, одышка.
Иммунитет. Противотуберкулезный иммунитет нестерильный инфекционный, обусловлен наличием в организме L-форм микобактерий.
Микробиологическая диагностика. Диагностику проводят с помощью бактериоскопии, бактериологического исследования и постановки биологической пробы. Все методы направлены на обнаружение микобактерий в патологическом материале: мокроте, промывных водах бронхов, плевральной и церебральной жидкостях, кусочках тканей из органов.
К обязательным методам обследования относится бактериоскопическое, бактериологическое исследование, биологическая проба, туберкулинодиагностика, основанная на определении повышенной чувствительности организма к туберкулину. Чаще для выявления инфицирования и аллергических реакций ставят внутрикожную пробу Манту с очищенным туберкулином в стандартном разведении. Для экспресс-диагностики туберкулеза применяют РИФ(реакция иммунофлюоресенции) и ПЦР(полимеразная цепная реакция). Для массового обследования населения, раннего выявления активных форм туберкулеза можно использовать ИФА(иммуноферментный анализ), направленный на обнаружение специфических антител.
Лечение. По степени эффективности противотуберкулезные препараты делят на группы: группа А — изониазид, рифампицин; группа В — пиразинамид, стрептомицин, флоримицин; группа С – ПАСК, тиоацетозон. При наличии сопутствующей микрофлоры и множественной лекарственной устойчивости микобактерий применяют фторхинолоны и альдозон.
Профилактика. Специфическую профилактику проводят путем введения живой вакцины — BCG(БЦЖ), внутрикожно на 2—5-й день после рождения ребенка. Проводят последующие ревакцинации. Предварительно ставят пробу Манту для выявления туберкулиннегативных лиц, подлежащих ревакцинации.
Условно-патогенные микобактерии: семейство Mycobacteriaceae, род Mycobacterium. Сходны по биологич. свойствам, но устойчивы к противотуберкулезным препаратам.
1 группа: медленнорастущие фотохромогенные M.kansassi, M.marinum – поражения кожи, лимфадениты, инфекции мочеполового тракта.
2 группа: медленнорастущие скотохромогенные: M.scrofulaceum, M.gordonae.
3 группа: медленнорастущие нехромогенные: M.avium, M.gastri.
4 группа: быстрорастущие ското-,фотохромогенные: M.fortuitum, M.chelonei.
15. Возбудитель сифилиса. Характеристика, принципы микробиологической диагностики. Си́филис (устар.: люэс) — хроническое системное венерическое инфекционное заболевание с поражением кожи, слизистых оболочек, внутренних органов, костей, нервной системы с последовательной сменой стадий болезни, вызываемое бактериями вида Treponema pallidum (бледная трепонема) подвида pallidum, относящимся к роду трепонема (Treponema)[1] семейства Spirochaetaceae[2][3].
Treponema palladium ; T. entericum
Морфология: типичные трепонемы, имеющие 8-12 завитков, двигательный аппарат – 3 периплазматических жгутика у каждого полюса клетки. Окраску по Граму не воспринимают, по Романовскому-Гимзе – слабо розового цвета, выявляется импрегнацией серебром.
Культуральные свойства: вирулентный штамм на пит. средах не растёт, накопление культуры происходит путём заражения кролика в яичко. Вирулентные штаммы культивируют на средах с мозговой и почечной тканью.
Биохимические свойства: микроаэрофил
Антигенная структура: сложная, обладает специфическим белковым и липоидным антигенами, последний по своему составу идентичен кардиолипину, , экстрагированному из бычьего сердца ( дифосфадилглицерин )
Факторы патогенности: в процессе прикрепления участвуют адгезины, липопротеины участвуют в развитии иммунопатологических процессов.
Резистентность: чувствителен к высыханию, солнечным лучам, на предметах сохраняется до высыхания. При неблагоприятных условиях переходит в L-формы и образует цисты.
Патогенез: Вызывают сифилис. Из места входных ворот трепонемы попадают в регионарные лимфатические узлы, где размножаются. Далее Т. проникает в кровяное русло, где прикрепляется к эндотелиоцитам, вызывая эндартерииты, приводящие к васкулитам и тканевому некрозу. С кровью Т. разносится по всему организму, обсеменяя органы: печень, почки, костную, сердечно-сосудистую, нервную системы.
Иммунитет: защитный иммунитет не вырабатывается. В ответ на антигены возбудителя развивается ГЗТ и аутоиммунные процессы. Гуморальный иммунитет вырабатывается на липоидный антиген Т. и представляет собой титр IgA и IgM.
Микроскопическое исследование. Проводят при первичном сифилисе во время появления твердого шанкра. Материал для исследования: отделяемое шанкра, содержимое регионарных лимфатических узлов, из которых готовят препарат «раздавленная» капля и исследуют в темном поле. При положительном результате видны тонкие извитые нити длиной 6—14 мкм, имеющие 10—12 равномерных мелких завитков правильной, формы. Для бледной трепонемы характерны маятникообразные и поступательно-сгибательные движения. При развитии поражений на слизистой оболочке рта при вторичном сифилисе, а также при локализации твердого шанкра в полости рта приходится дифференцировать бледную трепонему от сапрофитных трепонем, являющихся представителями нормальной микрофлоры. В этом случае решающее диагностическое значение имеет обнаружение типичных трепонем в пунктате регионарных лимфатических узлов.
Серодиагностика. Реакцию Вассермана ставят одновременно с 2 антигенами: 1) специфическим, содержащим антиген возбудителя— разрушенные ультразвуком трепонемы; 2) неспецифическим — кардиолипиновым. Исследуемую сыворотку разводят в соотношении 1:5 и ставят РСК по общепринятой методике. При положительной реакции наблюдается задержка гемолиза, при отрицательной—происходит гемолиз эритроцитов; интенсивность реакции оценивается соответственно от ( + + + + ) До ( —). Первый период сифилиса является серонегативным и характеризуется отрицательной реакцией Вассермана. У 50 % больных реакция становится положительной не ранее чем через 2—3 нед после появления твердого шанкра. Во втором и третьем периодах сифилиса частота положительных реакций достигает 75— 90 %. После проведенного курса лечения реакция Вассермана становится отрицательной. Параллельно реакции Вассермана ставится реакция микропреципитации с неспецифическим кардиолипиновым антигеном и исследуемой инактивированной сывороткой крови или плазмой. В лунку на пластине из плексигласа (или на обычное стекло) наносят 3 капли сыворотки и добавляют 1 каплю кардиолипинового антигена. Смесь тщательно перемешивают и учитывают результаты. Положительная реакция е сывороткой крови больного сифилисом характеризуется образованием и выпадением хлопьев разной величины; при отрицательном результате наблюдается равномерная легкая опалесценция.
РИФ — реакция непрямой иммунофлюоресценции — является специфической при диагностике сифилиса. В качестве антигена используют взвесь тканевых трепонем. Используется реакция РИФ_200. Сыворотку больного инактивируют так же, как для реакции Вассермана, и разводят в соотношении 1:200. На предметные стекла наносят капли антигена, высушивают и фиксируют 5 мин в ацетоне. Затем на препарат наносят сыворотку больного, через 30 мин промывают и высушивают. Следующим этапом является обработка препарата флюоресцирующей сывороткой против глобулинов человека. Изучают препарат с помощью люминесцентного микроскопа, отмечая степень свечения трепонем.
РИТ—реакция иммобилизации трепонем — также является специфической. Живую культуру трепонем получают при культивировании в яичке кролика. Яичко измельчают в специальной среде, в которой трепонемы сохраняют подвижность. Ставят реакцию следующим образом: взвесь тканевых (подвижных) трепонем соединяют в пробирке с исследуемой сывороткой и добавляют свежий комплемент. В одну контрольную пробирку вместо исследуемой сыворотки добавляют сыворотку здорового человека, в другую — вместо свежего комплемента добавляют инактивированный — неактивный. После выдерживания при 35 °С ванаэробных условиях (анаэростат) из всех пробирок готовят препарат «раздавленная» капля и в темном поле определяют количество подвижных и неподвижных трепонем.
Лечение: Пенициллины, тетрациклины, висмутсодержащие препараты.
16. Возбудители ОРВИ. Характеристика, принципы лабораторной диагностики.
Острые респираторные вирусные инфекции (ОРВИ) - особая группа заболеваний, которая по своему удельному весу в структуре инфекционной патологии человека прочно занимает одно из ведущих мест. Более 200 вирусов могут быть причиной возникновения ОРВИ, что чрезвычайно затрудняет проведение диагностики. Да и сам термин ОРВИ вряд ли соответствует требованиям, предъявляемым к этиологическому диагнозу инфекционного заболевания, что зачастую ведет к неоправданному или неуместному его употреблению в клинической практике, тем более, что, помимо вирусов, несколько десятков видов бактерий, хламидий, микоплазм способны поражать дыхательные пути. Вместе с тем, на сегодняшний день сложились определенные представления об основных возбудителях ОРВИ, включающих представителей, как минимум, шести семейств, и цель настоящей публикации - познакомить практических врачей с этими данными.
Особенности строения и жизнедеятельности вирусов
Прежде чем перейти непосредственно к характеристике этиологических агентов ОРВИ, на наш взгляд, уместно вспомнить некоторые особенности строения и жизнедеятельности вирусов, этих уникальных неклеточных форм жизни, способных к абсолютному паразитизму на молекулярно-генетическом аппарате клетки, поскольку именно здесь, возможно, лежит объяснение факта способности большого числа отличных друг от друга вирусов вызывать во многом сходные клинические проявления инфекции. Как известно, каждый отдельно взятый вирус (вирион) состоит из сердцевинной части, представленной комплексом нуклеиновой кислоты (РНК или ДНК) и белков - нуклеопротеида и оболочки, образованной белковыми субъединицами - капсида. У ряда так называемых одетых вирусов имеется дополнительная мембраноподобная оболочка, включающая липиды и поверхностные гликопротеины, играющие важную роль в реализации инфекционных свойств вируса, определяющие его антигенность и иммуногенность. Жизненный цикл подавляющего большинства вирусов представляет собой ряд последовательных этапов взаимодействия его с чувствительной клеткой, в результате которых генетический материал вируса проникает в клетку. При этом все основные процессы жизнедеятельности клетки, в первую очередь - синтез нуклеиновых кислот и белков, оказываются под контролем вирусного генома. В результате за счет ресурсов клетки создаются основные компоненты вирионов, которые после самосборки покидают ее.
Не вдаваясь в детали чрезвычайно сложного процесса репродукции вирусов, остановимся на двух этапах - начальном и конечном. Первый представляет собой адсорбцию вируса на клетке и реализуется через взаимодействие с ее специфическими поверхностными рецепторами (для орто- и парамиксовирусов таковыми являются сиализированные гликолипиды, для риновирусов - молекулы внутриклеточной адгезии 1 типа и т.д.). Таким образом, одним из свойств, объединяющих столь разнородную группу возбудителей ОРВИ, является их способность специфически взаимодействовать с клетками различных отделов респираторного тракта человека. Конечный этап репродукции вирусов заключается в выходе из клетки с уже истощенными ресурсами и необратимо нарушенным обменом веществ огромного количества новых вирионов, которые вновь репродуцируются в интактных клетках. В результате - массовая гибель клеток респираторного тракта с проявлениями характерных для этого клинических симптомов, явлений общей интоксикации и всего того, что вкладывается врачами в понятие ОРВИ.
Как видно из данных, представленных в таблице 1, основными возбудителями ОРВИ человека являются представители шести семейств вирусов, краткая характеристика которых предлагается Вашему вниманию.

Семейство Ортомиксовирусы
Данное семейство включает наряду с прочими вирусы гриппа человека. С клинической точки зрения, включение гриппа в число ОРВИ вполне законно, поскольку это полностью соответствует проявлениям заболевания. Однако способность данных вирусов вызывать глобальные вспышки - эпидемии и пандемии - давно уже вывела грипп в отдельную нозологическую единицу среди прочих ОРВИ, а проблема гриппозной инфекции, как и предсказывал академик В.М. Жданов перешла с человечеством в 21 век.
Позволим себе остановиться лишь на двух моментах проблемы гриппозной инфекции. Прежде всего - это уникальная способность вирусов гриппа А к изменению антигенной структуры поверхностных белков гемагглютинина (Н) и нейраминидазы (N). Эти изменения могут быть точечными (дрейфовыми) либо кардинально меняющими антигенную структуру гемагглютинина или нейраминидазы (шифтовыми). В результате первого варианта изменений человечество практически каждые 2-3 года сталкивается с измененным вариантом вируса гриппа А, в результате второго - появляется новый антигенный вариант вируса с интервалом в полтора-два десятилетия, и тогда на планете возникает пандемия гриппа.
Кроме того, особенностью современной ситуации является одновременная циркуляция в человеческой популяции двух вариантов вируса гриппа А (Н1N1 и Н3N2) и вируса гриппа В. Все это создает большие трудности при создании вакцин и осуществлении специфической профилактики данного заболевания.
Семейство Парамиксовирусы
Представители данного семейства - РНК-содержащие вирусы, покрытые суперкапсидной оболочкой. Род Парамиксовирусы этого семейства включает 4 серотипа вирусов парагриппа человека. Наиболее характерными признаками парагриппозной инфекции являются повышение температуры, ларингиты, бронхиты. У детей 1 и 2 типы вызывают тяжелые ларингиты с острым отеком и развитием стеноза гортани (ложный круп). Серотип 3 вируса парагриппа чаще всего ассоциируется с поражениями нижних дыхательных путей (НДП).
Другой представитель семейства парамиксовирусов - респираторно-синцитиальный вирус (РС-вирус) снискал недобрую славу одного из основных возбудителей тяжелых поражений НДП у детей первого года жизни. РС-вирусная инфекция характеризуется постепенным началом, подъемом температуры с развитием бронхитов, бронхиолитов, пневмонии. На этом фоне возможно формирование астматического синдрома, поскольку вирус-индуцированный синцитий, содержащий вирусный антиген, может являться пусковым моментом для развития аллергической реакции.
Общей особенностью парагриппа и РС-инфекции является отсутствие стойкого иммунитета, а высокий уровень антител в крови детей не является надежной гарантией против РС-вируса. В связи с этим данные вирусы представляют особую опасность, прежде всего для ослабленных детей, а вспышки могут протекать в виде внутрибольничных инфекций.
Семейство Коронавирусы
Семейство включает 13 видов вирусов: респираторные и энтеральные коронавирусы человека и животных. Респираторные коронавирусы человека представлены 4 серотипами, их геном представлен одноцепочечной РНК. При коронавирусной инфекции чаще всего развивается острый профузный насморк, длящийся до 7 дней без повышения температуры. Возможны головная боль, кашель, фарингит. У детей болезнь имеет более тяжелое течение (бронхиты, пневмонии, лимфоаденит шейных узлов). Коронавирусные инфекции носят сезонный характер и распространены в основном в осенне-зимний период. Заболевание часто имеет характер внутрисемейных и внутрибольничных вспышек.
Семейство Пикорнавирусы
В состав семейства входит 4 рода. Представители родов Риновирусы и Энтеровирусы включают возбудителей ОРВИ. Это мелкие вирусы, геном которых представлен молекулой РНК.
Род риновирусов является одним из самых многочисленных в царстве вирусов и содержит на сегодняшний день 113 серотипов. Считается, что риновирусы повинны не менее чем в половине всех случаев простудных заболеваний у взрослых. Продолжительность болезни обычно не превышает 7 суток. У детей возможна лихорадка, у взрослых повышение температуры наблюдается редко. Как и все ОРВИ, риновирусная инфекция встречается в основном в холодное время года, а поскольку число серотипов огромно и перекрестный иммунитет отсутствует, возможны рецидивы заболевания в одном и том же сезоне.
Вирусы Коксаки В и отдельные серотипы ЕСНО, относящиеся к роду энтеровирусов, также способны вызывать ОРЗ, протекающие с лихорадкой, фарингитом, осложнениями в виде пневмонии и поражений плевры.
Семейство Реовирусы
Геном реовирусов представлен уникальной двунитевой РНК, кодирующей 10 генов, суперкапсидная оболочка отсутствует. Различают три серотипа ортореовирусов, которые при воздушно-капельном пути передачи наиболее часто инфицируют новорожденных, детей до 6-месячного возраста, реже взрослых и после первичной репродукции в эпителии слизистой полости рта и глотки поражают респираторный тракт. В связи с тем, что проявления реовирусной инфекции весьма разнообразны, этиологический диагноз можно поставить только на основе лабораторных тестов.
Семейство Аденовирусы
В отличие от предыдущих групп возбудителей ОРВИ геном аденовирусов представлен линейной молекулой двунитевой ДНК. Среди аденовирусов человека выявлено 47 серотипов, которые объединены в 7 групп. Некоторые серотипы аденовирусов (указаны в таблице) способны вызывать заболевания, характеризующиеся воспалением зева, увеличением миндалин, явлениями лихорадки и общего недомогания. Иногда в процесс вовлекаются нижние дыхательные пути с развитием пневмонии. Поскольку аденовирусная инфекция может передаваться не только воздушно-капельным путем, но и при купании в бассейнах, возможны наряду с осенне-зимними, и летние вспышки этой инфекции. Другой особенностью аденовирусов является их способность длительно сохраняться (персистировать) в клетках миндалин, в связи с чем аденовирусная инфекция у некоторых пациентов может принимать хроническую форму и длиться в течение ряда лет.
Заключение
В настоящее время, к сожалению, существует значительный разрыв между возможностями диагностики респираторных вирусных инфекций, предоставляемыми современными методами вирусологии и молекулярной биологии, и уровнем реализации этих возможностей в наших практических лабораториях. Открытой проблемой остается также этиотропная терапия ОРВИ, поскольку арсенал лекарственных средств, активных против респираторных вирусов, на сегодняшний день ограничен.
17. Возбудитель краснухи. Характеристика, принципы диагностики, специфическая профилактика.
КРАСНУХА , источники, возбудитель, симптомы, признаки, лечение, профилактика, Неотложная помощь КРАСНУХА симптомы, лечение, признаки, профилактика, патогенез, возбудитель Симптомы: Появляются увеличение и болезненность заднешейных и затылочных лимфоузлов, небольшая слабость, недомогание, умеренная головная боль, температура тела повышается до 38 о С. Одновременно на лице, через несколько часов на теле наблюдаются обильная сыпь в виде бледнорозовых пятнышек до 1 см круглой или овальной формы, умеренно выраженный сухой кашель, першене, саднение, сухость в горле, небольшой насморк. Повышенная температура тела и сыпь сохраняются 1-3 дня, на несколько дней дольше – увеличение лимфатических узлов. КРАСНУХА Краснуха – острое инфекционное заболевание, характеризующееся слабо выраженными явлениями общей интоксикации, неяркой мелкопятнистой сыпью по всему телу, увеличением затылочных и заднешейных лимфатических узлов и поражением плода у беременных. Причина. Заболевание вызывается вирусом, который во внешней среде нестоек, быстро погибает при высушивании, под действием ультрафиолетовых лучей и дезинфицирующих средств. Источником инфекции является человек, больной выраженной или стертой формой краснухи, протекающей без сыпи. Вирус выделяется во внешнюю среду за неделю до заболевания и в течение недели после высыпания. Заражение происходит воздушно-капельным путем. Процесс развития болезни. Вирус краснухи проникает в организм через слизистую оболочку дыхательных путей и кровью разносится по всему организму. У беременных вирус краснухи попадает в плод и приводит к замедлению его роста, а также формированию различных уродств. Заболевание краснухой на 3-4-й неделе беременности обусловливает врожденные уродства в 60% случаев, на 13-16-й неделе и позже – в 7%. После перенесенного заболевания развивается стойкая пожизненная невосприимчивость к нему. Признаки. Инкубационный период длится от 11 до 24 дней. Заболевание начинается остро. Появляются увеличение и болезненность заднешейных и затылочных лимфоузлов, небольшая слабость, недомогание, умеренная головная боль, температура тела повышается до 38 о С. Одновременно на лице, через несколько часов на теле наблюдаются обильная сыпь в виде бледнорозовых пятнышек до 1 см круглой или овальной формы, умеренно выраженный сухой кашель, першене, саднение, сухость в горле, небольшой насморк. Повышенная температура тела и сыпь сохраняются 1-3 дня, на несколько дней дольше – увеличение лимфатических узлов. Нередко краснуха проявляется только небольшим повышением температуры тела и увеличением лимфатических узлов без появления сыпи. Распознавание болезни. Диагноз краснухи может быть подтвержден исследованием крови. Лечение больных краснухой обычно проводится дома, также, как больных острыми респираторными вирусными инфекциями. Переболевшим краснухой в первые 16 недель беременности рекомендуется ее прерывание. Предупреждение болезни. Для предупреждения краснухи применяется живая ослабленная вакцина, которая через 20 дней после введения создает невосприимчивость к заболеванию в течение 10 лет. Для обеспечения стойкой невосприимчивости к краснухе достаточно одной прививки. Первичная вакцинация рекомендуется всем детям начиная с 12-15 мес. Ревакцинации следует проводить девочкам в возрасте 11-14 лет, а также женщинам не позднее, чем за 3 мес до предполагаемой беременности. Детьми вакцинация переносится очень хорошо. У взрослых могут отмечаться незначительное увеличение лимфатических узлов и кратковременное небольшое повышение температуры тела. Беременных женщин вакцинировать нельзя! Кроме того, в течение 3 мес после прививки беременность нежелательна, так как имеется риск поражения плода вирусом вакцины. Изоляция больного краснухой прекращается через 4 дня после появления сыпи.
18. Вирусы гриппа. Характеристика, принципы диагностики, специфическая профилактика.
Вирусы гриппа - РНК-содержащие вирусы - относятся к сем. Orthomyxoviridae и разделяются на вирусы А, В и С (табл. 1).
Таблица 1.
Сравнительная характеристика вирусов гриппа
Критерии |
Тип А |
Тип В |
Тип С |
Тяжесть заболевания |
++++ |
++ |
+ |
Природный резервуар |
Есть |
Нет |
Нет |
Пандемии человека |
Вызывает |
Не вызывает |
Не вызывает |
Эпидемии человека |
Вызывает |
Вызывает |
Не вызывает (лишь спорадические заболевания) |
Антигенные изменения |
Шифт, дрейф |
Дрейф |
Дрейф |
Сегментированный геном |
Да |
Да |
Да |
Чувствительность к ремантадину |
Чувствительны |
Не чувствительны |
Не чувствительны |
Чувствительность к занамивиру |
Чувствительны |
Чувствительны |
- |
Поверхностные гликопротеины |
2 (HA, NA) |
2 (HA, NA) |
1(HA) |
Вирус гриппа имеет сферическую форму и размер 80-120 нм. Сердцевина представлена одноцепочечной отрицательной цепью РНК, состоящей из 8 фрагментов, которые кодируют 11 вирусных белков.
Вирусы гриппа А широко распространены в природе и поражают как людей, так и целый ряд млекопитающих и птиц. Вирусы гриппа типов В и С выделены только от человека.
Эпидемически значимыми являются 2 подтипа вируса гриппа А — H3N2 и H1N1 и вирус гриппа типа В (А.А. Соминова с соавт, 1997; О.М. Литвинова с соавт., 2001). Итогом такой ко-циркуляции явилось развитие в один и тот же эпидсезон в различных странах эпидемий гриппа различной этиологии. Гетерогенность популяции эпидемических вирусов возрастает также за счет дивергентного характера изменчивости вирусов гриппа, что приводит к одновременной циркуляции вирусов, относящихся к различным эволюционным ветвям (О.М. Литвинова с соавт., 2001). В этих условиях создаются предпосылки для одновременного инфицирования человека различными возбудителями, что приводит к формированию смешанных популяций и реассортации как между вирусами ко-циркулирующих подтипов, так и среди штаммов в пределах одного подтипа (О.И. Киселев с соавт., 2000).
Классификация типов вирусов гриппа основана на антигенных различиях двух поверхностных гликопротеинов — гемагглютинина (НА) и нейраминидазы (NА). Согласно этой классификации вирусы гриппа и подразделяют на 3 типа — вирусы гриппа типа А, типа В и типа С. Различаются 16 подтипов НА и 9 подтипов NА.

Рис. 1. Классификация вирусов гриппа А и виды животных и птиц - промежуточные и конечные хозяева в цепи передачи инфекции к человеку. Недавно открыт 16 подтип (Н16) гемагглютинина Примечание: ∗ НА 7 и NА 7-NА8 выявили и у лошадей
На рис. 1 представлены подтипы вирусов гриппа типа А и их промежуточные хозяева и природные резервуары (перелетные птицы). К основным хозяевам вирусов гриппа А относятся те виды, которым свойственна заболеваемость гриппом.
В популяции человека до настоящего времени выявлены вирусы гриппа А только трех подтипов с НА1, НА2 и НА3. При этом вирусы содержат только два типа нейраминидазы - NА1 и NА2 (рис.1). Доказана их стабильная циркуляция в течении прошлого столетия, начиная с пандемии 1918 г (R.G. Webster et al., 1978; K.G. Nicholson et al., 2003).
Вирусы гриппа А (в меньшей степени В) обладает способностью к изменению структуры НА и NА. Для вируса гриппа А характерны два типа изменчивости:
точечные мутации в вирусном геноме с соответствующим изменением в НА и NА (антигенный дрейф);
полная замена одного или обоих поверхностных гликопротеинов (НА и NА) вируса путем реассортации/рекомбинации (антигенный шифт), в результате которого появляется принципиально новый вариант вируса, способный вызвать гриппозные пандемии.
Для вируса гриппа В антигенная изменчивость ограничивается только дрейфом, т.к. он, по-видимому, не имеет природного резервуара среди птиц и животных. Для вируса гриппа С характерна большая стабильность антигенной структуры и с ним связаны лишь локальные вспышки и спорадические случаи заболевания.
Представляет определенный интерес появление новых штаммов вируса гриппа в человеческой популяции и связанные с ними пандемии (рис. 2). На рис. 2 представлены основные антигенные шифты, ассоциированные с панедмиями ХХ века, вызванные вирусами гриппа А:
в 1918 г пандемия была вызвана вирусом типа H1N1;
в 1957 г - H2N2 штаммом А/Singapore/1/57;
в 1968 г - H3N2 штаммом A/Hong Kong/1/68;
в 1977 г - H1N1 штаммом A/USSR/1/77 (многие ученые не рассматривали это как пандемию, но с появлением этого штамма сложилась ситуация с одновременной ко-циркуляцией 2 штаммов вируса гриппа А - H3N2 и H1N1).
В 1986 г в Китае вирус А/Тайвань/1/86 вызвал обширную эпидемия гриппа А/H1N1, продолжавшуюся до 1989г. Дрейф варианты этого вируса просуществовали до 1995 г, вызывая локальные вспышки и спорадические случаи заболевания. По результатам молекулярно-биологических исследований в геноме вируса А/H1N1 в эти годы возникли множественные мутации. В 1996 г появились два антигенных варианта вируса гриппа А/H1N1: А/Берн и А/Пекин, их особенностью являлась не только антигенная, но и географическая разобщенность. Так, в России вирус гриппа А/Берн принял активное участие в эпидемии гриппа 1997-98 гг. В этот же сезон на востоке страны была зарегистрирована циркуляция штаммов вируса А/Пекин. В дальнейшем в 2000-2001 гг. вирус гриппа А/H1N1 стал возбудителем эпидемии гриппа в России. Современные вирусы гриппа А/H1N1 обладают низкой иммуногенной активностью, свежие выделенные изоляты вируса взаимодействуют только в эритроцитами млекопитающих (человека 0 группы и морских свинок).
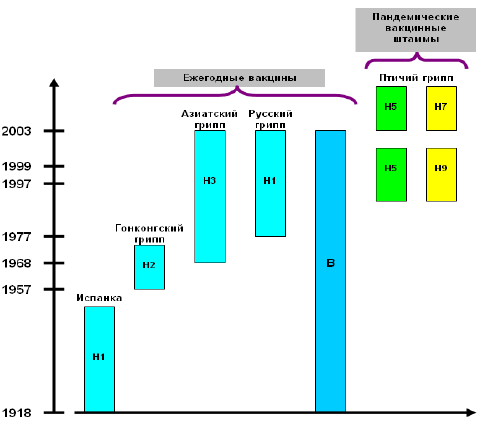
Рис. 2. Возникновение новых штаммов вируса гриппа в человеческой популяции и связанные с ними пандемии
В прошлом столетии вирусы гриппа типа А претерпели значительные генетические изменения, результатом чего явились глобальные пандемии с высокой летальностью среди людей. Самая большая пандемия гриппа (H1N1) была в 1918-1919 гг. («испанка»). Вирус, появившийся в 1918 г проделал выраженный дрейф, исходные (Hsw1N1) и конечные (H1N1) его варианты считаются шифтовыми. Вирус вызвал опустошительную эпидемия, унесшую 20 млн жизней (половина погибших - молодые люди в возрасте от 20 до 50 лет (M.T. Osterholm, 2005).
Исследования J.K. Tanbenberger et al., (2005) показали, что вирус, вызвавший пандемию 1918 г., не являлся реассортантом между птичьим вирусом гриппа и вирусом гриппа человека — все 8 генов вируса H1N1 имели больше сходство с вариантами «птичьего» вируса, нежели человеческого (рис. 3). Поэтому, по мнению R.B. Belshe (2005) вирус гриппа птиц, должен инфицировать (минуя промежуточного хозяина) человека, передаваясь от человека к человеку.
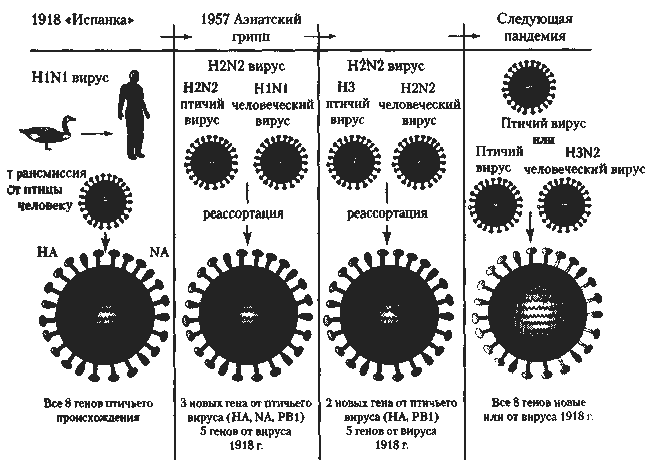
Рис. 3. Механизмы происхождения пандемических вирусов гриппа
«Азиатский» грипп (1957-1958 гг.), вызванный вирусом А/H2N2, который впервые зарегистрирован в Центральном Китае, не отличался столь драматичностью для человечества, но общая летальность в мире составила 1 -2 млн чел. Причем самая высокая смертность наблюдалась среди больных старше 65 лет. Пандемии 1957 и 1968 гг. были вызваны новыми вирусами, появившимися в результате реассортации. В 1957 г двойное инфицирование, вероятно, человека или свиньи птичьим вирусом H2N2 и человеческим вирусом H1N1 дало начало новому вирусу, содержащему гены НА, NА и ген, кодирующий один из белков полимеразы (РВ1) — от «птичьего» вируса и 5 генетических сегментов вируса гриппа H1N1 человека 1918 г. Этот вирус циркулировал в популяции человека до 1968 г, когда его вытеснил новый реассортантный вирус H3N2 (Гонконг).
«Гонконгский» грипп, вызванный вирусом А/H3N2 (1968-1969 гг.) впервые был выделен в Гонконге. Он появился в результате замены Н2 и полимеразного гена (РВ1) вируса H2N2 на 2 новых гена вируса гриппа птиц Н3 и РВ1. Остальные 6 генов этого вируса были человеческими (т.е. от предыдущего вируса 1957 г) и сегодня потомок этого вируса, согласно рис. 3, продолжает циркулировать среди людей. Гены вируса А /H3N2, происходят от вируса, вызвавшего пандемию в 1918 г (R.B. Belshe, 2005) (рис.3). Гонконгский грипп не отличался столь высокой смертностью, как в предыдущие пандемии, так как антигенные изменения произошли только в НА (антигенный шифт), а NА вируса осталась неизмененной. Наличие антител к NА, не предотвращает развития заболевания, однако может ослабить тяжесть течения инфекции (W.P. Glesen, 1996). Вполне вероятно, что низкая смертность, среди пожилых людей, связана с штаммом вируса гриппа с Н3, который циркулировал в мире в этом столетии и поэтому люди старше 60 лет имели протективные антитела к этому вирусу (L. Simonsen et al., 2004).
После 20-летнего перерыва стал снова циркулировать новый вариант вируса гриппа А/H1N1, который в 1977-1978 гг. вызвал эпидемию, достаточно умеренную, после которой в мире одновременно начали циркулировать 3 варианта возбудителя: вирусы гриппа А подтипов H1N1 и H3N2 и типа В.
Важно отметить, что вирусы гриппа птиц «участвуют» в появлении новых «человеческих» вирусов гриппа, которые характеризуются высокой патогенностью и способностью вызывать пандемии (Э.Г. Деева, 2008). Эти вирусы (H1N1, H2N2 и H3N2) имели различный набор внутренних генов, происхождение которых указывает на их филогенетическую связь с вирусами птиц и свиней.
Каковы же механизмы происхождения пандемических штаммов и какие биологические характеристики необходимы для появления высокопатогенного вируса с пандемическим потенциалом?
Для вирусов гриппа А характерна высокая частота возникновения реассортантов в результате смешанного заражения, что обусловлено сегментированностью вирусного генома. Преобладание реассортанта определенного генного состава считается результатом селекции, при которой из обширного набора разных реассортантов отбирается именно такой, который наиболее приспособлен к репродукции в данных условиях (Н.Л. Варич с соавт., 2009). Штаммоспецифические свойства геномных сегментов могут оказать сильное влияние на генный состав реассортантов в неселективных условиях. Другими словами, отличительной особенностью вирусов гриппа является то, что в восьми из генных сегментов, особенно в гене НА, происходят частые и непредсказуемые мутации. Реассортация играет важную роль в появлении новых вариантов вирусов, в частности в происхождении пандемических штаммов. И иногда нельзя исключить возможность появления на протяжении пандемии вируса с более высокой вирулентностью.
Современные исследования показали, что генная структура нового вируса А/H1N1 является сложной и в его состав, как мы уже отмечали во введении, входят гены свиного гриппа, поражающего свиней Северной Америки; гены свиного гриппа, поражающего свиней Европы и Азии; гены птичьего гриппа; гены человеческого гриппа. По сути, гены нового вируса получены из четырех различных источников. Микрофотография вируса гриппа А/H1N1 представлена на рис. 4.

Рис. 4. Микрофотография вируса гриппа А/H1N1
ВОЗ опубликовала «Руководство для лабораторий гриппа» и представила новые данные по последовательности вирусных генов и их длины реассортантного нового вируса гриппа А/H1N1 (изолят - А/California/04/2009): НА, NА, М, РВ1, РВ2, РА, NР, NS. Эти данные свидетельствуют о формировании нового пандемического варианта вируса, создавая всеобщую уязвимость перед инфекцией в виду отсутствия к иммунитета. Становится понятным, что пандемические варианты вируса гриппа возникают посредством как минимум двух механизмов:
реассортации между вирусами гриппа животных/птиц и человека;
непосредственной адаптации вируса животных/птиц к человеку.
Для понимания происхождения пандемических вирусов гриппа важное значение имеет изучение свойств природного резервуара инфекции и путях эволюции этого семейства вирусов при смене хозяина. Уже хорошо известно и это можно утверждать, что водоплавающие птицы являются природным резервуаром вирусов гриппа А (адаптированные к этим промежуточным хозяевам в течение многих столетий), о чем свидетельствует носительство всех 16 подтипов НА этого вируса. Через фекалии птиц, которые в воде могут сохраняться более 400 дней (Грипп птиц…, 2005), вирусы могут передаваться другим видам животных при употреблении воды из водоема. (K.G. Nicholson et al., 2003). Это подтверждается филогенетическим анализом последовательностей нуклеиновых кислот разных подтипов вирусов гриппа А от различных хозяев и из различных географических регионов.
Анализ последовательностей гена нуклеопротеина показал, что вирусы гриппа птиц эволюционировали с появлением 5 специфических хозяйских линий: вирусы диких и домашних лошадей, чаек, свиней и человека. Причем (!) вирусы гриппа человека и свиней составляют так называемую сестринскую группу, что свидетельствует об их близком родстве и, естественно, общем происхождении. Предшественник вирусов гриппа человека и классический свиной вирус, по-видимому, имели полностью «птичье» происхождение. В странах Средней Азии, по известным причинам, свинина не популярна, и эти животные практически отсутствуют в животноводстве. Это приводит к тому, что (в отличие от Китая, например), данный регион не имеет в популяции домашних животных основного промежуточного хозяина - свиней, поэтому вероятность «зарождения» пандемических вирусов в Среднеазиатском регионе ниже, чем в Китае, что практически и следует из данных по анализу их происхождения (Грипп птиц, 2005). Постоянный источник генов пандемических вирусов гриппа, существует ( в фенотипически неизменнном состоянии), в природном резервуаре вирусов водоплавающих и перелетных птиц (R.G. Welster, 1998). Следует иметь в виду, что предшественники вирусов, вызвавших пандемию «испанки» (1918 г), как и вирусы, явившиеся источником генома пандемических штаммов Азия/57 и Гонконг/68, до сих пор циркулируют среди популяции диких птиц с незначительными мутационными изменениями (Грипп птиц…, 2005).
19. Вирус кори. Характеристика, принципы диагностики, специфическая профилактика.
Подобно возбудителю гриппа, вирус кори (Measles virus) попадает в организм человека через дыхательные пути и размножается в эпителиальных клетках. Несмотря на то, что возбудитель кори, включая его геном, является хорошо изученным, тем не менее, многие молекулярные основы его патогенности еще не совсем понятны. Вирус кори является РНК-содержащим, имеет трехслойную оболочку: два гликопротеина выступают кнаружи от вирусной мембраны, ими являются гемагглютинин (Н) и так называемый протеин слияния (F). Третий мембранный негликозилированный матричный протеин (М) находится внутри оболочки вируса.
Вирус кори присоединяется к клетке макроорганизма своим Н-протеином, после чего происходит сборка мембраны микроорганизма в инфицированной клетке. Вначале в нее попадают вновь синтезированные протеины Н и F, а затем протеин М, который включается именно в те участки, где находятся аккумулированные Н и F протеины. Затем новые нуклеокапсиды связываются с модифицированными участками мембран и происходит полная сборка частиц возбудителя, а выход их из клетки идет путем почкования. Важнейшую роль в сборке микроорганизменных частиц играет белок М, так как он специфически узнается нуклекапсидами и, возможно, гликопротеидами.
Последние исследования выявили клеточный рецептор для вируса кори, который был идентифицирован как трансмембранный протеин CD46, один из регуляторов комплементарной активации. CD46 найден только на человеческой и обезьянней клетках, что коррелирует с естественным кругом хозяев возбудителя. CD46, выраженный на большинстве типов человеческих клеток, встречается в 14 различных изоформах, которые варьируют от ткани к ткани. Вирус кори может связывать все изоформы, что объясняет его способность инфицировать различные ткани. Среди клеток, которые возбудитель кори способен инфицировать, находятся моноциты и лимфоциты. Полагают, что вирус кори из дыхательных путей попадает в кровоток через легочные макрофаги. Во время виремии микроорганизм распространяется по всему организму, находясь внутри лейкоцитов.
Несмотря на тот факт, что возбудитель кори может инфицировать как Т-, так и В-лимфоциты, вирусная экспрессия не происходит до тех пор, пока инфицированный лейкоцит активирован. Этот феномен позволяет выдвинуть гипотезу, объясняющую активную вирусную инвазию в центральную нервную систему. Предполагается, что «молчащие» инфицированные лимфоциты попадают в ЦНС раньше, чем чужие вирусные гликопротеины окажутся на клеточной поверхности, обманывая таким образом иммунную защиту организма через стратегию «троянского коня».
Патология клетки при коревой инфекции в настоящее время полностью не изучена, как и клетка при раке легкого. Примечательным является тот факт, что возбудитель кори не ограничивает макромолекулярный синтез, хотя он может изменить экспрессию специфических клеточных генов, не разрушая цитоскелет клетки макроорганизма. В экспериментах in vitro с коревой транскрипционной системой, полученной из цитоплазматических экстрактов инфицированных клеток, было установлено, что для синтеза вирусной РНК требуется тубулин. Волокна актина могут быть вовлечены в транспорт нуклеокапсида из цитоплазмы к клеточной поверхности до почкования, и актин становится упакованным внутри возбудителя.
Промежуточные волокна участвуют в перекрестной иммунологической реактивности с фосфопротеином микроорганизма кори. Это позволяет предположить, что вирусный протеин может повредить клетку из-за «молекулярной мимикрии». Отличительным признаком коревой инфекции на клеточном уровне является формирование огромного многоядерного синцития. Когда вновь синтезированные Н и F протеины представлены на поверхности клетки организма, их присутствие приводит к слиянию инфицированной клетки со многими окружающими неинфицированными клетками с формированием характерного синцития.
20. Микоплазмы. Характеристика, принципы диагностики.
Антропонозные бактериальные инфекции человека, поражающие органы дыхания или мочеполовой тракт.
Микоплазмы относятся к классу Mollicutes, который включает 3 порядка: Acholeplasmatales, Mycoplasmatales,Anaeroplasmatales.
Морфология: Отсутствие ригидной клеточной стенки, полиморфизм клеток, пластичность, осмотическую чувствительность, резистентность к различным агентам, подавляющим синтез клеточной стенки, в том числе к пенициллину и его производным. Грам «-», лучше окрашиваются по Романовскому—Гимзе; различают подвижные и неподвижные виды. Клеточная мембрана находится в жидкокристаллическом состоянии; включает белки, погруженные в два липидных слоя, основной компонент которых — холестерин.
Культуральные свойства. Хемоорганотрофы, основной источник энергии — глюкоза или аргинин. Растут при температуре 30С. Большинство видов — факультативные анаэробы; чрезвычайно требовательны к питательным средам и условиям культивирования. Питательные среды (экстракт говяжьего сердца, дрожжевой экстракт, пептон, ДНК, глюкоза, аргинин).
Культивируют на жидких, полужидких и плотных питательных средах.
Биохимическая активность: Низкая. Выделяют 2 группы микоплазм: 1. разлагающие с образованием кислоты глюкозу, мальтозу, маннозу, фруктозу, крахмал и гликоген; 2.окисляющие глутамат и лактат, но не ферментирующие углеводы. Все виды не гидролизуют мочевину.
Антигенная структура: Сложная, имеет видовые различия; основные АГ представлены фосфо- и гликолипидами, полисахаридами и белками; наиболее иммунногенны поверхностные АГ, включающие углеводы в составе сложных гликолипидных, липогликановых и гликопротеиновых комплексов.
Факторы патогенности: адгезины, токсины, ферменты агрессии и продукты метаболизма. Адгезины входят в состав поверхностных АГ и обуславливают адгезию на клетках хозяина. Предполагают наличие нейротоксина у некоторых штаммов М. pneumoniae, так как часто инфекции дыхательных путей сопровождают поражения нервной системы. Эндотоксины выделены у многих патогенных микоплазм. У некоторых видов встречаются гемолизины. Среди ферментов агрессии основными факторами патогенности являются фосфолипаза А иаминопептидазы, гидролизующие фосфолипиды мембраны клетки. Протеазы, вызывающие дегрануляцию клеток, в том числе и тучных, расщепление молекул AT и незаменимых аминокислот.
Эпидемиология: М. pneumoniae колонизирует слизистую оболочку респираторного тракта; M. hominis, M.genitalium u U. urealyticum — «урогенитальные микоплазмы» — обитают в урогенитальном тракте.
Источник инфекции — больной человек. Механизм передачи — аэрогенный, основной путь передачи — воздушно-капельный.
Патогенез: Проникают в организм, мигрируют через слизистые оболочки, прикрепляются к эпителию через гликопротеиновые рецепторы. Микробы не проявляют выраженного цитопатогенного действия, но вызывают нарушения свойств клеток с развитием местных воспалительных реакций.
Клиника: Респираторный микоплазмоз - в форме инфекции верхних дыхательных путей, бронхита, пневмонии.Внереспираторные проявления: гемолитическая анемия, неврологические расстройства, осложнения со стороны ССС.
Иммунитет: для респираторного и урогенитального микоплазмоза характерны случаи повторного заражения.
Микробиологическая диагностика: мазки из носоглотки, мокрота, бронхиальные смывы. При урогенитальных инфекциях исследуют мочу, соскобы с уретры, влагалища.
Для лабораторной диагностики микоплазменных инфекций используют культуральный, серологический и молекулярно-генетический методы.
При серодиагностике материалом для исследования служат мазки-отпечатки тканей, соскобы из уретры,влагалиша, в которых можно обнаружить АГ микоплазм в прямой и непрямой РИФ. Микоплазмы и уреаплазмывыявляются в виде зеленых гранул.
АГ микоплазм могут быть обнаружены также в сыворотке крови больных. Для этого используют ИФА.
Для серодиагностики респираторного микоплазмоза определяют специфические AT в парных сыворотках больного. При урогенитальных микоплазмозах в ряде случаев проводят серодиагностику, AT определяют чаше всего в РПГА и ИФА.
Лечение. Антибиотики. Этиотропная химиотерапия.
Профилактика. Неспецифическая.
21. Вирусный гепатит Е. Характеристика, принципы диагностики.
Раньше (до выявления вируса гепатита E) это заболевание, вместе с гепатитами C, D, G, входило в группу так называемых гепатитов «ни А ни В».
Механизм заражения фекально-оральный, то есть болезнь передаётся от больного человека, который выделяет вирус с фекалиями. Как правило, вирус попадает в наш организм с загрязненной водой, реже - заносится через грязные руки.
Заболевают вирусом гепатита Е преимущественно молодые люди 15-29 лет. Особенно распространена эта форма гепатита в странах с жарким климатом и плохим водоснабжением.
Прогноз в большинстве случаев благоприятный. Исключение составляют женщины в последние три месяца беременности.
