
- •Часть I
- •Часть I
- •Оглавление
- •Введение
- •Лабораторно-практическое занятие № 1 Введение в фармацевтическую химию. Понятие о нормативной документации в фармации.
- •Знакомство с правилами безопасной работы в химической лаборатории.
- •Вопросы для обсуждения на семинаре.
- •3. Лабораторная работа Сравнительный анализ фс фармакопей различных стран
- •Лабораторно-практическое занятие № 2 Общие реакции подлинности лекарственных средств различных химических классов
- •1. Вопросы для обсуждения на семинаре.
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Общие фармакопейные реакции подлинности
- •Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
- •Оценка чистоты лекарственных средств: определение допустимых и недопустимых примесей
- •Лабораторно-практическое занятие № 4 Оценка качества лекарственных средств по показателю «чистота». Часть 2.
- •1. Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи
- •3. Лабораторная работа – 45 мин Оценка качества лекарственных средств по показателю «чистота»
- •Растворимость левомицетина
- •4. Защита лабораторной работы – 30 мин
- •Лабораторно-практическое занятие № 5 Оценка качества лекарственных средств по показателю «количественное определение»
- •Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Количественное определение действующего вещества в лекарственной субстанции титриметрическим методом
- •Лабораторно-практическое занятие № 6 Контрольная работа №1 «Общие вопросы фармацевтической химии»
- •Защита контрольной работы – 90 мин.
- •Лабораторно-практическая работа № 7 Фармацевтический анализ лекарственных средств p-элементов VII группы периодической системы элементов
- •Препараты галогенов
- •Абсорбционный комплекс синего цвета
- •Препараты галогенидов
- •1. Реакции на натрий.
- •Светло-желтый
- •2. Реакции на калий
- •Светло-желтый
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов VII группы псэ
- •Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
- •VI группы периодической системы элементов
- •Тиосульфат натрия/Natrii thiosulfas
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств р-элементов VI группы
- •Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементами V группы периодической системы элементов
- •Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
- •(Бура/ Borax)
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов III-IV групп
- •Лабораторно-практическое занятие № 11 Контрольная работа № 2 Фармацевтический анализ лекарственных средств p-элементов VII, VI, V, IV, III групп периодической системы элементов
- •1. Контрольный тест - 45 мин
- •2. Подготовка ответа на вопросы билета – 45 мин
- •Решите задачи:
- •3. Защита контрольных работ – 90 мин.
- •Лабораторно - практическое занятие №12 Фармацевтический анализ лекарственных средств s-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе магния
- •Лекарственные средства на основе кальция
- •Лекарственные средства на основе бария
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс s-элементов I-II групп псэ
- •Лабораторно-практическое занятие № 13 Фармацевтический анализ лекарственных средств d-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе серебра
- •Коллоидные препараты серебра
- •Лекарственные средства на основе цинка
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d- элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе железа
- •Лекарственные средства на основе платины
- •Радиофармацевтические препараты
- •Гомеопатические лекарственные средства
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d-элементов VIII группы псэ
- •Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Лекарственные средства – галогенопроизводные ациклических алканов
- •Лекарственные средства на основе спиртов
- •Лекарственные средства на основе эфиров
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств на основе спиртов
- •Лабораторно-практическое занятие № 17 Фармацевтический анализ лекарственных средств альдегидов и углеводов
- •Лекарственные средства альдегидов
- •Лекарственные средства на основе углеводов
- •1. Семинар - 90 мин
- •2.Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс альдегидов и углеводов
- •Лабораторно-практическое занятие № 18 Итоговое занятие
- •Приложение 1 Правила безопасной работы в лаборатории
- •Частные фармакопейные статьи к лабораторно-практическому занятию№1
- •Приложение 2 Общие фармакопейные статьи (Государственная фармакопея XI) определение температуры плавления
- •Определение температурных пределов перегонки
- •Определение плотности
- •Растворимость
- •Определение показателя преломления (рефрактометрия)
- •Определение оптического вращения (поляриметрия)
- •Определения, основанные на измерении поглощения электромагнитного излучения
- •Спектрофотометрия
- •Спектрофотометрия в ультрафиолетовой и видимой областях
- •Определение степени белизны порошкообразных лекарственных средств
- •Определение рН
- •Определение окраски жидкостей
- •Определение прозрачности и степени мутности жидкостей
- •Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
- •В лекарственных препаратах
- •Приложение 4 Частные фармакопейные статьи для лс р-элементов VII группы псэ (ер, перевод с английского)
- •Калия бромид (Kalii Bromidum)
- •Калия йодид (Kalii iodidum)
- •Натрия бромид ( Natrii Bromidum)
- •Натрия йодид ( Natrii iodidum)
- •Натрия фторид (Natrii fluoridum)
- •Натрия хлорид (Natrii chloridum)
- •Вода очищенная в резервуарах
- •Вода для инъекций (Aqua pro injectionibus)
- •Стерильная вода для инъекций
- •Раствор водорода пероксида (3%) (Solutio Hydrogenii peroxydi 3%)
- •Магния пероксид (Magnesii peroxydum)
- •Натрия тиосульфат (Natrii thiosulfas)
- •Натрия тетраборат (Natrii tetraboras) (Бура Borax)
- •Алюминия гидроксид (Aluminii hydroxidum)
- •Алюминия фосфат (Aluminii рhosphaS)
- •Натрия гидрокарбонат (Natrii hydrocarbonas)
- •Лития карбонат (Lithii carbonas)
- •Кальция хлорид (Сalcii chloridum)
- •Бария сульфат для рентгеноскопии (barii sulfas pro roentgeno)
- •Магния сульфат (Magnesii sulfas)
- •Магния оксид (Magnesii oxidum)
- •Серебра нитрат (Argenti nitras)
- •Цинка оксид (Zinci oxydum)
- •Цинка сульфат (Zinci sulfas)
- •Железа глюконат
- •Железа фумарат
- •Цисплатин (Cisplatinum)
- •Йодированный [I 125] альбумин для инъекций, меченный.
- •Натрия йодида [i131] раствор
- •Приложение 12 Частные фармакопейные статьи для лс галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Приложение 13 Частные фармакопейные статьи для лс альдегидов и углеводов
Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
Цель: Освоить фармакопейные методы оценки качества ЛС по показателям «чистота» (допустимые и недопустимые примеси).
Одним из важных этапов фармацевтического анализа является оценка чистоты ЛС. Примеси, встречающиеся в ЛС, могут влиять на терапевтическое действие ЛС, проявлять токсический эффект или присутствовать в виде «балласта», практически не оказывая специфического воздействия на организм. В связи с этим примеси в ЛС классифицируют на недопустимые и допустимые.
По содержанию примесей в ЛС можно судить о степени очистки фармацевтической субстанции. В частных фармакопейных статьях указывают допустимые пределы примесей: хлоридов, сульфатов, тяжёлых металлов и мышьяка, остаточных количеств органических растворителей, реагентов и побочных продуктов химического синтеза субстанций (иногда очень близких по природе к действующему веществ, их называют «родственными» примесями). Содержание примесей может оцениваться в массо-объемных долях (%), а в зарубежных фармакопеях также в ppm (parts per million - частей на миллион, мкг/мл).
Основными источниками примесей являются аппаратура, используемая в технологическом процессе получения ЛС, загрязненное сырье, растворители и химические вещества, которые используют при получении фармацевтических субстанций и лекарственных препаратов. Остаточные органические растворители – это растворители, которые используются на любой стадии производства лекарственного средства и полностью не удаляются после завершения технологического процесса. Предельно допустимое содержание органических растворителей в лекарственных средствах определяется степенью их возможного риска для здоровья человека. Определение содержания остаточных органических растворителей может быть осуществлено любыми валидированными методами. Наиболее часто для этих целей используется метод газовой хроматографии.
Общая зола – это остаток несгораемых неорганических веществ, оставшийся после сжигания и прокаливания субстанции. Этот остаток состоит из родственных минеральных примесей и посторонних минеральных примесей (земля, песок, камешки, пыль). Прокаливание ЛС проводят в муфельной печи при температуре около 600 ºС до постоянной массы, избегая появления пламени, сплавления золы и спекания ее со стенками тигля. По окончании прокаливания тигель охлаждают в эксикаторе и взвешивают.
В ЛС могут быть примеси, появление которых связано с их физическими или химическими изменениями под действием влаги, света, кислорода и других факторов окружающей среды.
Общие фармакопейные статьи включают методики определения допустимых и недопустимых примесей. Определение примесей в ЛС можно производить визуально или инструментально. Среди инструментальных методов используют колориметрический (по светопоглощению исследуемых растворов) и нефелометрический (по степени мутности) методы.
Открытие предполагаемой примеси проводят, используя эталонный раствор, содержащий предельно допустимое количество предполагаемой примеси. Для этого к раствору ЛС и эталонному раствору добавляют одинаковые количества реагентов, необходимых для обнаружения открываемой примеси, и сравнивают результаты. Интенсивность окраски или опалесценции (рассеивание света) раствора ЛС не должна превышать этот показатель для эталонного раствора (рис.1). Так, например, примесь тяжелых металлов определяют по интенсивности окраски растворов при добавлении Na2S (Ph.Eur.) или тиоацетамида CH3CSCNH2 (USP).
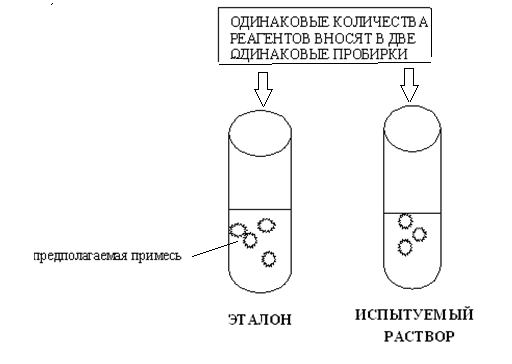
Рисунок 1. Схема определения допустимой примеси
Если устанавливают отсутствие примеси (определение недопустимой примеси), то к испытуемому раствору добавляют все необходимые по методике реактивы, кроме основного; затем полученный раствор делят на две равные части и к одной из них добавляют основной реактив. При этом не должно быть заметных различий между обеими частями раствора. Если различия обнаружены, то присутствует недопустимая примесь и ЛС не соответствует фармакопейному качеству (рис.2).

Рисунок 2. Схема определения недопустимой примеси.
Например, при проведении испытания на недопустимую примесь иона Ca2+ в ЛС «Натрия тиосульфат», к его раствору добавляют растворы NH4Cl и NH3 (аммиачный буферный раствор с постоянным значением рН) и делят раствор на две части. В одну из пробирок добавляют основной реактив - раствор оксалата аммония. Растворы в обеих пробирках не должны отличаться – в отсутствие примеси они остаются прозрачными. В присутствии ионов Са2+ в одной из пробирок образуется малорастворимый кальция оксалат CaC2O4.
При проведении испытаний необходимо следовать следующим требованиям:
1. Вода и все реактивы должны быть свободны от ионов, на содержание которых проводят испытания.
2. Пробирки и кюветы, в которых проводят наблюдения, должны быть бесцветными и одинакового диаметра.
3. Масса образца для приготовления эталонных растворов должна быть взята с точностью до 0,001 г.
4. Добавление реактивов к испытуемому и эталонному растворам должно проводиться одновременно и в одинаковых количествах.
5. Следует соблюдать интервал времени, в течение которого ведут наблюдение за результатом испытания.
6. Наблюдения мути и опалесценции растворов проводят на темном фоне, а окраски — на матово-белом фоне.
7. Эталонные растворы готовят непосредственно перед применением.
Определяемые в различных ЛС примеси имеют одну и ту же природу, поэтому методы их идентификации включены в общую ФС «Определение примесей». Ниже приведены общие методики определения примесей в ЛС неорганической природы.
Испытание на хлориды
К 10 мл раствора испытуемого ЛС, приготовленного, как указано в соответствующей частной статье, добавляют 0,5 мл азотной кислоты, 0,5 мл 2 % раствора нитрата серебра, перемешивают и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора (0,002 мг/мл) и такого же количества реактивов, какое добавлено к испытуемому раствору.
HNO3
Аg+ + Cl- ® АgСl¯
Предел обнаружения хлорид-иона — 0,1 мкг в 1 мл раствора.
Испытание на сульфаты
К 10 мл раствора испытуемого ЛС, добавляют 0,5 мл разведенной хлороводородной кислоты и 1 мл раствора хлорида бария, перемешивают и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора (0,01 мг/мл) и такого же количества реактивов, какое добавлено к испытуемому раствору. Мутность, появившаяся в испытуемом растворе, не должна превышать мутность эталона.
НСl
Ва2+ + SО42- ® ВаSО4¯
Предел обнаружения сульфат-иона – 3 мкг в 1 мл раствора.
Сульфатная зола
Точную навеску испытуемого вещества (около 1 г, если нет других указаний в частной фармакопейной статье) помещают в предварительно прокаленный и точно взвешенный фарфоровый, кварцевый или платиновый тигель, смачивают 1 мл серной кислоты концентрированной и осторожно нагревают на пламени или песчаной бане до удаления паров серной кислоты. Продолжают нагревание при более высокой температуре до исчезновения темных частиц. Затем тигель помещают в муфельную печь и прокаливают при температуре около 600 ºС до постоянной массы, избегая появления пламени, сплавления золы и спекания ее со стенками тигля. По окончании прокаливания тигель охлаждают в эксикаторе и взвешивают.
В случае трудного сгорания, прибавление серной кислоты концентрированной и прокаливание повторяют.
Испытание на соли аммония
Метод 1. К 10 мл раствора испытуемого препарата добавляют 0,15 мл реактива Несслера, перемешивают и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора (0,002 мг/мл) и количества реактива, которое было добавлено к испытуемому раствору. Окраска, появившаяся в испытуемом растворе, не должна превышать окраску эталона.
NН3 + 2К2НgI4 + 3КОН® [Нg2ОNН2]I + 7КI + 2Н2О
Предел обнаружения иона аммония - 0,3 мкг в 1 мл раствора.
Метод 2. 5 мл раствора испытуемого ЛС помещают в коническую колбу вместимостью 25 мл, добавляют 5 мл раствора едкого натра. Сверху колбы помещают смоченную водой красную лакмусовую бумагу и закрывают часовым стеклом. Колбу ставят на водяную баню. Наблюдение проводят через 5 мин.
NН4+ + ОН-® NН3 + Н2О
Предел обнаружения иона аммония - 3 мкг в 1 мл раствора.
Испытание на соли кальция
К 10 мл раствора испытуемого препарата, приготовленного как указано в соответствующей частной статье, добавляют 1 мл 10 % раствора хлорида аммония, 1 мл 10 % раствора аммиака и 1 мл раствора оксалата аммония, перемешивают и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора (0,03 мг/мл) и такого же количества реактивов, какое добавлено к испытуемому раствору. Помутнение испытуемого раствора не должно быть больше, чем в эталонном растворе.
C2O42- + Ca2+ ® СаС2О4¯
Предел обнаружения ионов кальция - 0,0035 мг (3,5 мкг) в 1 мл раствора.
Испытание на соли железа
Химические методы определения примеси железа в лекарственных средствах основаны на образовании окрашенных растворов при взаимодействии ионов железа с различными реагентами.
С сульфосалициловой кислотой соли двух- и трехвалентного железа в зависимости от концентрации образуют в аммиачной среде желтые или коричнево-красные растворы сульфосалицилатных комплексов.
К 10 мл раствора испытуемого препарата добавляют 2 мл сульфосалициловой кислоты и 1 мл раствора аммиака и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора (3 мкг ионов железа(III) в 1 мл) и такого же количества реактивов, добавленных к испытуемому раствору. Окраска, появившаяся в растворе испытуемого препарата, приготовленного как указано в соответствующей частной статье, не должна превышать окраску эталона.
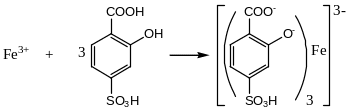
Предел обнаружения железа (II) и железа (III) - 0,05 мкг в 1 мл раствора.
С тиогликолевой кислотой в аммиачной среде или с аммония тиоцианатом в кислой среде соли трехвалентного железа в зависимости от концентрации образуют розовые или красные растворы соответствующих соединений. В этих методах двухвалентное железо переходит в трехвалентное под действием тиогликолевой кислоты или аммония персульфата.
Интенсивность окраски испытуемого раствора сравнивают с окраской эталонного раствора. Окраска, появившаяся в испытуемом растворе, не должна превышать окраску эталонного раствора.
Испытание на соли цинка
К 10 мл раствора испытуемого препарата, приготовленного как указано в соответствующей частной статье, добавляют 2 мл хлороводородной кислоты 25 %, 5 капель раствора гексацианоферрата (II) калия и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора (0,005 мг/мл) и такого же количества реактивов, какое добавлено к испытуемому раствору. Мутность испытуемого раствора, не должна превышать мутность эталона.
3Zn2+ + 2K+ + 2[Fe(CN)6]4- ® K2Zn3[Fe(CN)6]2¯
Предел обнаружения ионов цинка 1 мкг в 1 мл раствора.
Испытание на соли тяжелых металлов
Методы определения содержания примесей тяжелых металлов (свинец, ртуть, висмут, сурьма, олово, кадмий, серебро, медь, молибден, ванадий, рутений, платина, палладий) в ЛС основаны на образовании окрашенных сульфидов. Кроме указанных элементов окрашенные сульфиды дают железо в количестве более 0,05 % и мышьяк.
В качестве источника сульфидов используют раствор натрия сульфида или тиоацетамидный реактив.
После проведения реакции интенсивность окраски испытуемого раствора сравнивают с окраской эталонного раствора. Окраска, появившаяся в испытуемом растворе, не должна превышать окраску эталонного раствора.
К 10 мл раствора испытуемого препарата, приготовленного как указано в соответствующей частной статье, добавляют 1 мл разведенной уксусной кислоты, 2 капли раствора сульфида натрия, перемешивают и через 1 мин сравнивают с эталоном, содержащим 1 мл эталонного раствора (0,005 мг/мл), 9 мл воды и такого же количества реактивов, какое добавлено к испытуемому раствору.
СН3СООН
Рb2+ + S2- ® РbS¯
Предел обнаружения ионов свинца 0,5 мкг в 1 мл раствора.
Тиоацетамид – бидентатный лиганд, прочно связывающий ион Pb2+ в хелатный комплекс коричневого цвета:
2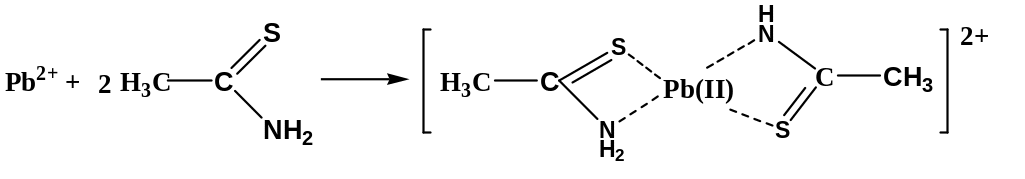
Испытание на мышьяк
Метод 1. Мышьяк (III) и мышьяк (V) при восстановлении цинком в кислой среде превращаются в арсин AsH3 - мышьяковистый водород (проба Гутцайта), который, соприкасаясь с ртутно-бромидной бумагой, полученной в опыте с испытуемым раствором, должен давать окраску не интенсивнее окраски ртутно-бромидной бумаги, полученной в опыте с эталоном.
Предел обнаружения мышьяка - 0,5 мкг в 1 мл раствора.
Метод 2. Соединения мышьяка (III) и мышьяка (V) при нагревании с солью фосфорноватистой кислоты (восстановитель) в присутствии хлороводородной кислоты восстанавливаются до элементного («металлического») мышьяка и в зависимости от количества можно наблюдать появление бурого осадка или бурого окрашивания. Например, для арсенита натрия реакция может быть представлена следующим образом:
2NaAsO2 + 3NaH2PO2 +5HCl = 2As + 3H3PO3 + 5NaCl+H2O
Определение воды
Важным показателем качества ряда ЛС является содержание в них воды. Изменение показателя «влажность» (особенно при хранении) может повлиять на содержание действующего вещества, а, следовательно, и на фармакологическую активность. Определение воды в ЛС проводят по методике, разработанной Карлом Фишером.
Реактив К.Фишера представляет собой раствор серы диоксида SO2, йода I2 и пиридина C5H5N в метиловом спирте CH3OH. Взаимодействие этого реактива с водой протекает стехиометрически в две стадии по уравнениям:
I2 + SO2 + H2O + 3C5H5N ® 2C5H5N . HI + C5H5NSO3
C5H5NSO3 + CH3OH ® C5H5N . HSO4CH3
Содержание воды (массовую долю в %) вычисляют по формуле:
![]() ,
где
,
где
Vо – объем реактива К.Фишера, израсходованный на титрование в основном опыте, в мл
Vк- объем реактива К.Фишера, израсходованный на титрование в контрольном опыте, в мл
m – навеска препарата в г
Т – титр реактива К.Фишера
С помощью реактива К. Фишера может быть определена как гигроскопическая, так и кристаллизационная вода. При этом воду можно определять в органических и неорганических соединениях, в различных растворителях и летучих веществах.
1. Вопросы для обсуждения на семинаре:
Классификация примесей. Основные источники примесей в ЛС.
В каких единицах оценивается содержание примесей?
Методы определения допустимых и недопустимых примесей в ЛС по ГФ РФ.
Методика определения воды в ЛС.
Особенности определения примесей: ионов аммония, цинка, кальция, мышьяка, железа, тяжелых металлов, хлорид-ионов, сульфат-ионов в ЛС.
2. Образцы тестовых вопросов:
Опишите метод обнаружения допустимых примесей.
Опишите метод обнаружения недопустимых примесей
Перечислите реактивы и запишите уравнения реакций, с помощью которых можно обнаружить примесь ионов аммония, цинка, кальция, мышьяка, железа, тяжелых металлов, хлорид-ионов, сульфат-ионов в ЛС.
Опишите методы определения воды в ЛС.
3. Лабораторная работа – 45 мин
