
- •Часть I
- •Часть I
- •Оглавление
- •Введение
- •Лабораторно-практическое занятие № 1 Введение в фармацевтическую химию. Понятие о нормативной документации в фармации.
- •Знакомство с правилами безопасной работы в химической лаборатории.
- •Вопросы для обсуждения на семинаре.
- •3. Лабораторная работа Сравнительный анализ фс фармакопей различных стран
- •Лабораторно-практическое занятие № 2 Общие реакции подлинности лекарственных средств различных химических классов
- •1. Вопросы для обсуждения на семинаре.
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Общие фармакопейные реакции подлинности
- •Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
- •Оценка чистоты лекарственных средств: определение допустимых и недопустимых примесей
- •Лабораторно-практическое занятие № 4 Оценка качества лекарственных средств по показателю «чистота». Часть 2.
- •1. Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи
- •3. Лабораторная работа – 45 мин Оценка качества лекарственных средств по показателю «чистота»
- •Растворимость левомицетина
- •4. Защита лабораторной работы – 30 мин
- •Лабораторно-практическое занятие № 5 Оценка качества лекарственных средств по показателю «количественное определение»
- •Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Количественное определение действующего вещества в лекарственной субстанции титриметрическим методом
- •Лабораторно-практическое занятие № 6 Контрольная работа №1 «Общие вопросы фармацевтической химии»
- •Защита контрольной работы – 90 мин.
- •Лабораторно-практическая работа № 7 Фармацевтический анализ лекарственных средств p-элементов VII группы периодической системы элементов
- •Препараты галогенов
- •Абсорбционный комплекс синего цвета
- •Препараты галогенидов
- •1. Реакции на натрий.
- •Светло-желтый
- •2. Реакции на калий
- •Светло-желтый
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов VII группы псэ
- •Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
- •VI группы периодической системы элементов
- •Тиосульфат натрия/Natrii thiosulfas
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств р-элементов VI группы
- •Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементами V группы периодической системы элементов
- •Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
- •(Бура/ Borax)
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов III-IV групп
- •Лабораторно-практическое занятие № 11 Контрольная работа № 2 Фармацевтический анализ лекарственных средств p-элементов VII, VI, V, IV, III групп периодической системы элементов
- •1. Контрольный тест - 45 мин
- •2. Подготовка ответа на вопросы билета – 45 мин
- •Решите задачи:
- •3. Защита контрольных работ – 90 мин.
- •Лабораторно - практическое занятие №12 Фармацевтический анализ лекарственных средств s-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе магния
- •Лекарственные средства на основе кальция
- •Лекарственные средства на основе бария
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс s-элементов I-II групп псэ
- •Лабораторно-практическое занятие № 13 Фармацевтический анализ лекарственных средств d-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе серебра
- •Коллоидные препараты серебра
- •Лекарственные средства на основе цинка
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d- элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе железа
- •Лекарственные средства на основе платины
- •Радиофармацевтические препараты
- •Гомеопатические лекарственные средства
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d-элементов VIII группы псэ
- •Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Лекарственные средства – галогенопроизводные ациклических алканов
- •Лекарственные средства на основе спиртов
- •Лекарственные средства на основе эфиров
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств на основе спиртов
- •Лабораторно-практическое занятие № 17 Фармацевтический анализ лекарственных средств альдегидов и углеводов
- •Лекарственные средства альдегидов
- •Лекарственные средства на основе углеводов
- •1. Семинар - 90 мин
- •2.Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс альдегидов и углеводов
- •Лабораторно-практическое занятие № 18 Итоговое занятие
- •Приложение 1 Правила безопасной работы в лаборатории
- •Частные фармакопейные статьи к лабораторно-практическому занятию№1
- •Приложение 2 Общие фармакопейные статьи (Государственная фармакопея XI) определение температуры плавления
- •Определение температурных пределов перегонки
- •Определение плотности
- •Растворимость
- •Определение показателя преломления (рефрактометрия)
- •Определение оптического вращения (поляриметрия)
- •Определения, основанные на измерении поглощения электромагнитного излучения
- •Спектрофотометрия
- •Спектрофотометрия в ультрафиолетовой и видимой областях
- •Определение степени белизны порошкообразных лекарственных средств
- •Определение рН
- •Определение окраски жидкостей
- •Определение прозрачности и степени мутности жидкостей
- •Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
- •В лекарственных препаратах
- •Приложение 4 Частные фармакопейные статьи для лс р-элементов VII группы псэ (ер, перевод с английского)
- •Калия бромид (Kalii Bromidum)
- •Калия йодид (Kalii iodidum)
- •Натрия бромид ( Natrii Bromidum)
- •Натрия йодид ( Natrii iodidum)
- •Натрия фторид (Natrii fluoridum)
- •Натрия хлорид (Natrii chloridum)
- •Вода очищенная в резервуарах
- •Вода для инъекций (Aqua pro injectionibus)
- •Стерильная вода для инъекций
- •Раствор водорода пероксида (3%) (Solutio Hydrogenii peroxydi 3%)
- •Магния пероксид (Magnesii peroxydum)
- •Натрия тиосульфат (Natrii thiosulfas)
- •Натрия тетраборат (Natrii tetraboras) (Бура Borax)
- •Алюминия гидроксид (Aluminii hydroxidum)
- •Алюминия фосфат (Aluminii рhosphaS)
- •Натрия гидрокарбонат (Natrii hydrocarbonas)
- •Лития карбонат (Lithii carbonas)
- •Кальция хлорид (Сalcii chloridum)
- •Бария сульфат для рентгеноскопии (barii sulfas pro roentgeno)
- •Магния сульфат (Magnesii sulfas)
- •Магния оксид (Magnesii oxidum)
- •Серебра нитрат (Argenti nitras)
- •Цинка оксид (Zinci oxydum)
- •Цинка сульфат (Zinci sulfas)
- •Железа глюконат
- •Железа фумарат
- •Цисплатин (Cisplatinum)
- •Йодированный [I 125] альбумин для инъекций, меченный.
- •Натрия йодида [i131] раствор
- •Приложение 12 Частные фармакопейные статьи для лс галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Приложение 13 Частные фармакопейные статьи для лс альдегидов и углеводов
Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
Испытание на хлориды. Растворы, содержащие хлориды, в зависимости от их концентрации образуют с раствором нитрата серебра белый творожистый осадок, белую муть или опалесценцию, не исчезающие от добавления азотной кислоты и легко исчезающие от добавления раствора аммиака.
Предел обнаружения хлорид-иона — 0,0001 мг (0,1 мкг) в 1 мл раствора. 0,002 мг (2 мкг) хлорид-иона в 1 мл раствора (эталонный раствор Б) дают при этой реакции хорошо заметную опалесценцию.
Определение проводят следующим образом: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, добавляют 0,5 мл азотной кислоты, 0,5 мл раствора нитрата серебра, перемешивают и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое добавлено к испытуемому раствору.
Опалесценция, появившаяся в испытуемом растворе, не должна превышать опалесценцию эталона.
Приготовление эталонного раствора хлорид-иона. 0,659 г прокаленного хлорида натрия растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора водой до метки (раствор А). 5 мл раствора А помещают в мерную колбу вместимостью 1 л и доводят объем раствора водой до метки (раствор Б). Этот раствор содержит 0,002 мг (2 мкг) хлорид-иона в 1 мл.
HNO3
Аg+ + CI- АgСI
Испытание на сульфаты. Растворы, содержащие сульфаты, в зависимости от их концентрации образуют с растворами солей бария белый осадок или муть, не исчезающие от добавления разведенной хлористоводородной кислоты.
Предел обнаружения сульфат-иона – 0,003 мг (3 мкг) в 1 мл раствора. 0,01 мг (10 мкг) сульфат-иона в 1 мл раствора (эталонный раствор Б) дает при этой реакции через 10 мин заметную муть.
Определение проводят следующим образом: к 10 мл раствора испытуемого ЛС, добавляют 0,5 мл разведенной хлористоводородной кислоты и 1 мл раствора хлорида бария, перемешивают и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое добавлено к испытуемому раствору. Мутность, появившаяся в испытуемом растворе, не должна превышать мутность эталона.
Приготовление эталонного раствора сульфат-иона: 1,814 г сульфата калия, высушенного при температуре от 100 до 105°С до постоянной массы, растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора водой до метки (раствор А). 10 мл раствора А помещают в мерную колбу вместимостью 1 л и доводят объем раствора водой до метки (раствор Б). Этот раствор содержит 0,01 мг (10 мкг) сульфат-иона в 1 мл.
НСI
Ва2+ + SО42- ВаSО4
Испытание на соли аммония.
МЕТОД 1. Растворы, содержащие ионы аммония, в зависимости от их концентрации образуют с реактивом Несслера желто-бурый осадок или желтое окрашивание. Предел обнаружения - 0,0003 мг (0,3 мкг) иона аммония в 1 мл раствора. 0,002 мг (2 мкг) иона аммония в 1 мл раствора (эталонный раствор Б) дают при этой реакции желтое окрашивание.
Определение проводят следующим образом: к 10 мл раствора испытуемого препарата добавляют 0,15 мл реактива Несслера, перемешивают и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактива, какое добавлено к испытуемому раствору. Окраска, появившаяся в испытуемом растворе, не должна превышать окраску эталона.
В препаратах, содержащих щелочно-земельные и тяжелые металлы, определение солей аммония проводят следующим образом: испытуемое вещество растворяют в возможно меньшем количестве воды, добавляют при охлаждении 2 мл раствора едкого натра и 2 мл раствора карбоната натрия (поясните, какие возможны реакции). Раствор разбавляют водой до требуемой концентрации, взбалтывают и фильтруют. В 10 мл фильтрата проводят определение, как указано выше.
В препаратах, содержащих более 0,03% примеси железа, определение проводят следующим образом: к 10 мл раствора испытуемого препарата добавляют 2 капли раствора едкого натра и 3 мл 20% раствора тартрата натрия-калия (поясните химизм протекающих процессов). После тщательного перемешивания добавляют 0,15 мл реактива Несслера и далее поступают, как указано выше.
Приготовление эталонного раствора соли аммония: 0,628 г хлорида аммония, высушенного в эксикаторе над серной кислотой до постоянной массы, растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора водой до метки (раствор А). 10 мл раствора А помещают в мерную колбу вместимостью 1 л и доводят объем раствора водой до метки (раствор Б). Этот раствор содержит 0,002 мг (2 мкг) иона аммония в 1 мл.
NН3 + 2К2НgI4 + 3КОН [ОНg2NН2 ]I- + 7КI + 2Н2О
МЕТОД II. Растворы, содержащие ионы аммония, при добавлении едкого натра выделяют аммиак, который определяют по запаху или посинению смоченной водой красной лакмусовой бумаги. Предел обнаружения иона аммония - 0,003 мг (3 мкг) в 1 мл раствора.
Определение проводят следующим образом: 5 мл раствора испытуемого ЛС помещают в коническую колбу вместимостью 25 мл, добавляют 5 мл раствора едкого натра. Сверху колбы помещают смоченную водой красную лакмусовую бумагу и закрывают часовым стеклом. Колбу ставят на водяную баню. Наблюдение проводят через 5 мин.
NН4+ + ОН- NН3 + Н2О
Испытание на ионы кальция. Ионы кальция с оксалат-ионами образуют белый мелкокристаллический осадок или белую муть, не исчезающую от добавления уксусной кислоты, но легко растворимую в соляной или азотной кислоте.
Предел обнаружения ионов кальция - 0,0035 мг (3,5 мкг) в 1 мл раствора. 0,03 мг (30 мкг) ионов кальция (эталонный раствор Б) в 1 мл вызывает помутнение раствора.
Определение ионов кальция в неорганических соединениях: К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, добавляют 1 мл раствора хлорида аммония, 1 мл раствора аммиака и 1 мл раствора оксалата аммония, перемешивают и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое добавлено к испытуемому раствору. Помутнение испытуемого раствора не должно быть больше, чем в эталонном растворе.
Приготовление эталонного раствора соли кальция: 0,749 г карбоната кальция, высушенного при температуре от 100 до 105°С до постоянной массы, взбалтывают в мерной колбе вместимостью 100 мл с 10 мл воды, добавляют постепенно разведенную хлороводородную кислоту до растворения и после удаления пузырьков углекислого газа доводят объем раствора водой до метки (раствор А). 10 мл раствора А помещают в мерную колбу вместимостью 1 л и доводят объем раствора водой до метки (раствор Б). Этот раствор содержит 0,03 мг (30 мкг) ионов кальция в 1 мл.
NH4Cl+ NH3 . Н2О
C2O42- + Ca2+ СаС2О4
Испытание на соли железа. Растворы, содержащие ионы железа (II) и железа (III), в зависимости от концентрации и рН с сульфосалициловой кислотой в аммиачной среде коричнево-красные или желтые комплексные соединения (изобразите возможную структуру образующихся комплексов).
Предел обнаружения железа (II) и железа (III) - 0,05 мкг в 1 мл раствора (красно-коричневые комплексы). 3 мкг ионов железа в 1 мл раствора образуют желтые комплексы.
Определение проводят следующим образом: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, добавляют 2 мл раствора сульфосалициловой кислоты и 1 мл раствора аммиака и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое добавлено к испытуемому раствору. Окраска, появившаяся в испытуемом растворе, не должна превышать окраску эталона.
Определение солей железа в соединениях магния: поступают, как указано выше, но перед добавлением раствора аммиака к раствору препарата добавляют 0,5 мл раствора хлорида аммония.
Определение солей железа в соединениях алюминия: к раствору препарата, приготовленного, как указано в соответствующей частной статье, добавляют 5 мл раствора сульфосалициловой кислоты и 2 мл раствора едкого натра. Полученную окраску сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое добавлено к испытуемому раствору.
Определение солей железа в органических соединениях: зольный остаток после сжигания пробы препарата в присутствии концентрированной серной кислоты обрабатывают 2 мл концентрированной хлористоводородной кислоты при нагревании на водяной бане и добавляют 2 мл воды (объясните сущность протекающих процессов). Содержимое тигля, если нужно, фильтруют в пробирку через фильтр небольшого диаметра, тигель и фильтр промывают 3 мл воды, присоединяя промывные воды к фильтрату. Раствор нейтрализуют концентрированным раствором аммиака и доводят объем раствора водой до 10 мл. Далее поступают, как указано выше.
Приготовление эталонного раствора соли железа (III): Около 2,5 г железо-аммонийных квасцов (точная масса) растворяют в воде в мерной колбе вместимостью 100 мл и доводят объем раствора водой до метки, 20 мл этого раствора переносят в колбу с притертой пробкой, добавляют 10 мл хлористоводородной кислоты и 2 г йодида калия, смесь взбалтывают и оставляют в темном месте на 30 мин, затем добавляют 50 мл воды и титруют раствором тиосульфата натрия (0,1 моль/л) (индикатор — крахмал). 1 мл раствора тиосульфата натрия соответствует 0,0056 г железа.
На основании полученных результатов готовят 0,1% раствор железо(III)-иона, для чего рассчитанное количество железоаммонийных квасцов растворяют в воде в мерной колбе вместимостью 100 мл, добавляют 1 мл хлороводородной кислоты и доводят объем раствора водой до метки (раствор А). 15 мл раствора А помещают в мерную колбу вместимостью 500 мл и доводят объем раствора водой до метки (раствор Б). 10 мл раствора Б помещают в мерную колбу вместимостью 100 мл и доводят объем раствора водой до метки (раствор В). Этот раствор содержит 0,003 мг (3 мкг) ионов железа(III) в 1 мл. Раствор В пригоден только в день его приготовления.
Испытание на соли цинка. Растворы, содержащие ионы цинка, в зависимости от концентрации образуют с раствором гексацианоферрата (II) калия белый осадок, нерастворимый в разведенных кислотах.
Предел обнаружения ионов цинка 1 мкг в 1 мл раствора. 5 мкг ионов цинка в 1 мл раствора дают при этой реакции хорошо заметную муть.
Определение проводят следующим образом: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, добавляют 2 мл хлористоводородной кислоты, 5 капель раствора гексацианоферрата (II) калия и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое добавлено к испытуемому раствору. Муть, появившаяся в испытуемом растворе, не должна превышать эталон.
В случае появления в испытуемом растворе синего окрашивания, мешающего нефелометрическому сравнению, следует предварительно отделить железо. Для этого к испытуемому раствору, нагретому до кипения, добавляют раствор аммиака до отчетливого запаха и смесь фильтруют. В соответствующей части фильтрата определяют цинк.
Приготовление эталонного раствора ионов цинка: 0,625 г оксида цинка, предварительно прокаленного до постоянной массы, растворяют в 10 мл азотной кислоты, переносят в мерную колбу вместимостью 500 мл и доводят объем раствора водой до метки (раствор А). 1 мл раствора А помещают в мерную колбу вместимостью 200 мл, добавляют 4 капли азотной кислоты и доводят объем раствора водой до метки (раствор Б). Этот раствор содержит 5 мкг ионов цинка в 1 мл.
3Zn2+ + 2K4[Fe(CN)6] + НСI K2Zn3[Fe(CN)6]2 + 6K+
Испытание на соли тяжелых металов. Растворы, содержащие ионы свинца, в зависимости от концентрации образуют с растворами сульфида натрия или сероводорода черный осадок или бурое окрашивание раствора. 0,5 мкг ионов свинца в 1 мл раствора (предел обнаружения) дают при этой реакции при наблюдении в слое толщиной от 6 до 8 см заметное бурое окрашивание
Определение проводят следующим образом: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, добавляют 1 мл разведенной уксусной кислоты, 2 капли раствора сульфида натрия, перемешивают и через 1 мин сравнивают с эталоном, состоящим из 1 мл эталонного раствора Б, такого же количества реактивов, какое добавлено к испытуемому раствору, и 9 мл воды.
Наблюдение окраски проводят по оси пробирок диаметром около 1,5 см, помещенных на белой поверхности. В сравниваемых растворах допустима лишь слабая опалесценция от серы, выделяющейся из сульфида натрия.
В препаратах, содержащих железо в количестве 0,05% и более, определение тяжелых металлов проводят после отделения железа, согласно указаниям в соответствующих частных статьях.
СН3СООН
Рb2+ + S2- РbS
Следует иметь в виду, что в Европейской Фармакопее в качестве реагента на тяжелые металлы используют тиоацетамид, который образует лиганд, окрашенный в коричневый цвет:
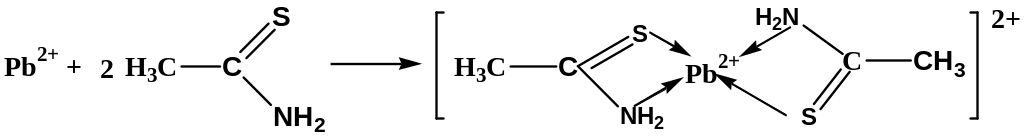
Но ни одна фармакопея не дает четкого определения термину «тяжелые металлы», что, в свою очередь, вносит много вопросов в интерпретацию описанной выше методики. Так, не ясно, как повлияет на окраску темных сульфидов возможное присутствие в испытуемом образце ионов кадмия, цинка, марганца, образующих соответственно желтый, белый и телесный сульфиды. Несомненно, что эталонный визуальный метод должен остаться в прошлом, а определение тяжелых металлов в лекарственных средствах должно проводиться методами атомной абсорбции (ААС) или атомно-эмиссионной спектрометрии с индуктивно связанной плазмой (АЭС-ИСП), как это и происходит на ведущих фирмах-производителях.
Приготовление эталонного раствора ионов свинца: 0,915 г свежеперекристаллизованного ацетата свинца растворяют в воде в мерной колбе вместимостью 1 л, добавляют 1 мл разведенной уксусной кислоты и доводят объем раствора водой до метки (раствор А). 1 мл раствора А помещают в мерную колбу вместимостью 100 мл и доводят объем раствора водой до метки (раствор Б); раствор содержит 5 мкг ионов свинца в 1 мл. Раствор Б пригоден только в день его приготовления.
Испытание на мышьяк. Методы определения предельного содержания мышьяка в лекарственных средствах основаны на восстановлении соединений мышьяка до мышьяковистого водорода с последующим получением желто-бурого продукта реакции (метод 1) или до металлического мышьяка (метод 2).
Метод 1
Прибор (рис. 4.3). Состоит из конической колбы (1) вместимостью 100 мл, закрывающейся пробкой, через которую проходит стеклянная трубка (2), расширенная в верхней части, длина расширенной части трубки 120–150 мм, внутренний диаметр – 10–12 мм. В нижнюю часть трубки помещают тампон (3) из 50–60 мг не плотно упакованной свинцово-ацетатной ваты. Верхняя расширенная часть трубки закрыта пробкой, через которую проходит вторая стеклянная трубка (4) длиной 100 мм и внутренним диаметром 5–6 мм. Нижнюю часть второй трубки закрывают полоской ртутно-бромидной бумаги (5) шириной 6 мм. Верхние края полоски закреплены между стенками первой трубки и пробкой.
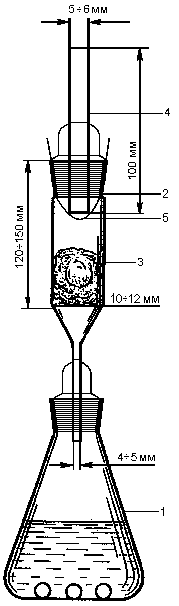
Рис. 4.3. Прибор для определения мышьяка
