
- •Часть I
- •Часть I
- •Оглавление
- •Введение
- •Лабораторно-практическое занятие № 1 Введение в фармацевтическую химию. Понятие о нормативной документации в фармации.
- •Знакомство с правилами безопасной работы в химической лаборатории.
- •Вопросы для обсуждения на семинаре.
- •3. Лабораторная работа Сравнительный анализ фс фармакопей различных стран
- •Лабораторно-практическое занятие № 2 Общие реакции подлинности лекарственных средств различных химических классов
- •1. Вопросы для обсуждения на семинаре.
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Общие фармакопейные реакции подлинности
- •Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
- •Оценка чистоты лекарственных средств: определение допустимых и недопустимых примесей
- •Лабораторно-практическое занятие № 4 Оценка качества лекарственных средств по показателю «чистота». Часть 2.
- •1. Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи
- •3. Лабораторная работа – 45 мин Оценка качества лекарственных средств по показателю «чистота»
- •Растворимость левомицетина
- •4. Защита лабораторной работы – 30 мин
- •Лабораторно-практическое занятие № 5 Оценка качества лекарственных средств по показателю «количественное определение»
- •Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Количественное определение действующего вещества в лекарственной субстанции титриметрическим методом
- •Лабораторно-практическое занятие № 6 Контрольная работа №1 «Общие вопросы фармацевтической химии»
- •Защита контрольной работы – 90 мин.
- •Лабораторно-практическая работа № 7 Фармацевтический анализ лекарственных средств p-элементов VII группы периодической системы элементов
- •Препараты галогенов
- •Абсорбционный комплекс синего цвета
- •Препараты галогенидов
- •1. Реакции на натрий.
- •Светло-желтый
- •2. Реакции на калий
- •Светло-желтый
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов VII группы псэ
- •Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
- •VI группы периодической системы элементов
- •Тиосульфат натрия/Natrii thiosulfas
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств р-элементов VI группы
- •Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементами V группы периодической системы элементов
- •Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
- •(Бура/ Borax)
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов III-IV групп
- •Лабораторно-практическое занятие № 11 Контрольная работа № 2 Фармацевтический анализ лекарственных средств p-элементов VII, VI, V, IV, III групп периодической системы элементов
- •1. Контрольный тест - 45 мин
- •2. Подготовка ответа на вопросы билета – 45 мин
- •Решите задачи:
- •3. Защита контрольных работ – 90 мин.
- •Лабораторно - практическое занятие №12 Фармацевтический анализ лекарственных средств s-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе магния
- •Лекарственные средства на основе кальция
- •Лекарственные средства на основе бария
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс s-элементов I-II групп псэ
- •Лабораторно-практическое занятие № 13 Фармацевтический анализ лекарственных средств d-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе серебра
- •Коллоидные препараты серебра
- •Лекарственные средства на основе цинка
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d- элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе железа
- •Лекарственные средства на основе платины
- •Радиофармацевтические препараты
- •Гомеопатические лекарственные средства
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d-элементов VIII группы псэ
- •Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Лекарственные средства – галогенопроизводные ациклических алканов
- •Лекарственные средства на основе спиртов
- •Лекарственные средства на основе эфиров
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств на основе спиртов
- •Лабораторно-практическое занятие № 17 Фармацевтический анализ лекарственных средств альдегидов и углеводов
- •Лекарственные средства альдегидов
- •Лекарственные средства на основе углеводов
- •1. Семинар - 90 мин
- •2.Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс альдегидов и углеводов
- •Лабораторно-практическое занятие № 18 Итоговое занятие
- •Приложение 1 Правила безопасной работы в лаборатории
- •Частные фармакопейные статьи к лабораторно-практическому занятию№1
- •Приложение 2 Общие фармакопейные статьи (Государственная фармакопея XI) определение температуры плавления
- •Определение температурных пределов перегонки
- •Определение плотности
- •Растворимость
- •Определение показателя преломления (рефрактометрия)
- •Определение оптического вращения (поляриметрия)
- •Определения, основанные на измерении поглощения электромагнитного излучения
- •Спектрофотометрия
- •Спектрофотометрия в ультрафиолетовой и видимой областях
- •Определение степени белизны порошкообразных лекарственных средств
- •Определение рН
- •Определение окраски жидкостей
- •Определение прозрачности и степени мутности жидкостей
- •Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
- •В лекарственных препаратах
- •Приложение 4 Частные фармакопейные статьи для лс р-элементов VII группы псэ (ер, перевод с английского)
- •Калия бромид (Kalii Bromidum)
- •Калия йодид (Kalii iodidum)
- •Натрия бромид ( Natrii Bromidum)
- •Натрия йодид ( Natrii iodidum)
- •Натрия фторид (Natrii fluoridum)
- •Натрия хлорид (Natrii chloridum)
- •Вода очищенная в резервуарах
- •Вода для инъекций (Aqua pro injectionibus)
- •Стерильная вода для инъекций
- •Раствор водорода пероксида (3%) (Solutio Hydrogenii peroxydi 3%)
- •Магния пероксид (Magnesii peroxydum)
- •Натрия тиосульфат (Natrii thiosulfas)
- •Натрия тетраборат (Natrii tetraboras) (Бура Borax)
- •Алюминия гидроксид (Aluminii hydroxidum)
- •Алюминия фосфат (Aluminii рhosphaS)
- •Натрия гидрокарбонат (Natrii hydrocarbonas)
- •Лития карбонат (Lithii carbonas)
- •Кальция хлорид (Сalcii chloridum)
- •Бария сульфат для рентгеноскопии (barii sulfas pro roentgeno)
- •Магния сульфат (Magnesii sulfas)
- •Магния оксид (Magnesii oxidum)
- •Серебра нитрат (Argenti nitras)
- •Цинка оксид (Zinci oxydum)
- •Цинка сульфат (Zinci sulfas)
- •Железа глюконат
- •Железа фумарат
- •Цисплатин (Cisplatinum)
- •Йодированный [I 125] альбумин для инъекций, меченный.
- •Натрия йодида [i131] раствор
- •Приложение 12 Частные фармакопейные статьи для лс галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Приложение 13 Частные фармакопейные статьи для лс альдегидов и углеводов
Определение рН
Водородным показателем (рН) называется отрицательный десятичный логарифм активности ионов водорода.
рН = - lg аН+.
Измерение рН заключается в сравнении потенциала индикаторного электрода, погруженного в испытуемый раствор, с потенциалом того же электрода в стандартном буферном растворе с известным значением рН.
При калибровке рН-метров пользуются шкалой стандартных буферных растворов.
Потенциометрический метод измерения рН. Потенциометрическое определение рН заключается в измерении ЭДС элемента, состоящего из двух электродов: индикаторного, потенциал которого зависит от активности ионов водорода, и электрода сравнения - стандартного электрода с известной величиной потенциала.
В качестве индикаторных электродов для измерения рН на практике применяют стеклянный и хингидронный электроды. В отдельных случаях в качестве индикаторного электрода можно использовать водородный электрод.
Для измерения рН применяют высокоомные потенциометры различных систем или рН-метры, шкала которых градуирована в милливольтах или непосредственно в единицах рН.
Подготовка рН-метра и электродной системы производится согласно инструкциям, прилагаемым к прибору.
Калибровка и проверка рН-метров проводится по стандартным буферным растворам.
Различие между показанием прибора и номинальным значением рН буферного раствора не должно превышать 0,04 единицы рН.
Если рН контролируемого раствора отличается менее чем на единицу от рН стандартного буферного раствора, то достаточна проверка прибора по одному буферному раствору, величина рН которого лежит в том же диапазоне измерения, что и значения рН контролируемого раствора.
Если рН контролируемых растворов находятся в широких пределах, то проверку рН-метра следует производить по двум стандартным буферным растворам в соответствии с инструкцией.
При измерении рН контролируемых растворов отсчет величины рН по шкале прибора производят после того, как показания прибора примут установившееся значение. Время установления показаний определяется буферными свойствами и температурой раствора (обычно время установления показаний не превышает 2 мин).
Определение рН проводят при 25 ±2oC, в противном случае необходимо сделать соответствующие поправки.
При измерении рН сильнокислых и сильнощелочных растворов при температурах, близких к 0oC, или при измерении рН растворов с очень малой буферной емкостью (например, дистиллированной воды) время установления показаний может достигать нескольких минут.
При измерении рН в неводных и смешанных растворителях, а также в некоторых коллоидных системах следует иметь в виду, что полученные значения рН являют условными.
Определение окраски жидкостей
Окраску жидкостей определяют визуально путем сравнения с соответствующими эталонами. Исследуемые жидкости и эталоны берут для сравнения в равных количествах. Сравнение производят в пробирках одинакового стекла и диаметра при дневном отраженном свете на матово - белом фоне.
Окраска исследуемого образца должна быть вполне идентична эталону или только приближаться к отмеченной окраске, не превышая ее по интенсивности, но несколько отличаясь от нее по тону.
Жидкость, которая должна быть бесцветной, рассматривают сверху через весь слой жидкости на матово - белом фоне. Бесцветными считают жидкости, которые по цвету не отличаются от воды, а в случае растворов - от соответствующего растворителя.
Приготовление исходных растворов
Раствор А. Около 6,00 г (точная навеска) растертого хлорида кобальта (СоCl2 х 6Н2О; М.м. 237,93) растворяют в растворе серной кислоты (0,1 моль/л) в мерной колбе вместимостью 100 мл, перемешивают и доводят объем раствора раствором серной кислоты (0,1 моль/л) до метки.
Содержание хлорида кобальта в растворе определяют следующим образом: 5 мл раствора хлорида кобальта помещают в коническую колбу вместимостью 250 мл с притертой пробкой, прибавляют 5 мл 3% раствора перекиси водорода и 30 мл раствора едкого натра, смесь кипятят с обратным холодильником в течение 10 мин, затем охлаждают до комнатной температуры, прибавляют 2 г йодида калия и 15 мл 50% раствора серной кислоты. Выделившийся йод титруют раствором тиосульфата натрия (0,1 моль/л) (индикатор - крахмал).
Параллельно проводят контрольный опыт.
1 мл раствора тиосульфата натрия (0,1 моль/л) соответствует 0,02379 г хлорида кобальта (II).
Объем раствора хлорида кобальта (СоCl2 х 6Н2О) разбавляют таким образом, чтобы содержание хлорида кобальта в 1 мл составляло 0,060 г.
Раствор Б. 0,4900 г растертого бихромата калия (К2Сr2О7; Мr 294,18) растворяют в растворе серной кислоты (0,1 моль/л) в мерной колбе вместимостью 100 мл и доводят объем раствора раствором серной кислоты (0,1 моль/л) до метки. 1 мл полученного раствора должен содержать 0,0049 г бихромата калия (К2Сr2О7).
Содержание бихромата калия в растворе определяют следующим образом: 20 мл раствора бихромата калия помещают в коническую колбу вместимостью 250 мл с притертой пробкой, прибавляют 30 мл разведенной хлористоводородной кислоты, 1 г йодида калия, оставляют на 5 мин в темном месте, затем прибавляют 80 мл воды и титруют выделившийся йод раствором тиосульфата натрия (0,1 моль/л) (индикатор - крахмал) до изменения окраски в зеленый цвет.
Параллельно проводят контрольный опыт.
1 мл раствора тиосульфата натрия (0,1 моль/л) соответствует 0,0049 г дихромата калия.
Раствор В. Около 6,00 г (точная навеска) растертого сульфата меди (II) (СuSО4 х 5Н2О; М.м. 249,68) растворяют в растворе серной кислоты (0,1 моль/л) в мерной колбе вместимостью 100 мл и доводят объем раствора раствором серной кислоты (0,1 моль/л) до метки.
Содержание сульфата меди в растворе определяют следующим образом: 10 мл раствора сульфата меди помещают в коническую колбу вместимостью 250 мл с притертой пробкой, прибавляют 40 мл воды, 4 мл разведенной уксусной кислоты, 3 г йодида калия, смесь перемешивают и выделившийся йод титруют раствором тиосульфата натрия (0,1 моль/л) (индикатор - крахмал).
Параллельно проводят контрольный опыт.
1 мл раствора тиосульфата натрия (0,1 моль/л) соответствует 0,02497 г сульфата меди (II). Объем раствора сульфата меди (CuSО4 х 5H2О) разбавляют таким образом, чтобы содержание сульфата меди в 1 мл составляло 0,060 г.
Раствор Г. Около 4,50 г (точная навеска) хлорида железа (III) (FеСl3 х 6Н2О; М.м. 270,30) растворяют в мерной колбе вместимостью 100 мл в растворе серной кислоты (0,1 моль/л) и доводят объем раствора раствором серной кислоты (0,1 моль/л) до метки.
Содержание хлорида железа (III) в растворе определяют следующим образом: 10 мл раствора хлорида железа помещают в коническую колбу вместимостью 250 мл с притертой пробкой, прибавляют 15 мл разведенной хлористоводородной кислоты, 4 г йодида калия и оставляют на 15 мин в темном месте. После прибавления 100 мл воды выделившийся йод титруют раствором тиосульфата натрия (0,1 моль/л) (индикатор - крахмал).
1 мл раствора тиосульфата натрия (0,1 моль/л) соответствует 0,02703 г хлорида железа (III).
Объем раствора хлорида железа (FеСl3 х 6Н2О) разбавляют таким образом, чтобы содержание хлорида железа в 1 мл составляло 0,045г.
Срок годности исходных растворов 1 год.
Приготовление основных растворов
Основные растворы получают смешением исходных растворов хлорида кобальта (А), бихромата калия (Б), сульфата меди (В) и хлорида железа (Г) с раствором серной кислоты (0,1 моль/л) в следующих соотношениях.
Основной раствор |
Раствор А, мл |
Раствор Б, мл |
Раствор В, мл |
Раствор Г, мл |
Раствор серной кислоты, (0,1 моль /л), мл |
I |
35,00 |
8,00 |
17,00 |
40,00 |
- |
II |
9,50 |
10,70 |
1,90 |
4,00 |
73,90 |
III |
40,50 |
6,30 |
6,10 |
12,00 |
35,10 |
IV |
3,50 |
10,40 |
20,10 |
4,00 |
62,00 |
Срок годности основных растворов 1 год.
Приготовление эталонов
Эталоны для сравнения приготавливают из основных растворов путем разбавления их раствором серной кислоты (0,1 моль/л).
Эталоны следует хранить по 5 мл в бесцветных, герметически укупоренных пробирках или запаянных ампулах вместимостью 5 мл в защищенном от света месте.
Срок годности эталонов N 1, 2, 3, 4 - 4 дня. Эталоны N 5, 6, 7 следует применять свежеприготовленными.
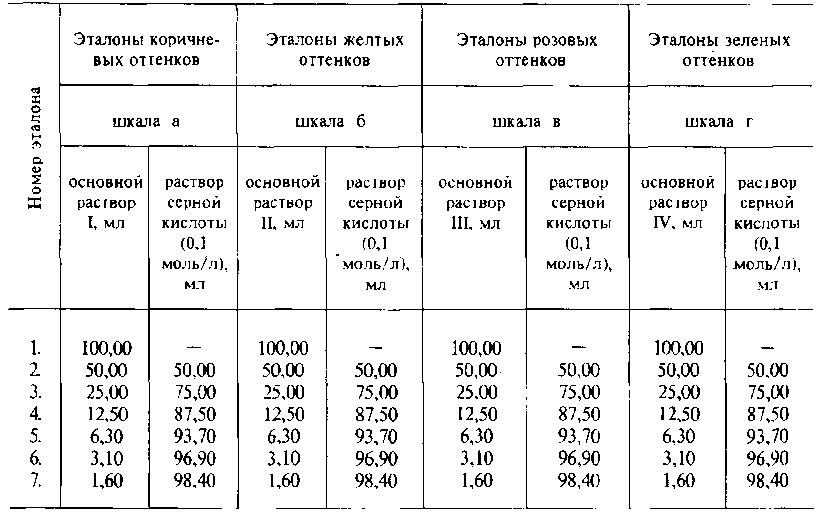
При сравнении окраски испытуемого раствора с эталонами указывают, кроме номера эталона, букву шкалы. Например, окраска раствора не должна превышать эталон N 5б.
Примечание. Раствор серной кислоты (0,1 моль/л): медленно и осторожно, при постоянном перемешивании, вливают 6 мл концентрированной серной кислоты в 1020 мл воды.
