- •Часть I
- •Часть I
- •Оглавление
- •Введение
- •Лабораторно-практическое занятие № 1 Введение в фармацевтическую химию. Понятие о нормативной документации в фармации.
- •Знакомство с правилами безопасной работы в химической лаборатории.
- •Вопросы для обсуждения на семинаре.
- •3. Лабораторная работа Сравнительный анализ фс фармакопей различных стран
- •Лабораторно-практическое занятие № 2 Общие реакции подлинности лекарственных средств различных химических классов
- •1. Вопросы для обсуждения на семинаре.
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Общие фармакопейные реакции подлинности
- •Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
- •Оценка чистоты лекарственных средств: определение допустимых и недопустимых примесей
- •Лабораторно-практическое занятие № 4 Оценка качества лекарственных средств по показателю «чистота». Часть 2.
- •1. Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи
- •3. Лабораторная работа – 45 мин Оценка качества лекарственных средств по показателю «чистота»
- •Растворимость левомицетина
- •4. Защита лабораторной работы – 30 мин
- •Лабораторно-практическое занятие № 5 Оценка качества лекарственных средств по показателю «количественное определение»
- •Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Количественное определение действующего вещества в лекарственной субстанции титриметрическим методом
- •Лабораторно-практическое занятие № 6 Контрольная работа №1 «Общие вопросы фармацевтической химии»
- •Защита контрольной работы – 90 мин.
- •Лабораторно-практическая работа № 7 Фармацевтический анализ лекарственных средств p-элементов VII группы периодической системы элементов
- •Препараты галогенов
- •Абсорбционный комплекс синего цвета
- •Препараты галогенидов
- •1. Реакции на натрий.
- •Светло-желтый
- •2. Реакции на калий
- •Светло-желтый
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов VII группы псэ
- •Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
- •VI группы периодической системы элементов
- •Тиосульфат натрия/Natrii thiosulfas
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств р-элементов VI группы
- •Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементами V группы периодической системы элементов
- •Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
- •(Бура/ Borax)
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов III-IV групп
- •Лабораторно-практическое занятие № 11 Контрольная работа № 2 Фармацевтический анализ лекарственных средств p-элементов VII, VI, V, IV, III групп периодической системы элементов
- •1. Контрольный тест - 45 мин
- •2. Подготовка ответа на вопросы билета – 45 мин
- •Решите задачи:
- •3. Защита контрольных работ – 90 мин.
- •Лабораторно - практическое занятие №12 Фармацевтический анализ лекарственных средств s-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе магния
- •Лекарственные средства на основе кальция
- •Лекарственные средства на основе бария
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс s-элементов I-II групп псэ
- •Лабораторно-практическое занятие № 13 Фармацевтический анализ лекарственных средств d-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе серебра
- •Коллоидные препараты серебра
- •Лекарственные средства на основе цинка
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d- элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе железа
- •Лекарственные средства на основе платины
- •Радиофармацевтические препараты
- •Гомеопатические лекарственные средства
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d-элементов VIII группы псэ
- •Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Лекарственные средства – галогенопроизводные ациклических алканов
- •Лекарственные средства на основе спиртов
- •Лекарственные средства на основе эфиров
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств на основе спиртов
- •Лабораторно-практическое занятие № 17 Фармацевтический анализ лекарственных средств альдегидов и углеводов
- •Лекарственные средства альдегидов
- •Лекарственные средства на основе углеводов
- •1. Семинар - 90 мин
- •2.Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс альдегидов и углеводов
- •Лабораторно-практическое занятие № 18 Итоговое занятие
- •Приложение 1 Правила безопасной работы в лаборатории
- •Частные фармакопейные статьи к лабораторно-практическому занятию№1
- •Приложение 2 Общие фармакопейные статьи (Государственная фармакопея XI) определение температуры плавления
- •Определение температурных пределов перегонки
- •Определение плотности
- •Растворимость
- •Определение показателя преломления (рефрактометрия)
- •Определение оптического вращения (поляриметрия)
- •Определения, основанные на измерении поглощения электромагнитного излучения
- •Спектрофотометрия
- •Спектрофотометрия в ультрафиолетовой и видимой областях
- •Определение степени белизны порошкообразных лекарственных средств
- •Определение рН
- •Определение окраски жидкостей
- •Определение прозрачности и степени мутности жидкостей
- •Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
- •В лекарственных препаратах
- •Приложение 4 Частные фармакопейные статьи для лс р-элементов VII группы псэ (ер, перевод с английского)
- •Калия бромид (Kalii Bromidum)
- •Калия йодид (Kalii iodidum)
- •Натрия бромид ( Natrii Bromidum)
- •Натрия йодид ( Natrii iodidum)
- •Натрия фторид (Natrii fluoridum)
- •Натрия хлорид (Natrii chloridum)
- •Вода очищенная в резервуарах
- •Вода для инъекций (Aqua pro injectionibus)
- •Стерильная вода для инъекций
- •Раствор водорода пероксида (3%) (Solutio Hydrogenii peroxydi 3%)
- •Магния пероксид (Magnesii peroxydum)
- •Натрия тиосульфат (Natrii thiosulfas)
- •Натрия тетраборат (Natrii tetraboras) (Бура Borax)
- •Алюминия гидроксид (Aluminii hydroxidum)
- •Алюминия фосфат (Aluminii рhosphaS)
- •Натрия гидрокарбонат (Natrii hydrocarbonas)
- •Лития карбонат (Lithii carbonas)
- •Кальция хлорид (Сalcii chloridum)
- •Бария сульфат для рентгеноскопии (barii sulfas pro roentgeno)
- •Магния сульфат (Magnesii sulfas)
- •Магния оксид (Magnesii oxidum)
- •Серебра нитрат (Argenti nitras)
- •Цинка оксид (Zinci oxydum)
- •Цинка сульфат (Zinci sulfas)
- •Железа глюконат
- •Железа фумарат
- •Цисплатин (Cisplatinum)
- •Йодированный [I 125] альбумин для инъекций, меченный.
- •Натрия йодида [i131] раствор
- •Приложение 12 Частные фармакопейные статьи для лс галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Приложение 13 Частные фармакопейные статьи для лс альдегидов и углеводов
Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
Перечень лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров в соответствие с учебной программой:
Хлорэтил / Aethylii chloridum
Галотан / Halothanum
Спирт этиловый / Spiritus aethylicus
Глицерин / Glycerinum
Эфир медицинский / Aether medicinalis
Нитроглицерин / Nitroglycerinum
Лекарственные средства – галогенопроизводные ациклических алканов
Для медицины важную роль играют галогенопроизводные углеводородов, в которых один или несколько атомов водорода замещены на атомы галогенов (фтор, хлор, бром или йод). Каждый из этих элементов оказывает свое, особое, влияние на химические, физические и фармакологические свойства вещества.
Физиологическое действие галогенопроизводных углеводородов основано на том, что, обладая способностью растворяться в жирах, они вызывают физические и коллоидные изменения в липидах нервной ткани и тем самым производят анестетический эффект. Газообразные и жидкие галогенопроизводные углеводородов обладают наркотическим действием, причем более активным, чем незамещенные углеводороды. Наркотическая активность зависит от природы галогена. Хлорзамещенные производные являются более активными, чем соответствующие бромзамещенные, а последние в свою очередь более активны, чем йодопроизводные. Сила наркотического действия галогенпроизводных углеводородов, а также их токсичность зависит от степени галогенирования углеводорода. С увеличением числа галогенов в молекуле углеводорода возрастают его наркотические свойства, а вместе с этим токсичность.
В связи с прочным ковалентным связыванием с атомом углерода реакцией с раствором нитрата серебра галоген обнаружить не удается.
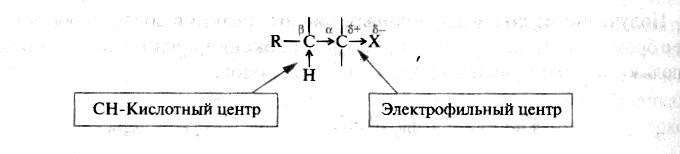
В химическом отношении галогенопроизводные углеводородов весьма реакционноспособны. Реакционная способность галогенов определяется характером связи углерод–галоген. Наличие в молекуле галогеноалканов электроотрицательного атома галогена приводит к перераспределению электронной плотности, в результате чего возникают два реакционных центра:
Электрофильный центр – атом углерода, связанный с галогеном.
Электрофильный центр возникает вследствие поляризации связи С-Наl и может подвергаться атаке нуклеофильными частицами (нуклеофильное замещение SN). В качестве нуклеофилов могут выступать отрицательно заряженные ионы Н- (гидрид-ион), Вr-, Cl-, I- (галогенид-ионы) и т.д.
СН-кислотный центр – полярная связь С-Н у атома углерода в -положении к галогену.
Свойства ЛС галогенпроизводные углевоводородов описаны в таблице 16-1:
Таблица 16-1. Лекарственные средства галогенпроизводные углевоводородов
Лекарственное вещество Структурная формула |
Описание Фармакологическая группа, применение |
Хлорэтил Aethylii chloridum
этил хлорид |
Газообразный при комнатной температуре и давлении, но обычно сжимается до бесцветной, подвижной, легковоспламеняющейся и очень летучей жидкости. Обладает характерным эфирным запахом. Легко растворим в воде, смешивается с этанолом (96%) и эфиром. Хлорэтил применяют как местноанестезирующее средство для обезболивания поверхности ткани, уменьшения кожного зуда, лечения рожистого воспаления. |
Галотан Halothanum
(RS)-2-бромо-2-хлоро-1,1,1-трифтороэтан |
Прозрачная, бесцветная, подвижная, тяжелая, негорючая жидкость. Мало растворимая в воде, смешивается с безводным этанолом и трихлорэтиленом. Применяется как наркозное ингаляционное, анальгезирующее, миорелаксирующее средство. |
Хлорэтил / Aethylii chloridum
этил хлорид
С2Н5Cl Mr 64,5
Содержание действующего вещества должно составлять не менее 99,5% и не более 100,5%.
Определение подлинности
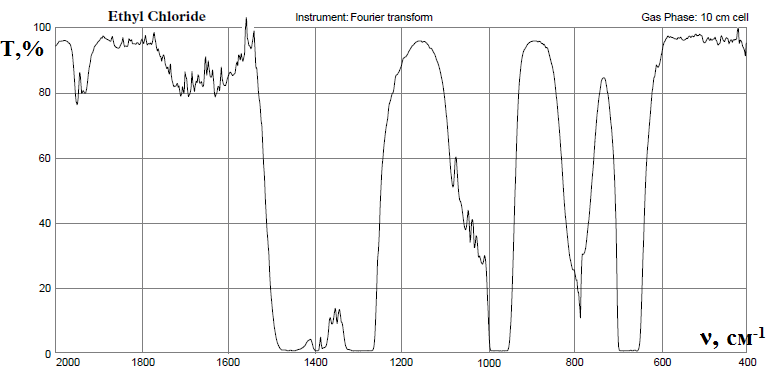
Инфракрасный спектр хлорэтила, снятый в области 2000-400см-1, по положению и интенсивности полос пропускания должен соответствовать спектру стандартного образца:
В колбу с обратным холодильником помещают 5 мл 0,5 моль/л раствора KOH, 2-3 мл испытуемого р-ра, опускают колбу в кипящую водяную баню и кипятят в течение 10 минут: хлор, связанный ковалентной связью с органической молекулой, переходит в ионное состояние. После охлаждения прибавляют 5 мл воды. Раствор даёт характерную реакцию на хлориды.
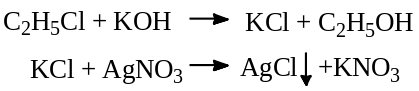
Оценка чистоты
Для определения кислотности/щелочности 10 мл хлорэтила встряхивают с 10 мл ледяной воды, и оставляют до полного испарения этилхлорида. Оставшаяся жидкость (раствор А) должна иметь нейтральный рН.
Плотность хлорэтила, измеренная ареометром при 00С, должна составлять 0,921-0,926 г/см3.
Температура кипения – Ткип. = 12,0-12,50С.
Недопустимыми примесями являются: этанол, хлорид ионы, органические примеси.
Определение примеси этанола: 5 мл раствора А нагревают с 10 мл 1 моль/л раствором NaOH и 10 мл 0,1 моль/л раствором йода: жёлтый осадок йодоформа не должен образовываться.
![]()
Определение хлорид ионов: к 5 мл раствора А добавряют раствор AgNO3 – не должно наблюдаться опалесценции.
Органические примеси: при испарении этилхлорида не должно быть никаких посторонних запахов.
Количественное определение
В колбу с притертой пробкой, содержащую 25,0 мл 1 моль/л спиртового раствора КОН, помещают 1,5 мл охлажденного хлорэтила, быстро закрывают пробкой, и взвешивают. Пробку плотно закрепляют, и помещают колбу в водяную баню при комнатной температуре. Далее водяную баню нагревают до кипения и кипятят в течение 30 минут, и снова охлаждают до комнатной температуры. Колбу вынимают, открывают, добавляют фенолфталеин и оттитровывают избыток щелочи 1 моль/л раствором HCl.
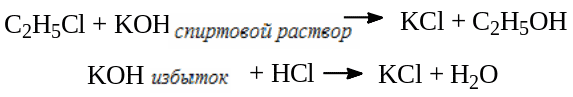
1 мл 1 моль/л спиртового раствора KOH эквивалентен 64,51 мг С2Н5Cl.
Галотан / Halothanum
(RS)-2-бромо-2-хлоро-1,1,1-трифтороэтан
С2НBrClF3 Mr 197,4
Галотан под действием света медленно разлагается, поэтому для стабилизации добавляют тимол (0,01 %).
Определение подлинности
1.Температура кипения – Ткип. = 49,0-51,00С.
2.Плотность фторотана больше, чем плотность серной кислоты, поэтому после добавления 5 мл фторотана к 5 мл концентрированной серной кислоте, препарат должен находиться в нижнем слое.
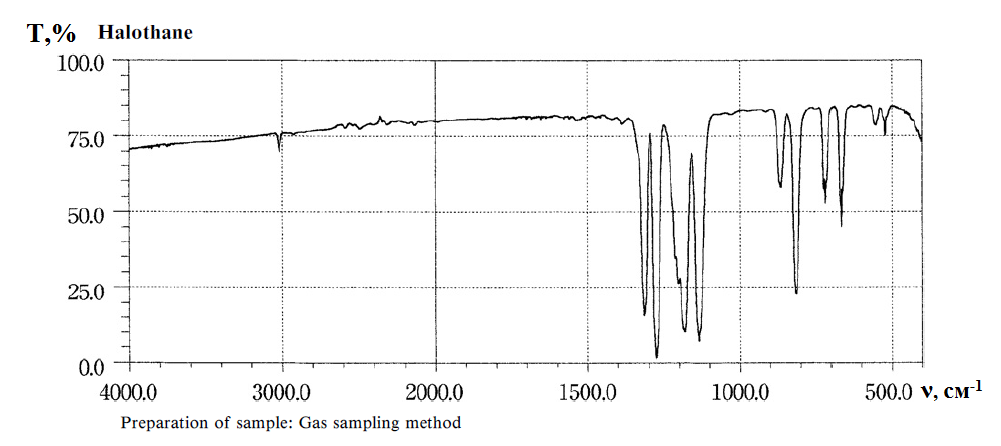
Инфракрасный спектр галотана, снятый в области 4000-500см-1, по положению и интенсивности полос пропускания должен соответствовать спектру стандартного образца:
3.Определение ковалентно связанных атомов галогенов проводят после минерализации: к 0,1 мл галотана добавляют к 2 мл 2-метил-2-пропанола, 1 мл раствора меди эдетеата, 0,5 мл концентрированного аммиака и 0,4 мл смеси, состоящей из 30% раствора H2O2 и 1,6 мл воды (раствор А).
Определение фторид-ионов: раствор А нагревают на водяной бане при температуре 500С в течение 15 минут, охлаждают, добавляют 0,3 мл ледяной уксусной кислоты. К 1 мл полученного раствора добавляют 0,5 мл смеси, состоящей из свежеприготовленного раствора ализарина и циркония нитрата, раствор становится желтым.
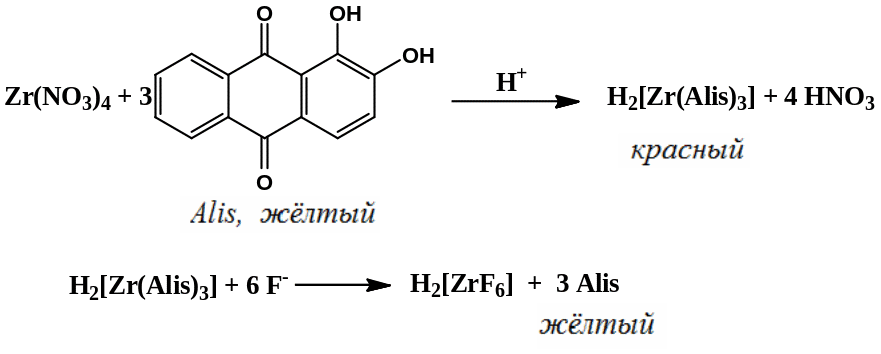
Определение бромид-ионов: к 1 мл раствора А добавляют 1 мл буферного раствора рН 5,2, 1 мл фенолового красного, 9 мл воды и 0,1 мл раствора хлорамина Б, раствор становится сине-фиолетового цвета.
Определение хлорид-ионов: к 2 мл раствора А добавляют 0,5 мл смеси, состоящей из H2SO4 и воды в соотношении 25:75, 0,5 мл ацетона и 0,2 мл 50 г/л раствора KBrO3, и взбалтывают. Далее нагревают на водяной бане при 500С в течение 2 минут и охлаждают. Бромат калия в кислой среде является сильным окислителем, он окисляет бромид ионы, и они в дальнейшем не препятствуют открытию хлорид ионов:
![]()
К раствору добавляют 0,5 мл смеси, состоящей HNO3 и воды в соотношении 1:1, и 0,5 мл раствора AgNO3, выпадает белый осадок.
![]()
Фторид ионы не препятствуют обнаружению хлорид ионов, так как AgF растворим в воде.
Оценка чистоты
Кислотность/щелочность определяют индикаторным методом: к 20 мл галотана добавляют 20 мл воды, взбалтывают в течение 3-х минут. Далее отделяют водный слой и добавляют 0,2 мл раствора бромкрезолового пурпурного. Не более 0,1 мл 0,01 моль/л раствора NaOH или 0,6 мл 0,01 моль/л раствора HCl требуется для изменения цвета индикатора.
Плотность галотана должна составлять 1,872-1,877 г/см3.
Температура кипения – Ткип. = 49,0-51,00С.
Методом газовой хроматографии контролируют содержание летучих родственных примесей (не более 0,005%), содержание стабилизатора – тимола должно быть в пределах от 0,008% до 0,012%.
Недопустимыми примесями являются бромиды, хлориды и свободный бром, хлор.
Для определения примеси хлоридов и бромидов к 10 мл галотана добавляют 20 мл воды и взбалтывают в течение 3 минут. К 5 мл водного слоя добавляют 5 мл воды, 0,05 HNO3 и 0,2 мл раствора AgNO3 – не должно наблюдаться опалесценции.
Для определения примеси свободного хлора и брома к 10 мл водного извлечения (см. выше) добавляют 1 мл раствора KI и раствор крахмала – не должно быть синего окрашивания.
![]()
50 мл галотана выпаривают досуха на водяной бане, остаток сушат в печи при температуре 100-1050С в течение 2 часов. Остаток должен весить не более 1 мг.
Количественное определение не предусмотрено НД.