
- •Часть I
- •Часть I
- •Оглавление
- •Введение
- •Лабораторно-практическое занятие № 1 Введение в фармацевтическую химию. Понятие о нормативной документации в фармации.
- •Знакомство с правилами безопасной работы в химической лаборатории.
- •Вопросы для обсуждения на семинаре.
- •3. Лабораторная работа Сравнительный анализ фс фармакопей различных стран
- •Лабораторно-практическое занятие № 2 Общие реакции подлинности лекарственных средств различных химических классов
- •1. Вопросы для обсуждения на семинаре.
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Общие фармакопейные реакции подлинности
- •Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
- •Оценка чистоты лекарственных средств: определение допустимых и недопустимых примесей
- •Лабораторно-практическое занятие № 4 Оценка качества лекарственных средств по показателю «чистота». Часть 2.
- •1. Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи
- •3. Лабораторная работа – 45 мин Оценка качества лекарственных средств по показателю «чистота»
- •Растворимость левомицетина
- •4. Защита лабораторной работы – 30 мин
- •Лабораторно-практическое занятие № 5 Оценка качества лекарственных средств по показателю «количественное определение»
- •Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Количественное определение действующего вещества в лекарственной субстанции титриметрическим методом
- •Лабораторно-практическое занятие № 6 Контрольная работа №1 «Общие вопросы фармацевтической химии»
- •Защита контрольной работы – 90 мин.
- •Лабораторно-практическая работа № 7 Фармацевтический анализ лекарственных средств p-элементов VII группы периодической системы элементов
- •Препараты галогенов
- •Абсорбционный комплекс синего цвета
- •Препараты галогенидов
- •1. Реакции на натрий.
- •Светло-желтый
- •2. Реакции на калий
- •Светло-желтый
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов VII группы псэ
- •Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
- •VI группы периодической системы элементов
- •Тиосульфат натрия/Natrii thiosulfas
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств р-элементов VI группы
- •Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементами V группы периодической системы элементов
- •Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
- •(Бура/ Borax)
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов III-IV групп
- •Лабораторно-практическое занятие № 11 Контрольная работа № 2 Фармацевтический анализ лекарственных средств p-элементов VII, VI, V, IV, III групп периодической системы элементов
- •1. Контрольный тест - 45 мин
- •2. Подготовка ответа на вопросы билета – 45 мин
- •Решите задачи:
- •3. Защита контрольных работ – 90 мин.
- •Лабораторно - практическое занятие №12 Фармацевтический анализ лекарственных средств s-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе магния
- •Лекарственные средства на основе кальция
- •Лекарственные средства на основе бария
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс s-элементов I-II групп псэ
- •Лабораторно-практическое занятие № 13 Фармацевтический анализ лекарственных средств d-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе серебра
- •Коллоидные препараты серебра
- •Лекарственные средства на основе цинка
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d- элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе железа
- •Лекарственные средства на основе платины
- •Радиофармацевтические препараты
- •Гомеопатические лекарственные средства
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d-элементов VIII группы псэ
- •Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Лекарственные средства – галогенопроизводные ациклических алканов
- •Лекарственные средства на основе спиртов
- •Лекарственные средства на основе эфиров
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств на основе спиртов
- •Лабораторно-практическое занятие № 17 Фармацевтический анализ лекарственных средств альдегидов и углеводов
- •Лекарственные средства альдегидов
- •Лекарственные средства на основе углеводов
- •1. Семинар - 90 мин
- •2.Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс альдегидов и углеводов
- •Лабораторно-практическое занятие № 18 Итоговое занятие
- •Приложение 1 Правила безопасной работы в лаборатории
- •Частные фармакопейные статьи к лабораторно-практическому занятию№1
- •Приложение 2 Общие фармакопейные статьи (Государственная фармакопея XI) определение температуры плавления
- •Определение температурных пределов перегонки
- •Определение плотности
- •Растворимость
- •Определение показателя преломления (рефрактометрия)
- •Определение оптического вращения (поляриметрия)
- •Определения, основанные на измерении поглощения электромагнитного излучения
- •Спектрофотометрия
- •Спектрофотометрия в ультрафиолетовой и видимой областях
- •Определение степени белизны порошкообразных лекарственных средств
- •Определение рН
- •Определение окраски жидкостей
- •Определение прозрачности и степени мутности жидкостей
- •Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
- •В лекарственных препаратах
- •Приложение 4 Частные фармакопейные статьи для лс р-элементов VII группы псэ (ер, перевод с английского)
- •Калия бромид (Kalii Bromidum)
- •Калия йодид (Kalii iodidum)
- •Натрия бромид ( Natrii Bromidum)
- •Натрия йодид ( Natrii iodidum)
- •Натрия фторид (Natrii fluoridum)
- •Натрия хлорид (Natrii chloridum)
- •Вода очищенная в резервуарах
- •Вода для инъекций (Aqua pro injectionibus)
- •Стерильная вода для инъекций
- •Раствор водорода пероксида (3%) (Solutio Hydrogenii peroxydi 3%)
- •Магния пероксид (Magnesii peroxydum)
- •Натрия тиосульфат (Natrii thiosulfas)
- •Натрия тетраборат (Natrii tetraboras) (Бура Borax)
- •Алюминия гидроксид (Aluminii hydroxidum)
- •Алюминия фосфат (Aluminii рhosphaS)
- •Натрия гидрокарбонат (Natrii hydrocarbonas)
- •Лития карбонат (Lithii carbonas)
- •Кальция хлорид (Сalcii chloridum)
- •Бария сульфат для рентгеноскопии (barii sulfas pro roentgeno)
- •Магния сульфат (Magnesii sulfas)
- •Магния оксид (Magnesii oxidum)
- •Серебра нитрат (Argenti nitras)
- •Цинка оксид (Zinci oxydum)
- •Цинка сульфат (Zinci sulfas)
- •Железа глюконат
- •Железа фумарат
- •Цисплатин (Cisplatinum)
- •Йодированный [I 125] альбумин для инъекций, меченный.
- •Натрия йодида [i131] раствор
- •Приложение 12 Частные фармакопейные статьи для лс галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Приложение 13 Частные фармакопейные статьи для лс альдегидов и углеводов
Лекарственные средства на основе железа
В организме человека 70% железа сосредоточено в эритроцитах. В составе гемоглобина, железо участвует в переносе кислорода от легких ко всем органам и тканям. Дефицит железа в организме приводит к развитию железодефицитной анемии.
Железа (II) сульфат гептагидрат / Ferrosi sulfas heptahydricus
FeSO4∙7H2O Mr 278,0
Содержание действующего вещества в субстанции должно составлять не менее 98,0% и не более 105,0%.
Определение подлинности проводят по реакциям на ион железа (II) и сульфат ион.
Навеску субстанции массой около 0,05 г растворяют в 1 мл воды и добавляют 1 мл раствора калия феррицианида, образуется осадок синего цвета (турнбулева синь), который не растворяется в разведенной HCl.
![]()
При добавлении к раствору субстанции раствора сульфида аммония образуется черный осадок, растворимый в минеральных кислотах.

При добавлении к раствору субстанции 1 моль/л раствора NH3 образуется светло-зелёный осадок Fe(OH)2, который на воздухе меняет цвет сначала на зеленый, а затем на коричневый.
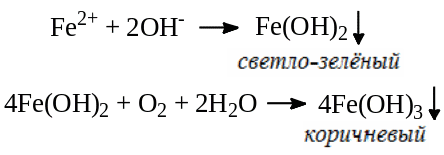
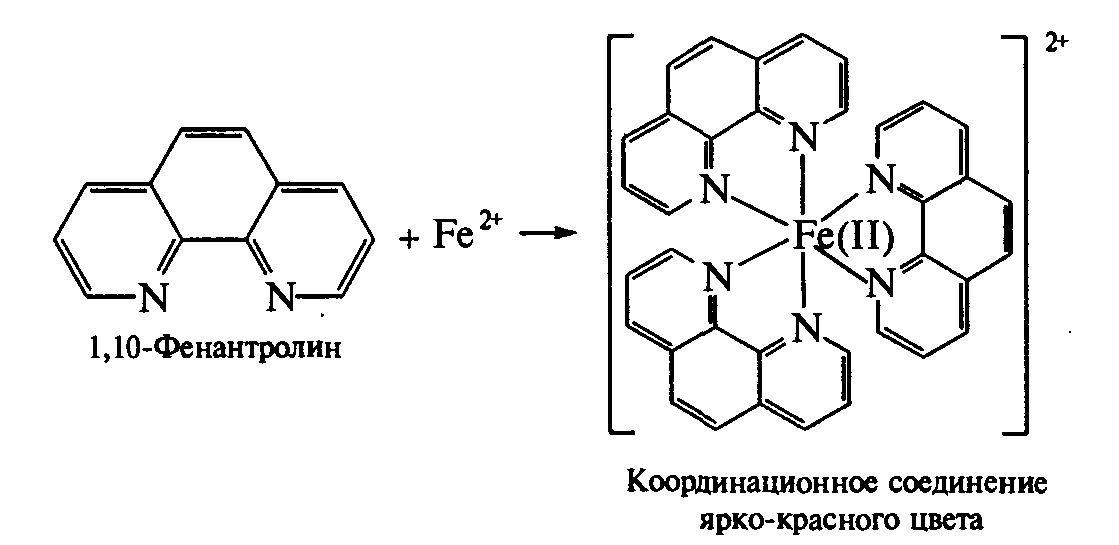
При добавлении к нейтральному или слабо подкисленному раствору субстанции спиртового раствора 1,10-фенантролина (1:50) появляется интенсивное красное окрашивание.
Сульфат-ион обнаруживают по реакции с раствором хлорида бария:
![]()
Оценка чистоты
2,5 г субстанции растворяют в воде, добавляют 0,5 мл разведенной H2SO4 и доводят объём водой до 50 мл. Опалесценция полученного раствора не должна быть интенсивнее опалесценции эталонного раствора, указанного в ФС.
рН 5% водного раствора субстанции должен быть в пределах от 3,0 до 4,0.
Допустимыми примесями являются: хлориды (не более 300 ppm), ионы Fe3+ (не более 0,5%), марганец (не более 0,1%), цинк (не более 500 ppm), тяжелые металлы (не более 50 ppm).
Для обнаружения примесей ионов Fe3+ навеску субстанции массой 5,00 г растворяют в смеси, состоящей из 10 мл разведенной HCl и 100 мл воды, в колбе из темного стекла с притертой пробкой. Добавляют 3 г KI, закрывают пробкой и оставляют на 5 минут в темном месте.
![]()
Выделившийся йод титруют 0,1 моль/л раствором Na2S2O3, используя в качестве индикатора раствор крахмала. На титрование должно пойти не более 4,5 мл титранта.
![]()
Количественное определение проводят методами цериметрии и премангонатометрии.
Растворяют 2,5 г NaHCO3 в смеси, состоящей из 150 мл воды и 10 мл разведённой H2SO4. После прекращения выделения пузырьков газа к раствору добавляют 0,500 г исследуемой субстанции и растворяют при осторожном перемешивании. Добавляют 0,1 мл раствора ферроина (индикатор) и титруют 0,1 моль/л раствором аммония церия нитратом ((NH4)2[Ce(NO3)6]), до исчезновения красного окрашивания.
При титровании происходит окисление ионов Fe2+ до Fe3+, и в точке эквивалентности разрушается комплекс Fe2+ с индикатором (реакцию см. выше).
![]()
1 мл 0,1 моль/л раствора (NH4)2[Ce(NO3)6] эквивалентен 27,80 мг FeSO4∙7H2O.
Точную навеску FeSO4∙7H2O массой около 0,7 г растворяют в смеси, состоящей из 20 мл воды и 20 мл разведённой H2SO4. Добавляют 2 мл раствора фосфорной кислоты и немедленно титруют 0,05 моль/л раствором KMnO4 до появления устойчивого розового окрашивания.
![]()
1 мл 0,05 моль/л раствора KMnO4 эквивалентен 27,80 мг FeSO4∙7H2O.
Железа фумарат / Ferrosi fumaras
железа (II) бутендиоат
С4Н2 FeO4 Mr 169,9
Содержание действующего вещества в субстанции должно составлять не менее 93,0% и не более 101,0%.
Определение подлинности проводят физико-химическими и химическими методами.
К 1,0 г субстанции добавляют 25 мл смеси, состоящей из равных объёмов соляной кислоты и воды, нагревают на водяной бане в течение 15 минут. Охлаждают и фильтруют. Фильтрат дает характерные реакции на ион железа (II).
Подлинность железа фумарата также устанавливают методом ТСХ, используя пластины с селикагелем. Для приготовления испытуемого раствора к 1,0 г субстанции добавляют 25 мл смеси, состоящей из равных объёмов соляной кислоты и воды, нагревают на водяной бане в течение 15 минут. Охлаждают и фильтруют. Остаток на фильтре промывают 50 мл смеси, состоящей из разведенной HCl и воды (1:9). Далее остаток высушивают при 100-1050С. 20 мг осадка растворяют в ацетоне и доводят объём тем же растворителем до 10 мл. Для приготовления раствора сравнения 20 мг фумаровой кислоты растворяют в 10 мл ацетона. Подвижная фаза – смесь состоящая из безводной муравьиной кислоты, метиленхлорида, бутанола и гептана в соотношении 12:16:32:44. Пластинки высушивают при 1050С в течение 15 минут, и детектируют пятна при 254нм. Пятно на хроматограмме, соответствующее определяемому веществу, по положению, интенсивности окраски и размеру должно быть идентично пятну стандартного образца фумаровой кислоты.
Смешивают 0,5 г субстанции с 1 г резорцина. К 0,5 г полученной смеси в тигле добавляют 0,15 мл H2SO4 и осторожно нагревают. Образуется темно красная полутвердая масса, которую добавляют к 100 мл воды. Появляется оранжево-желтое окрашивание, полученный раствор не флюоресцирует.
Оценка чистоты
Допустимыми примесями являются сульфаты (не более 0,2%), мышьяк (не более 5 ppm), ионы Fe3+ (не более 2,0%). Методом атомно-абсорбционной спектроскопии контролируют содержание кадмия (не более 10,0 ppm), хрома (не более 2,00˟102 ppm), свинца (не более 20,0 ppm), ртути (не более 1,0 ppm), никеля (не более 2,00˟102 ppm), цинка (не более 5,00˟102 ppm).
Потеря в массе при высушивании не должна быть более 1,0% в расчете на навеску 1,000г, высушенную при 1050С.
Количественное определение проводят методом цериметрии.
Растворяют при слабом нагревании 0,150 г субстанции в 7,5 мл разведенной H2SO4. Охлаждают, добавляют 25 мл воды и 0,1 мл ферроина. Немедленно тируют 0,1 моль/л раствором церия сульфата. В точке эквивалентности происходит изменение окраски с оранжевой на сине-зелёную.
1 мл 0,1 моль/л раствора Се(SО4)2 эквивалентен 16,99 мг С4Н2 FeO4.
Железа глюконат / Ferrosi gluconas
железа (II) ди(D-глюконат)
С12Н22 FeO14∙хН2О Mr 446,1 (безводная субстанция)
Содержит от 11,8% до 12,5% ионов Fe2+ (высушенная субстанция). Содержит различное количество воды.
Определение подлинности проводят физико-химическими и химическими методами.
Растворяют 5,0 г субстанции в воде при нагревании при 600С, охлаждают и доводят объём раствора до 50 мл водой. Полученный раствор даёт характерные реакции на ион Fe2+.
Подлинность железа глюконата устанавливают методом ТСХ, используя пластины с селикагелем. Испытуемый раствор и раствор сравнения готовят, растворяя 20 мг субстанции в 2 мл воды (если необходимо при нагревании на водяной бане). Подвижная фаза – смесь из концентрированного раствора аммиака, этилацетата, воды и этанола (96%) в соотношении 10:10:30:50. Для обнаружения пятен пластинку опрыскивают 50 г/л раствором калия дихромата в 40% растворе серной кислоты: пятно на хроматограмме, соответствующее определяемому веществу должно быть идентично по положению, интенсивности окраски и размеру пятну стандартного образца железа глюконата.
Оценка чистоты
Растворяют 5,0 г субстанции в воде при нагревании при 600С, охлаждают и доводят объём раствора до 50 мл водой. Полученный раствор должен быть прозрачным, его рН, измеренный через 3-4 часа после приготовления, должен быть в пределах от 4,0 до 5,5.
Допустимыми примесями являются хлориды (не более 0,06%), сульфаты (не более 500 ppm), мышьяк (не более 2 ppm), ионы Fe3+ (не более 1,0%), тяжёлые металлы (не более 20 ppm).
Недопустимыми примесями являются: сахароза и другие восстанавливающие сахара, оксалаты и барий.
Определение сахарозы и других восстанавливающих сахаров: 0,5 г субстанции растворяют в 10 мл теплой воды и добавляют 1 мл раствора аммиака. Через этот раствор пропускают H2S и отставляют на 30 минут.
Далее фильтруют, осадок промывают двумя порциями каждая по 5 мл воды. Смывы с осадка совмещают с фильтратом, подкисляют раствором HCl до кислой реакции среды. Полученный раствор кипятят до тех пор, пока от паров перестанет чернеть бумага, смоченная ацетатом свинца, при необходимости продолжают кипятить пока объём раствора не уменьшится приблизительно до 10 мл. Охлаждают, добавляют 15 мл раствора Na2CO3, и оставляют на 5 минут, после чего фильтруют. Доводят объём фильтрата водой до 100мл. К 5 мл этого раствора добавляют 2 мл реактива Фелинга и кипятят в течение 1 минуты. Оставляют стоять на 1 минуту. Не должно появиться красного осадка.
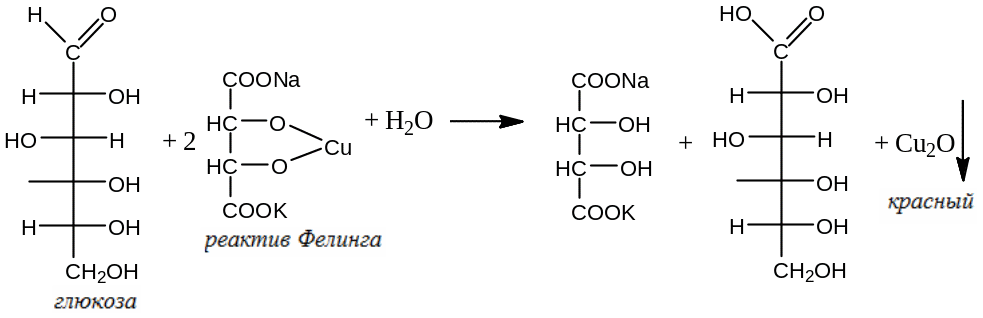
Определение оксалатов: растворяют 5,0 г субстанции в смеси, состоящей из 10 мл разведенной H2SO4 и 40 мл воды. Добавляют 50 мл эфира и встряхивают в течение 5 минут. Отделяют водный слой, добавляют к нему 20 мл эфира и снова встряхивают 5 минут. Объединяют эфирные слои и выпаривают досуха. Оставшийся остаток растворяют в 15 мл воды. Фильтруют, фильтрат выпаривают до тех пор, пока объём не уменьшится до 5 мл, добавляют 1 мл разведенной уксусной кислоты и 1,5 CaCl2. Оставляют стоять на 30 минут. Не должно образоваться осадка.
![]()
Определение Ba2+: растворяют 5,0 г субстанции в воде при нагревании при 600С, охлаждают и доводят объём раствора до 50 мл водой (раствор А). 10 мл этого раствора разводят водой до 50 мл, добавляют 5 мл разведенной H2SO4. Оставляют стоять на 5 минут. Опалесценция в растворе не должна быть интенсивнее опалесценции раствора, состоящего из 10 мл раствора А и 45 мл воды.
Потеря в массе при высушивании должна быть от 5,0% до 10,5% в расчете на навеску 0,500 г , высушенную при 1050С в течение 5 часов.
Микробиологическая чистота: общее количество аэробных микроорганизмов должно быть не более 103 на грамм субстанции при определении на твердой питательной среде.
Количественное определение проводят методом цериметрии.
Растворяют 0,5 г NaHCO3 в смеси, состоящей из 70 мл воды и 30 мл разведённой H2SO4. После прекращения выделения пузырьков газа к раствору добавляют 1,00 г исследуемой субстанции и растворяют при осторожном перемешивании. Добавляют 0,1 мл раствора ферроина (индикатор) и титруют 0,1 моль/л раствором аммония церия нитратом ((NH4)2[Ce(NO3)6]), до исчезновения красного окрашивания.
1 мл 0,1 моль/л раствора (NH4)2[Ce(NO3)6] эквивалентен 5,585 мг Fe2+.
