
- •Часть I
- •Часть I
- •Оглавление
- •Введение
- •Лабораторно-практическое занятие № 1 Введение в фармацевтическую химию. Понятие о нормативной документации в фармации.
- •Знакомство с правилами безопасной работы в химической лаборатории.
- •Вопросы для обсуждения на семинаре.
- •3. Лабораторная работа Сравнительный анализ фс фармакопей различных стран
- •Лабораторно-практическое занятие № 2 Общие реакции подлинности лекарственных средств различных химических классов
- •1. Вопросы для обсуждения на семинаре.
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Общие фармакопейные реакции подлинности
- •Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
- •Оценка чистоты лекарственных средств: определение допустимых и недопустимых примесей
- •Лабораторно-практическое занятие № 4 Оценка качества лекарственных средств по показателю «чистота». Часть 2.
- •1. Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи
- •3. Лабораторная работа – 45 мин Оценка качества лекарственных средств по показателю «чистота»
- •Растворимость левомицетина
- •4. Защита лабораторной работы – 30 мин
- •Лабораторно-практическое занятие № 5 Оценка качества лекарственных средств по показателю «количественное определение»
- •Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Количественное определение действующего вещества в лекарственной субстанции титриметрическим методом
- •Лабораторно-практическое занятие № 6 Контрольная работа №1 «Общие вопросы фармацевтической химии»
- •Защита контрольной работы – 90 мин.
- •Лабораторно-практическая работа № 7 Фармацевтический анализ лекарственных средств p-элементов VII группы периодической системы элементов
- •Препараты галогенов
- •Абсорбционный комплекс синего цвета
- •Препараты галогенидов
- •1. Реакции на натрий.
- •Светло-желтый
- •2. Реакции на калий
- •Светло-желтый
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов VII группы псэ
- •Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
- •VI группы периодической системы элементов
- •Тиосульфат натрия/Natrii thiosulfas
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств р-элементов VI группы
- •Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементами V группы периодической системы элементов
- •Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
- •(Бура/ Borax)
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов III-IV групп
- •Лабораторно-практическое занятие № 11 Контрольная работа № 2 Фармацевтический анализ лекарственных средств p-элементов VII, VI, V, IV, III групп периодической системы элементов
- •1. Контрольный тест - 45 мин
- •2. Подготовка ответа на вопросы билета – 45 мин
- •Решите задачи:
- •3. Защита контрольных работ – 90 мин.
- •Лабораторно - практическое занятие №12 Фармацевтический анализ лекарственных средств s-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе магния
- •Лекарственные средства на основе кальция
- •Лекарственные средства на основе бария
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс s-элементов I-II групп псэ
- •Лабораторно-практическое занятие № 13 Фармацевтический анализ лекарственных средств d-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе серебра
- •Коллоидные препараты серебра
- •Лекарственные средства на основе цинка
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d- элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе железа
- •Лекарственные средства на основе платины
- •Радиофармацевтические препараты
- •Гомеопатические лекарственные средства
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d-элементов VIII группы псэ
- •Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Лекарственные средства – галогенопроизводные ациклических алканов
- •Лекарственные средства на основе спиртов
- •Лекарственные средства на основе эфиров
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств на основе спиртов
- •Лабораторно-практическое занятие № 17 Фармацевтический анализ лекарственных средств альдегидов и углеводов
- •Лекарственные средства альдегидов
- •Лекарственные средства на основе углеводов
- •1. Семинар - 90 мин
- •2.Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс альдегидов и углеводов
- •Лабораторно-практическое занятие № 18 Итоговое занятие
- •Приложение 1 Правила безопасной работы в лаборатории
- •Частные фармакопейные статьи к лабораторно-практическому занятию№1
- •Приложение 2 Общие фармакопейные статьи (Государственная фармакопея XI) определение температуры плавления
- •Определение температурных пределов перегонки
- •Определение плотности
- •Растворимость
- •Определение показателя преломления (рефрактометрия)
- •Определение оптического вращения (поляриметрия)
- •Определения, основанные на измерении поглощения электромагнитного излучения
- •Спектрофотометрия
- •Спектрофотометрия в ультрафиолетовой и видимой областях
- •Определение степени белизны порошкообразных лекарственных средств
- •Определение рН
- •Определение окраски жидкостей
- •Определение прозрачности и степени мутности жидкостей
- •Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
- •В лекарственных препаратах
- •Приложение 4 Частные фармакопейные статьи для лс р-элементов VII группы псэ (ер, перевод с английского)
- •Калия бромид (Kalii Bromidum)
- •Калия йодид (Kalii iodidum)
- •Натрия бромид ( Natrii Bromidum)
- •Натрия йодид ( Natrii iodidum)
- •Натрия фторид (Natrii fluoridum)
- •Натрия хлорид (Natrii chloridum)
- •Вода очищенная в резервуарах
- •Вода для инъекций (Aqua pro injectionibus)
- •Стерильная вода для инъекций
- •Раствор водорода пероксида (3%) (Solutio Hydrogenii peroxydi 3%)
- •Магния пероксид (Magnesii peroxydum)
- •Натрия тиосульфат (Natrii thiosulfas)
- •Натрия тетраборат (Natrii tetraboras) (Бура Borax)
- •Алюминия гидроксид (Aluminii hydroxidum)
- •Алюминия фосфат (Aluminii рhosphaS)
- •Натрия гидрокарбонат (Natrii hydrocarbonas)
- •Лития карбонат (Lithii carbonas)
- •Кальция хлорид (Сalcii chloridum)
- •Бария сульфат для рентгеноскопии (barii sulfas pro roentgeno)
- •Магния сульфат (Magnesii sulfas)
- •Магния оксид (Magnesii oxidum)
- •Серебра нитрат (Argenti nitras)
- •Цинка оксид (Zinci oxydum)
- •Цинка сульфат (Zinci sulfas)
- •Железа глюконат
- •Железа фумарат
- •Цисплатин (Cisplatinum)
- •Йодированный [I 125] альбумин для инъекций, меченный.
- •Натрия йодида [i131] раствор
- •Приложение 12 Частные фармакопейные статьи для лс галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Приложение 13 Частные фармакопейные статьи для лс альдегидов и углеводов
Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
Перечень лекарственных веществ p-элементов III-IV групп ПСЭ в соответствие с учебной программой:
Борная кислота / Boric acid
Натрия тетраборат /Sodium tetraborate
Алюминия гидроксид /Aluminium hydroxide
Алюминия фосфат /Aluminium phosphate
Натрия гидрокарбонат /Sodium hydrocarbonate
Лития карбонат /Lithium carbonate
К р-элементам III группы относятся бор, алюминий, галлий, индий, таллий. Атомы этих элементов на внешнем электронном слое содержат три валентных электрона, что обусловливает степень окисления в соединениях, равную +3. С ростом порядкового номера внутри подгруппы металлические свойства элементов усиливаются. Бор имеет ярко выраженный неметаллический характер. Алюминий, галлий, индий – металлы с амфотерными свойствами. У таллия ярко твыражены металлические свойства.
Бор относится к эссенциальным микроэлементам. Участвует в углеводном, жировом обменах, в окислительно-восстановительных процессах организма, а также в кальциевом обмене. Алюминий влияет на ферментативные процессы. Предполагают, что он замещает ионы магния и кальция в активных центрах, так как ионные радиусы и энергии ионизации атомов этих элементов близки. Соединения галлия и индия применяются в качестве радиофармацевтических препаратов. В настоящее время соединения таллия не применяются в фармации из-за чрезвычайно высокой токсичности. Преобладающей формой таллия в жидких биосредах является ион Tl+. Одинаковый ионный заряд и близость размеров ионов Tl+ r=137 пм) и K+ r=148 пм) обусловливают их конкуренцию в биохимических процессах. Переходу Tl+ в эритроциты и распределению по органам и тканям способствует прочное связывание с тиоловыми группами (-SH), фосфатами и галогенидами, присутствующими в жидких биосредах.
Таблица 10-1. Лекарственные средства ЛС p-элементов III-IV групп ПСЭ.
Лекарственное вещество Структурная формула |
Описание Фармакологическая группа, применение |
Борная кислота Boric acid
H3BO3
|
Бесцветные, блестящие, слегка жирные на ощупь чешуйки или мелкий белый кристаллический порошок. Растворим в воде и спирте, легко растворим в кипящей. Применяется как антибактериальное, вяжущее, противопаразитарное, противопедикулезное, противогрибковое, фунгистатическое средство. Коагулирует белки микробной клетки, нарушает проницаемость их клеточной оболочки. Абсорбируется через поврежденную кожу, раневую поверхность, слизистые оболочки. Используется наружно при лечении конъюнктивита (2% водный раствор), мокнущей экземы, дерматита (примочки с 3% раствором), отита (спиртовые растворы 0,5% - 3%), педикулеза (5% борную мазь). |
Натрия тетраборат Sodium tetraborate
Na2B4O7,10H2O
|
Белый или почти белый кристаллический порошок или бесцветные флуоресцирующие кристаллы. Растворим в воде, очень легко растворим в кипящей воде, легко растворим в глицерине, не растворим в спирте. Применяется как антисептическое и инсектицидное средство. Используется наружно при лечении опрелостей, пролежней, вагинального кандидоза, фарингита, тонзиллита. В пищевой промышленности разрешен для использования в качестве пищевой добавки, зарегистрированной как Е285. Обладает инсектицидными свойствами (по уровню токсичности относится к 4 классу). Основной областью применения является уничтожение тараканов. |
Алюминия гидроксид Aluminium hydroxide
Al(OH)3 |
Белый аморфный порошок. Практически не растворим в воде, способен образовывать гель. Растворим в разбавленных минеральных кислотах и растворах щелочей. Обладает антацидными, адсорбирующими и обволакивающими свойствами. Препарат нейтрализует хлороводородную (соляную) кислоту (1 г нейтрализует около 250 мл 0,1 н. раствора соляной кислоты) с образованием алюминия хлорида и воды; рН желудочного сока постепенно повышается до 3,5 4,5 и остается на этом уровне в течение нескольких часов. В щелочном содержимом кишечника алюминия хлорид образует нерастворимые соединения алюминия (фосфаты и др.). Применяется при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки, острых и хронических гастритах и при пищевых отравлениях. В настоящее время стали более широко применять другие препараты, содержащие алюминий, в том числе комбинированные лекарственные формы (Алмагель, Гастал и др.). Алюминия гидроокись иногда применяют в качестве вяжущего средства наружно при кожных заболеваниях. |
Алюминия фосфат Aluminium phosphate
AlPO4
|
Белый или почти белый порошок, возможно образование распадающихся агрегатов частиц. Растворим в разбавленных минеральных кислотах. Практически не растворим в воде, этаноле (96%), и в растворах гидроксидов щелочных металлов. Обладает антацидными, адсорбирующими и обволакивающими свойствами. В желудке в течение 10 мин повышает pH до 3,5–5 и снижает протеолитическую активность пепсина. Благодаря адсорбирующим свойствам, удаляет из ЖКТ бактерии, вирусы, газы, эндо- и экзотоксины. Применяется Алюминия фосфат при язвенной болезни желудка и двенадцатиперстной кишки, гастрите, диафрагмальной грыже, функциональной диареи. |
Натрия гидрокарбонат Sodium hydrocarbonate
NaHCO3
|
Белый кристаллический порошок без запаха. Устойчив в сухом воздухе, медленно разлагается во влажном. Легко растворим в воде с образованием щелочных растворов (pH 5% раствора 8,1), практически нерастворим в этаноле. Является регулятором водно-электролитного баланса. Фармакологическое действие - антацидное, муколитическое, отхаркивающее, восстанавливающее щелочное состояние крови. В желудке при приеме внутрь взаимодействует с соляной кислотой желудочного сока и вызывает ее нейтрализацию. Антацидный эффект развивается быстро, но является кратковременным. Образующийся в реакции нейтрализации углекислый газ обусловливает неприятные ощущения в желудке. Избыточное выделение двуокиси углерода при язвенной болезни желудка может провоцировать перфорацию его стенки. По этой причине при отравлении кислотами натрия гидрокарбонат для нейтрализации не используется. Сдвигает КЩС в сторону алкалоза, способствует выделению ионов натрия и хлора, усилению осмотического диуреза, ощелачивает мочу (предупреждает выпадение в осадок солей мочевой кислоты в мочевыводящей системе). Сдвигает в щелочную сторону реакцию бронхиальной слизи, способствует разжижению мокроты, улучшает ее отхаркивание. Облегчает симптомы морской и воздушной болезни. |
Лития карбонат Lithium carbonate
Li2CO3 |
Белый или почти белый порошок, мало растворим в воде, практически нерастворим в спирте. Фармакологическое действие - нормотимическое, антипсихотическое, седативное. Блокирует натриевые каналы в нейронах и мышечных клетках, вызывает сдвиг интранейронального метаболизма катехоламинов. Применяется при маниакальной фазе и профилактике обострений биполярного аффективного расстройства, шизоаффективных расстройствах, аффективных расстройствах при хроническом алкоголизме, лекарственной зависимости (некоторые формы), сексуальных отклонениях, мигрени. |
ЛС - производные р-элементов III группы ПСЭ
Борная кислота /Acidum boricum
H3BO3 Мr 61,8
Существует в виде нескольких лекарственных форм. 2-3% растворы, порошки, мази на основе борной кислоты. При передозировке вызывает жжение, покраснение кожных покровов и слизистых.
Борная кислота легко проникает и накапливается в органах и тканях млекопитающих, т.е. обладает кумулятивным действием. При остром отравлении она поражает мозг, слизистые оболочки и кожу, а при хроническом - кроветворные и половые клетки. Особенно опасна борная кислота для развивающихся эмбрионов.
При длительном нагревании более 100°С борная кислота теряет часть воды и переходит в метаборную кислоту, а затем в тетраборную кислоту, после стадии стекловидной массы превращается в борный ангидрид.
Н3ВО3НВО2Н2В4О7В2О3
Растворы борной кислоты имеют рН=3,8-4,8.
Определение подлинности.
А. Растворить 0,1 г вещества в кипящей воде и 5,0 мл метанола, прибавить 0,1 мл раствора серной кислоты и поджечь раствор. Край пламени должен иметь зеленую окраску.
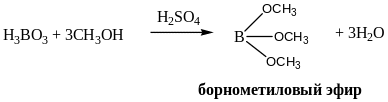
2В(ОСН3)3 + 12О2 = В2О3 + 6СО2 + 9Н2О
В. Согласно Ph.Eur., необходимо растворить 3,3 г борной кислоты в 80 мл кипящей воды, охладить и развести до 100 мл водой, свободной от углекислого газа. Раствор имеет кислую реакцию: рН = 3,8- 4,8. Эта процедура позволяет отличить борную кислоту от другого препарата бора – буры, раствор которой имеет щелочную реакцию.
Описан метод идентификации соединений бора с куркумином – желтым пигментом, получаемым из однодольных травянистых растений семейства Имбирных. С точки зрения строения куркумин является полифенолом, в растворах с различным значением рН меняет окраску. Обычно для качественных реакций применяется куркумовая бумага - фильтровальная бумага, пропитанная спиртовой настойкой куркумина.
И сследуемый
раствор борной кислоты наносят на
куркумовую бумагу, одновременно добавляя
несколько капель кислоты хлороводородной.
Образуется боратный комплекс куркумина
розового или темно-красного цвета:
сследуемый
раствор борной кислоты наносят на
куркумовую бумагу, одновременно добавляя
несколько капель кислоты хлороводородной.
Образуется боратный комплекс куркумина
розового или темно-красного цвета:
При действии растворов щелочей пятно становится фиолетовым или зеленовато-черным.
Оценка чистоты.
Раствор С. 3,3 г вещества растворить в 80 мл кипящей дистиллированной воды и довести объем раствора до 100 мл дистиллированной водой, свободной от диоксида углерода.
Прозрачность и цветность. Раствор С должен быть прозрачным и бесцветным.
рН 3,8-4,8.
Растворимость в спирте. 1,0 вещества растворить в 10 мл кипящего спирта. По опалесценции полученный раствор не превышает опалесценцию эталона мутности II.
Органические примеси. При нагревании ЛС не должна темнеть до грязно-красного окрашивания.
Сульфаты. 10 мл стандартного раствора разбавить до 15 мл дистиллированной водой и сравнить с эталоном на сульфаты. Содержание сульфат-иона не должно превышать 450 ррm.
Тяжелые металлы. С 12,0 мл раствора С выполнить тест А. Приготовить раствор сравнения, используя 2,5 мл эталонного раствора (2 ppm Pb) и 7,5 мл воды. Содержание тяжелых металлов не должно превышать 15 ррm.
Количественное определение.
Навеску вещества массой 1,000 г растворить при нагревании в 100,0 мл воды, содержащей 15,0 г маннитола.
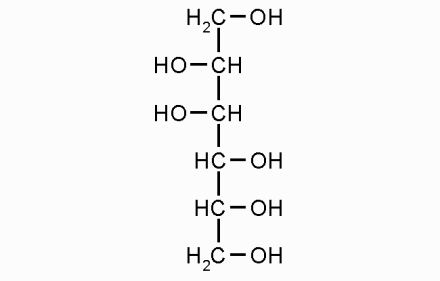
маннтол
Титровать 1моль/л раствором натрия гидроксида с 0,5 мл раствора фенолфталеина в качестве индикатора до тех пор пока раствор не окрасится в розовый цвет.
Д
 ля
усиления кислотных свойств борной
кислоты можно использовать глицерин
(ГФХ).
ля
усиления кислотных свойств борной
кислоты можно использовать глицерин
(ГФХ).
1,0 мл 1 моль/л раствора натрия гидроксида эквивалентен 61,8 кислоты борной.
Натрия тетраборат/Sodium tetraborate
