
- •Часть I
- •Часть I
- •Оглавление
- •Введение
- •Лабораторно-практическое занятие № 1 Введение в фармацевтическую химию. Понятие о нормативной документации в фармации.
- •Знакомство с правилами безопасной работы в химической лаборатории.
- •Вопросы для обсуждения на семинаре.
- •3. Лабораторная работа Сравнительный анализ фс фармакопей различных стран
- •Лабораторно-практическое занятие № 2 Общие реакции подлинности лекарственных средств различных химических классов
- •1. Вопросы для обсуждения на семинаре.
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Общие фармакопейные реакции подлинности
- •Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
- •Оценка чистоты лекарственных средств: определение допустимых и недопустимых примесей
- •Лабораторно-практическое занятие № 4 Оценка качества лекарственных средств по показателю «чистота». Часть 2.
- •1. Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи
- •3. Лабораторная работа – 45 мин Оценка качества лекарственных средств по показателю «чистота»
- •Растворимость левомицетина
- •4. Защита лабораторной работы – 30 мин
- •Лабораторно-практическое занятие № 5 Оценка качества лекарственных средств по показателю «количественное определение»
- •Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Количественное определение действующего вещества в лекарственной субстанции титриметрическим методом
- •Лабораторно-практическое занятие № 6 Контрольная работа №1 «Общие вопросы фармацевтической химии»
- •Защита контрольной работы – 90 мин.
- •Лабораторно-практическая работа № 7 Фармацевтический анализ лекарственных средств p-элементов VII группы периодической системы элементов
- •Препараты галогенов
- •Абсорбционный комплекс синего цвета
- •Препараты галогенидов
- •1. Реакции на натрий.
- •Светло-желтый
- •2. Реакции на калий
- •Светло-желтый
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов VII группы псэ
- •Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
- •VI группы периодической системы элементов
- •Тиосульфат натрия/Natrii thiosulfas
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств р-элементов VI группы
- •Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементами V группы периодической системы элементов
- •Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
- •(Бура/ Borax)
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов III-IV групп
- •Лабораторно-практическое занятие № 11 Контрольная работа № 2 Фармацевтический анализ лекарственных средств p-элементов VII, VI, V, IV, III групп периодической системы элементов
- •1. Контрольный тест - 45 мин
- •2. Подготовка ответа на вопросы билета – 45 мин
- •Решите задачи:
- •3. Защита контрольных работ – 90 мин.
- •Лабораторно - практическое занятие №12 Фармацевтический анализ лекарственных средств s-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе магния
- •Лекарственные средства на основе кальция
- •Лекарственные средства на основе бария
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс s-элементов I-II групп псэ
- •Лабораторно-практическое занятие № 13 Фармацевтический анализ лекарственных средств d-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе серебра
- •Коллоидные препараты серебра
- •Лекарственные средства на основе цинка
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d- элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе железа
- •Лекарственные средства на основе платины
- •Радиофармацевтические препараты
- •Гомеопатические лекарственные средства
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d-элементов VIII группы псэ
- •Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Лекарственные средства – галогенопроизводные ациклических алканов
- •Лекарственные средства на основе спиртов
- •Лекарственные средства на основе эфиров
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств на основе спиртов
- •Лабораторно-практическое занятие № 17 Фармацевтический анализ лекарственных средств альдегидов и углеводов
- •Лекарственные средства альдегидов
- •Лекарственные средства на основе углеводов
- •1. Семинар - 90 мин
- •2.Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс альдегидов и углеводов
- •Лабораторно-практическое занятие № 18 Итоговое занятие
- •Приложение 1 Правила безопасной работы в лаборатории
- •Частные фармакопейные статьи к лабораторно-практическому занятию№1
- •Приложение 2 Общие фармакопейные статьи (Государственная фармакопея XI) определение температуры плавления
- •Определение температурных пределов перегонки
- •Определение плотности
- •Растворимость
- •Определение показателя преломления (рефрактометрия)
- •Определение оптического вращения (поляриметрия)
- •Определения, основанные на измерении поглощения электромагнитного излучения
- •Спектрофотометрия
- •Спектрофотометрия в ультрафиолетовой и видимой областях
- •Определение степени белизны порошкообразных лекарственных средств
- •Определение рН
- •Определение окраски жидкостей
- •Определение прозрачности и степени мутности жидкостей
- •Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
- •В лекарственных препаратах
- •Приложение 4 Частные фармакопейные статьи для лс р-элементов VII группы псэ (ер, перевод с английского)
- •Калия бромид (Kalii Bromidum)
- •Калия йодид (Kalii iodidum)
- •Натрия бромид ( Natrii Bromidum)
- •Натрия йодид ( Natrii iodidum)
- •Натрия фторид (Natrii fluoridum)
- •Натрия хлорид (Natrii chloridum)
- •Вода очищенная в резервуарах
- •Вода для инъекций (Aqua pro injectionibus)
- •Стерильная вода для инъекций
- •Раствор водорода пероксида (3%) (Solutio Hydrogenii peroxydi 3%)
- •Магния пероксид (Magnesii peroxydum)
- •Натрия тиосульфат (Natrii thiosulfas)
- •Натрия тетраборат (Natrii tetraboras) (Бура Borax)
- •Алюминия гидроксид (Aluminii hydroxidum)
- •Алюминия фосфат (Aluminii рhosphaS)
- •Натрия гидрокарбонат (Natrii hydrocarbonas)
- •Лития карбонат (Lithii carbonas)
- •Кальция хлорид (Сalcii chloridum)
- •Бария сульфат для рентгеноскопии (barii sulfas pro roentgeno)
- •Магния сульфат (Magnesii sulfas)
- •Магния оксид (Magnesii oxidum)
- •Серебра нитрат (Argenti nitras)
- •Цинка оксид (Zinci oxydum)
- •Цинка сульфат (Zinci sulfas)
- •Железа глюконат
- •Железа фумарат
- •Цисплатин (Cisplatinum)
- •Йодированный [I 125] альбумин для инъекций, меченный.
- •Натрия йодида [i131] раствор
- •Приложение 12 Частные фармакопейные статьи для лс галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Приложение 13 Частные фармакопейные статьи для лс альдегидов и углеводов
Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
Перечень лекарственных веществ p-элементов V группы ПСЭ в соответствие с учебной программой:
Натрия нитрит /Natrii nitris NaNO2
Висмута нитрат основной /Bismuthi subnitras BiO(NO3) •Н2О)
К р-элементам V группы относятся азот, фосфор, мышьяк, сурьма, висмут. Эти элементы характеризуются меньшими значениями относительной электроотрицательности по сравнению с галогенами и халькогенами, поэтому их неметаллические свойства выражены слабее. Металлические свойства в группе увеличиваются от азота к висмуту. Висмут в лекарственных средствах присутствует в катионной форме (ион висмутила BiO+).
Фосфор играет важную роль в жизнедеятельности растительных и животных организмов: фосфор участвует в образовании костной ткани, входит в состав АТФ, ферментов и фосфолипидов. ЛС «Натрия фосфат» ([Natrii phosphas (Na2HPО4.12H2О)] может применяться как компонент фосфатных клизм, при подготовки нижних отделов ЖКТ к исследованиям, операциям и т.д. В настоящее время в медицине используются различные фосфатные соли (железа фосфат, алюминия фосфат, дексаметазона фосфат, рибофлавин натрия фосфат и др.)
Соединения сурьмы (SbO+) в малых дозах применялись как отхаркивающие средства, а в больших - как рвотные. ЛС «Калия антимонилтартрат» (калий сурьмяновиннокислый, рвотный камень) — комплексное соединение оксида сурьмы и калия виннокислого SbOKC4H4O6).
В гомпеопатии применяют соединения мышьяка (III), который в малых дозах стимулирует эритропоэз.
Азот - один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот. Из неорганических соединений азота в медицине применяют: раствор аммиака в воде – NH3.H2O, соли аммония, оксид азота (I) N2O, натрия нитрит.
Таблица 9-1. Лекарственные средства ЛС p-элементов V группы ПСЭ.
Лекарственное вещество Структурная формула |
Описание Фармакологическая группа, применение |
Натрия нитрит Natrii nitris
NaNO2
|
Белые или белые со слабым желтоватым оттенком кристаллы. Гигроскопичен. Легко растворим в воде, растворим в спирте. Ранее применялся в медицине как сосудорасширяющее средство при стенокардии, при спазмах сосудов мозга, а также как антидот при отравлениях цианидами. Применяется в качестве консерванта и красителя в пищевой промышленности. |
Висмута нитрат основной (Висмута субнитрат) Bismuth subnitrate
4[BiNO3(OH)2],BiO(OH)
|
Представляет смесь BiNO3(OH)2, BiONO3 и BiOOH. Белый аморфный или мелкокристаллический порошок. Практически нерастворим в воде и спирте, растворим в минеральных кислотах с разложением. Применяется как антисептическое и дезинфицирующее средство, как гастропротектор. Используется при воспалительных заболеваниях кожи и слизистых оболочек (дерматит, язвы, эрозии, экзема); гастродуодените, язвенной болезни желудка и двенадцатиперстной кишки, энтерите, колите. |
Натрия нитрит /Natrii nitris
NaNO2 Mr 298.0
Натрия нитрит обладает токсичными и мутагенными свойствами, обусловленными взаимодействием в естественных условиях с вторичными и третичными аминами, образуя канцерогенные нитрозамины. При передозировке препарата в крови образуется метгемоглобин, повреждаются мембраны эритроцитов, могут развиться коллапс, обморок, сердцебиение, внутричерепная гипертензия, паралич, кома. Смертельная дозировка для человека - 2-6гр вещества.
Определение подлинности
Натрия нитрит обладает окислительно-восстановительной двойственностью, что используется при оценке качества препарата:
NO2- – окислитель: NO2-+ 2Н+ + e- NO + Н2О
NO2- – восстановитель: NO2- + Н2О - 2e- NO3- + 2Н+
А. Разбавьте 1 мл раствора С1 (см. определение чистоты) до 25 мл водой. К 0,1 мл раствора добавьте 1 мл раствора сульфаниловой кислоты. Дайте постоять 2-3 мин. Добавьте 1 мл раствора β-нафтола и 1 мл раствора разведенного натрия гидроксида. Развивается интенсивное красное окрашивание.
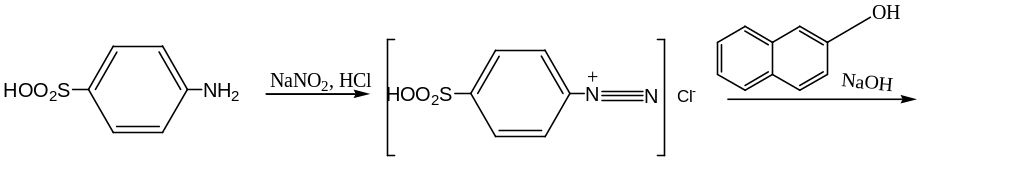
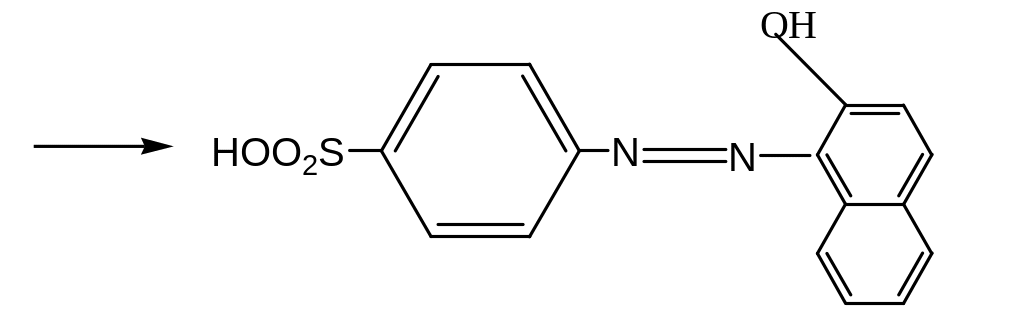
азокраситель
Б. К 1 мл раствора, приготовленного для определения подлинности в пункте А, добавьте 3 мл раствора антипирина (фенозона) (20г/л) и 0,4 мл разбавленной серной кислоты. Развивается интенсивное зеленое окрашивание.
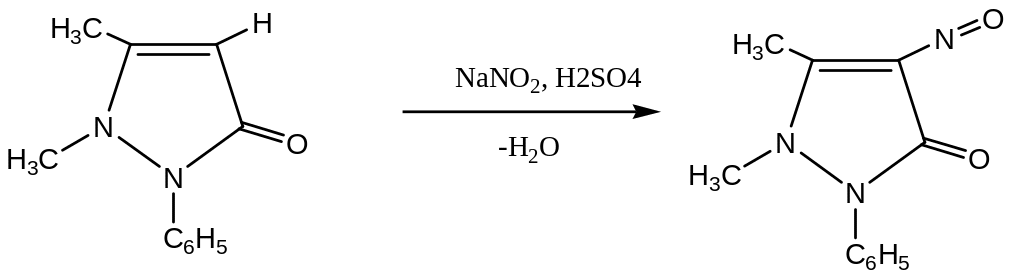
антипирин нитрозоантипирин,
изумрудно-зеленый
В. К 0,15 мл раствора С1 добавьте 0,35 мл воды. Полученный раствор дает реакции на натрий.
Оценка чистоты.
Раствор С1. Растворите 2,5 г ЛС в воде, свободной от диоксида углерода, и разбавьте до 50 мл тем же растворителем.
Раствор С2. Растворите 3 г ЛС в дистиллированной воде. Осторожно добавьте 10 мл азотной кислоты и выпарите до сухого остатка. Растворите остаток в 10 мл дистиллированной воды, нейтрализуйте разведенным раствором натрия гидроокисида и разбавьте до 30 мл дистиллированной водой.
NO2- + 2H+ 2HNO2 NO2 + NO + H2O
Прозрачность и цветность. Раствор С1 – прозрачный и по окраске не превосходит эталон цветности В6.
Кислотность и щелочность. К 10 мл раствора С1, добавьте 0,05 мл раствора фенолового красного, 0,1 мл 0,01 М раствора натрия гидроксида. Раствор приобретает красную окраску. При добавлении 0,3 мл 0,01 М раствора хлороводородной кислоты окраска раствора изменяется на желтую.
При определении хлоридов, сульфатов и тяжелых металлов используют раствор С2, чтобы избежать образования малорастворимого (1:300) белого осадка серебра нитрита AgNO2: умеренно растворимого (1:67,5) ВаNO2 и Pb(NO2
)2
Хлориды. Разбавьте 10 мл раствора С2 до 15 мл дистиллированной водой. Раствор сравните с эталоном на хлориды. Содержание хлоридов не должно превышать 50 ррm.
Cl- + Ag+ AgCl¯
Сульфаты. Разбавьте 7,5 мл раствора С2 до 15 мл дистиллированной водой. Раствор сравните с эталоном на сульфаты. Содержание сульфатов не должно превышать 200 ррm.
Тяжелые металлы. Разбавьте 10 мл раствора С2 до 20 мл дистиллированной водой. 12 мл полученного раствора сравните с эталоном на тяжелые металлы (1 ррm Pb). Содержание тяжелых металлов не должно превышать 20 ррm.
Потеря в весе при высушивании. Не более чем 1%, при высушивании 1,000 г вещества в вакууме.
Количественное определение
Метод обратной цереметрии.
0,1г субстанции (точная навеска) натрия нитрита растворить в 25мл дистиллированной воды. 5мл полученного раствора при постоянном перемешивании внести в коническую колбу, содержащую 7,5мл 0,1моль/л раствора сульфата церия. Колбу быстро закрыть пробкой и оставить на две минуты.
2Ce(SO4)2 + NaNO2 + Н2О ® NaNO3 + Ce2(SO4)3 + H2SО4
Далее в колбу добавить 2,5мл раствора KI (200 г/л) и 0,5мл раствора крахмала. Продолжая постоянное перемешивание, титровать 0,1М раствором натрия тиосульфата до исчезновения синей окраски.
.2Ce(SO4)2+ 2KI ® I2+ K2SO4 + Ce2(SO4)3
I2 + 2Na2S2O3 ® 2NaI + Na2S4O6
1мл 0,1 моль/л Cе(SO4)2 соответствует 3,45мг NаNO2
Хранение. Препарат хранят в хорошо закрытых банках из оранжевого стекла в сухом темном месте, так как на воздухе он легко окисляется, а на свету частично разлагается (диспропорционирует) и желтеет:
2NaNO2 + H2O NO2 + NO + 2NaOH
Висмута субнитрат /Bismuth subnitrate
4[BiNO3(OH)2],BiO(OH) Mr 1462
Определение подлинности
А. Разведите 1 мл раствора С1 до 5мл водой, добавьте 0.3 мл раствора калия йодида. Образуется чёрный осадок, который растворяется при добавлении 2 мл раствора калия йодида и раствор становится оранжевым.
Bi(NO3)3 + 3KI → BiI3↓ + 3KNO3
BiI3 + KI → K[BiI4]
B. Даёт реакцию (б) на висмут (см. Общие реакции). При взаимодействии ионов висмута с тиомочевиной образуются различного состава тиомочевинные комплексы, имеющие лимонно-желтую окраску:
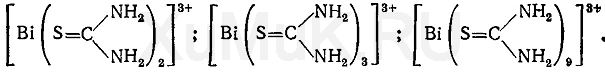
С. Даёт реакцию на нитраты (см. Общие реакции по ЕР)

D. рН раствора С2 не более 2.0
Оценка чистоты
Приготовление раствора С1: взболтайте 5 г вещества при постепенном нагревании в 10 мл воды, добавьте 20 мл азотной кислоты. Нагревайте до растворения, охладите и доведите до 100 мл водой.
Приготовление раствора С2: поместите 1 г вещества в 20 мл колбу и добавьте 2 мл азотной кислоты, не содержащей свинца. Оставьте на некоторое время для растворения, при необходимости слегка нагрейте. Добавьте 10 мл воды, встряхните и добавьте небольшими порциями 4,5 мл раствора аммония, не содержащего свинца; встряхните, охладите, доведите объем раствора до 20 мл водой, снова встряхните до осаждения твердых частиц. Раствор должен быть прозрачным и бесцветным.
Кислотность. Суспензируйте 1 г вещества в 15 мл воды и несколько раз встряхните. Дайте отстояться в течение 5 минут и профильтруйте. К 10 мл фильтрата добавьте 0,5 мл раствора фенолфталеина. Для изменения окраски на розовую должно потребоваться не более чем 0,5 мл 0,1моль/л раствора натрия гидроксида.
Хлориды. К 5 мл раствора С1 добавьте 3 мл азотной кислоты и доведите объем раствора до 15 мл водой. Раствор сравните с эталоном на хлориды. Содержание хлоридов не должно превышать 200 ррm в растворе С2.
Медь. Не более чем 50 ррm меди, определенного методом атомно-абсорбционной спектрометрии в растворе С2.
Свинец. Не более чем 20 ррm свинца, определенной методом атомно-абсорбционной спектрометрии в растворе С2.
Серебро. Не более чем 25 ррm серебра, определенной методом атомно-абсорбционной спектрометрии.
Вещества, не осаждаемые аммиаком. К 20 мл раствора С1 добавьте концентрированный раствор аммиака до щелочной реакции и профильтруйте. Промойте осадок водой и выпарьте его на водяной бане. Добавьте 0,3 мл разведенной серной кислоты и прокалите. Остаток не должен быть более 10 мг (1%).
Сухой остаток. Не более чем 3%, при высушивании 1 г вещества при 1000 –1050С.
Количественное определение.
Растворите при нагревании 0.25 г вещества в 10 мл смеси, состоящей из 2 частей кислоты хлорной и 5 частей воды. К горячему раствору добавьте 200 мл воды и 50 мг растертого ксиленолового оранжевого. Титруйте 0,1 моль/л раствором натрия эдетата до появления жёлтой окраски.
1мл 0.1моль/л эдетата натрия соответствует 20.90 мг Bi
Висмут субнитрат содержит не менее 71% и не более 74% висмута, рассчитанное на сухое вещество.
Прямое комплексонометрическое титрование включает три стадии:
1 стадия – образование окрашенного комплекса ионов металла с индикатором.
При прибавлении индикатора ксиленолового оранжевого (индикатор добавляется в таком количестве, чтобы связать менее 1% ионов металла) к раствору висмута нитрата основного, образуется окрашенный в синий цвет комплекс ионов висмута с индикатором:
H6Ind ) + Bi3+ ® BiH3Ind + 3H+
желтый синий
2 стадия - образование комплекса ионов металла с трилоном Б.
При титровании раствором ЭДТА (Н2Y2-) образуется бесцветный комплекс иона висмута с ЭДТА, который более устойчивый, чем комплекс ионов металла с индикатором:
Bi3+ + Н2Y2- ® BiY- + 2H+
3 стадия – разрушение комплекса ионов металла с индикатором, образование более устойчивого комплекса ионов металла с ЭДТА и выделение свободного индикатора:
BiH3Ind + Н2Y2- ® BiY- + H6Ind
синий желтый
В точке эквивалентности выделяется свободный индикатор, и наблюдается переход окраски из синей в желтую. Титрование ведут в кислой среде.
Хранение. В хорошо закрытых банках оранжевого стекла в защищенном от света месте.
