
- •Часть I
- •Часть I
- •Оглавление
- •Введение
- •Лабораторно-практическое занятие № 1 Введение в фармацевтическую химию. Понятие о нормативной документации в фармации.
- •Знакомство с правилами безопасной работы в химической лаборатории.
- •Вопросы для обсуждения на семинаре.
- •3. Лабораторная работа Сравнительный анализ фс фармакопей различных стран
- •Лабораторно-практическое занятие № 2 Общие реакции подлинности лекарственных средств различных химических классов
- •1. Вопросы для обсуждения на семинаре.
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Общие фармакопейные реакции подлинности
- •Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
- •Оценка чистоты лекарственных средств: определение допустимых и недопустимых примесей
- •Лабораторно-практическое занятие № 4 Оценка качества лекарственных средств по показателю «чистота». Часть 2.
- •1. Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи
- •3. Лабораторная работа – 45 мин Оценка качества лекарственных средств по показателю «чистота»
- •Растворимость левомицетина
- •4. Защита лабораторной работы – 30 мин
- •Лабораторно-практическое занятие № 5 Оценка качества лекарственных средств по показателю «количественное определение»
- •Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Количественное определение действующего вещества в лекарственной субстанции титриметрическим методом
- •Лабораторно-практическое занятие № 6 Контрольная работа №1 «Общие вопросы фармацевтической химии»
- •Защита контрольной работы – 90 мин.
- •Лабораторно-практическая работа № 7 Фармацевтический анализ лекарственных средств p-элементов VII группы периодической системы элементов
- •Препараты галогенов
- •Абсорбционный комплекс синего цвета
- •Препараты галогенидов
- •1. Реакции на натрий.
- •Светло-желтый
- •2. Реакции на калий
- •Светло-желтый
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов VII группы псэ
- •Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
- •VI группы периодической системы элементов
- •Тиосульфат натрия/Natrii thiosulfas
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств р-элементов VI группы
- •Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементами V группы периодической системы элементов
- •Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
- •(Бура/ Borax)
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов III-IV групп
- •Лабораторно-практическое занятие № 11 Контрольная работа № 2 Фармацевтический анализ лекарственных средств p-элементов VII, VI, V, IV, III групп периодической системы элементов
- •1. Контрольный тест - 45 мин
- •2. Подготовка ответа на вопросы билета – 45 мин
- •Решите задачи:
- •3. Защита контрольных работ – 90 мин.
- •Лабораторно - практическое занятие №12 Фармацевтический анализ лекарственных средств s-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе магния
- •Лекарственные средства на основе кальция
- •Лекарственные средства на основе бария
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс s-элементов I-II групп псэ
- •Лабораторно-практическое занятие № 13 Фармацевтический анализ лекарственных средств d-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе серебра
- •Коллоидные препараты серебра
- •Лекарственные средства на основе цинка
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d- элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе железа
- •Лекарственные средства на основе платины
- •Радиофармацевтические препараты
- •Гомеопатические лекарственные средства
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d-элементов VIII группы псэ
- •Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Лекарственные средства – галогенопроизводные ациклических алканов
- •Лекарственные средства на основе спиртов
- •Лекарственные средства на основе эфиров
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств на основе спиртов
- •Лабораторно-практическое занятие № 17 Фармацевтический анализ лекарственных средств альдегидов и углеводов
- •Лекарственные средства альдегидов
- •Лекарственные средства на основе углеводов
- •1. Семинар - 90 мин
- •2.Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс альдегидов и углеводов
- •Лабораторно-практическое занятие № 18 Итоговое занятие
- •Приложение 1 Правила безопасной работы в лаборатории
- •Частные фармакопейные статьи к лабораторно-практическому занятию№1
- •Приложение 2 Общие фармакопейные статьи (Государственная фармакопея XI) определение температуры плавления
- •Определение температурных пределов перегонки
- •Определение плотности
- •Растворимость
- •Определение показателя преломления (рефрактометрия)
- •Определение оптического вращения (поляриметрия)
- •Определения, основанные на измерении поглощения электромагнитного излучения
- •Спектрофотометрия
- •Спектрофотометрия в ультрафиолетовой и видимой областях
- •Определение степени белизны порошкообразных лекарственных средств
- •Определение рН
- •Определение окраски жидкостей
- •Определение прозрачности и степени мутности жидкостей
- •Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
- •В лекарственных препаратах
- •Приложение 4 Частные фармакопейные статьи для лс р-элементов VII группы псэ (ер, перевод с английского)
- •Калия бромид (Kalii Bromidum)
- •Калия йодид (Kalii iodidum)
- •Натрия бромид ( Natrii Bromidum)
- •Натрия йодид ( Natrii iodidum)
- •Натрия фторид (Natrii fluoridum)
- •Натрия хлорид (Natrii chloridum)
- •Вода очищенная в резервуарах
- •Вода для инъекций (Aqua pro injectionibus)
- •Стерильная вода для инъекций
- •Раствор водорода пероксида (3%) (Solutio Hydrogenii peroxydi 3%)
- •Магния пероксид (Magnesii peroxydum)
- •Натрия тиосульфат (Natrii thiosulfas)
- •Натрия тетраборат (Natrii tetraboras) (Бура Borax)
- •Алюминия гидроксид (Aluminii hydroxidum)
- •Алюминия фосфат (Aluminii рhosphaS)
- •Натрия гидрокарбонат (Natrii hydrocarbonas)
- •Лития карбонат (Lithii carbonas)
- •Кальция хлорид (Сalcii chloridum)
- •Бария сульфат для рентгеноскопии (barii sulfas pro roentgeno)
- •Магния сульфат (Magnesii sulfas)
- •Магния оксид (Magnesii oxidum)
- •Серебра нитрат (Argenti nitras)
- •Цинка оксид (Zinci oxydum)
- •Цинка сульфат (Zinci sulfas)
- •Железа глюконат
- •Железа фумарат
- •Цисплатин (Cisplatinum)
- •Йодированный [I 125] альбумин для инъекций, меченный.
- •Натрия йодида [i131] раствор
- •Приложение 12 Частные фармакопейные статьи для лс галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Приложение 13 Частные фармакопейные статьи для лс альдегидов и углеводов
Тиосульфат натрия/Natrii thiosulfas
Na2S2O3,5H2O Mr 248.2
Содержание действующего вещества составляет от 99.0 % до 101.0 % Na2S2O3,5H2O
Натрия тиосульфат – соль, образованная катионом натрия и анионом тиосерной кислоты:
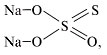
Сера в тиосульфат-ионе находится в разной степени окисления: (+4 и 0). Поэтому окислительно-восстановительные превращения тиосульфат-иона весьма разнообразны и используются в фармацевтическом анализе.
В водном растворе натрия тиосульфат гидролизуется по аниону:
S2O32- + H2O HS2O3- + OH-
На воздухе препарат разлагается:
2Na2S2O3 + O2 (воздух) = 2Na2SO4 + 2S
Натрия тиосульфат применяют как антидот при отравлениях тяжелыми металлами и цианидами. Его применяют также в качестве десенсибилизирующего (предупреждающего или ослабляющего проявления аллергии), а также как противопаразитарное средство. При лечении чесотки втирают 60 % раствор в кожу туловища и конечностей и после высыхания смачивают 6 % раствором соляной кислоты (по прописи Демьяновича). Гибель чесоточного клеща и его яиц обусловлена акарицидным действием серы и сернистого ангидрида:
Na2S2O3 + 2НСI SO2 + S + 2NaCl + H2O
Реакции подлинности
А. Разложение натрия тиосульфат в кислой среде с образованием опалесциирующих частиц элементной серы и оксида серы(IV), имеющего специфический запах (см. выше).
Б. При взаимодействии раствора натрия тиосульфата с раствором серебра нитрата образуется белый осадок, цвет которого постепенно меняется от белого в желтый, бурый, чёрный:
Na2S2O3 + 2AgNO3 Ag2S2O3(белый)+ 2NaNO3
Ag2S2O3 Ag2SO3 (белый)+ S (желтый)
Ag2SO3 + S + H2OAg2S (черный ) )+ H2SO4
Реакцию проводят с избытком раствора серебра нитрата.
В. Препарат также дает характерные реакции на ион натрия.
Оценка чистоты
Поскольку натрия тиосульфат применяют в больших дозах, в том числе для внутривенного введения, его подвергают тщательному испытанию на чистоту. В соответствии с требованиями ГФ РФ устанавливают прозрачность и цветность 30% раствора, щелочность 10% раствора. Недопустимые примеси: сульфиты, сульфаты, сульфиды, кальций, мышьяк, селен. Допустимые примеси: хлориды, тяжелые металлы, железо.
Количественное определение содержания натрия тиосульфата субстанции проводят йодометрически. Титрант – 0,05 моль/л раствор йода, индикатор – крахмал. Титрование ведут до появления синего окрашивания йодкрахмального комплекса абсорбционной природы.
2Na2S2O3 + I2 → 2NaI + Na2S4O6
1мл 0,05 моль/л йода соответствует 24,82 мг Na2S2O35H2O.
По ГФ РФ содержание Na2S2O3 должно быть не более 102 %, учитывая степень потери (выветривания) кристаллизационной воды.
Хранение. В герметичной таре.
1. Семинар - 90 мин
Вопросы для обсуждения:
Методы получения ЛС р-элементов VI группы ПСЭ.
Фармакопейные и нефармакопейные реакции подлинности ЛС р-элементов VI группы ПСЭ.
Испытания на чистоту и определение допустимых примесей в ЛС р-элементов VI группы ПСЭ.
Методики количественного определения ЛС р-элементов VI группы ПСЭ.
Применение ЛС р-элементов VI группы в медицине.
