
- •Часть I
- •Часть I
- •Оглавление
- •Введение
- •Лабораторно-практическое занятие № 1 Введение в фармацевтическую химию. Понятие о нормативной документации в фармации.
- •Знакомство с правилами безопасной работы в химической лаборатории.
- •Вопросы для обсуждения на семинаре.
- •3. Лабораторная работа Сравнительный анализ фс фармакопей различных стран
- •Лабораторно-практическое занятие № 2 Общие реакции подлинности лекарственных средств различных химических классов
- •1. Вопросы для обсуждения на семинаре.
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Общие фармакопейные реакции подлинности
- •Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
- •Оценка чистоты лекарственных средств: определение допустимых и недопустимых примесей
- •Лабораторно-практическое занятие № 4 Оценка качества лекарственных средств по показателю «чистота». Часть 2.
- •1. Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи
- •3. Лабораторная работа – 45 мин Оценка качества лекарственных средств по показателю «чистота»
- •Растворимость левомицетина
- •4. Защита лабораторной работы – 30 мин
- •Лабораторно-практическое занятие № 5 Оценка качества лекарственных средств по показателю «количественное определение»
- •Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Количественное определение действующего вещества в лекарственной субстанции титриметрическим методом
- •Лабораторно-практическое занятие № 6 Контрольная работа №1 «Общие вопросы фармацевтической химии»
- •Защита контрольной работы – 90 мин.
- •Лабораторно-практическая работа № 7 Фармацевтический анализ лекарственных средств p-элементов VII группы периодической системы элементов
- •Препараты галогенов
- •Абсорбционный комплекс синего цвета
- •Препараты галогенидов
- •1. Реакции на натрий.
- •Светло-желтый
- •2. Реакции на калий
- •Светло-желтый
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов VII группы псэ
- •Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
- •VI группы периодической системы элементов
- •Тиосульфат натрия/Natrii thiosulfas
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств р-элементов VI группы
- •Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементами V группы периодической системы элементов
- •Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
- •(Бура/ Borax)
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов III-IV групп
- •Лабораторно-практическое занятие № 11 Контрольная работа № 2 Фармацевтический анализ лекарственных средств p-элементов VII, VI, V, IV, III групп периодической системы элементов
- •1. Контрольный тест - 45 мин
- •2. Подготовка ответа на вопросы билета – 45 мин
- •Решите задачи:
- •3. Защита контрольных работ – 90 мин.
- •Лабораторно - практическое занятие №12 Фармацевтический анализ лекарственных средств s-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе магния
- •Лекарственные средства на основе кальция
- •Лекарственные средства на основе бария
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс s-элементов I-II групп псэ
- •Лабораторно-практическое занятие № 13 Фармацевтический анализ лекарственных средств d-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе серебра
- •Коллоидные препараты серебра
- •Лекарственные средства на основе цинка
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d- элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе железа
- •Лекарственные средства на основе платины
- •Радиофармацевтические препараты
- •Гомеопатические лекарственные средства
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d-элементов VIII группы псэ
- •Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Лекарственные средства – галогенопроизводные ациклических алканов
- •Лекарственные средства на основе спиртов
- •Лекарственные средства на основе эфиров
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств на основе спиртов
- •Лабораторно-практическое занятие № 17 Фармацевтический анализ лекарственных средств альдегидов и углеводов
- •Лекарственные средства альдегидов
- •Лекарственные средства на основе углеводов
- •1. Семинар - 90 мин
- •2.Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс альдегидов и углеводов
- •Лабораторно-практическое занятие № 18 Итоговое занятие
- •Приложение 1 Правила безопасной работы в лаборатории
- •Частные фармакопейные статьи к лабораторно-практическому занятию№1
- •Приложение 2 Общие фармакопейные статьи (Государственная фармакопея XI) определение температуры плавления
- •Определение температурных пределов перегонки
- •Определение плотности
- •Растворимость
- •Определение показателя преломления (рефрактометрия)
- •Определение оптического вращения (поляриметрия)
- •Определения, основанные на измерении поглощения электромагнитного излучения
- •Спектрофотометрия
- •Спектрофотометрия в ультрафиолетовой и видимой областях
- •Определение степени белизны порошкообразных лекарственных средств
- •Определение рН
- •Определение окраски жидкостей
- •Определение прозрачности и степени мутности жидкостей
- •Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
- •В лекарственных препаратах
- •Приложение 4 Частные фармакопейные статьи для лс р-элементов VII группы псэ (ер, перевод с английского)
- •Калия бромид (Kalii Bromidum)
- •Калия йодид (Kalii iodidum)
- •Натрия бромид ( Natrii Bromidum)
- •Натрия йодид ( Natrii iodidum)
- •Натрия фторид (Natrii fluoridum)
- •Натрия хлорид (Natrii chloridum)
- •Вода очищенная в резервуарах
- •Вода для инъекций (Aqua pro injectionibus)
- •Стерильная вода для инъекций
- •Раствор водорода пероксида (3%) (Solutio Hydrogenii peroxydi 3%)
- •Магния пероксид (Magnesii peroxydum)
- •Натрия тиосульфат (Natrii thiosulfas)
- •Натрия тетраборат (Natrii tetraboras) (Бура Borax)
- •Алюминия гидроксид (Aluminii hydroxidum)
- •Алюминия фосфат (Aluminii рhosphaS)
- •Натрия гидрокарбонат (Natrii hydrocarbonas)
- •Лития карбонат (Lithii carbonas)
- •Кальция хлорид (Сalcii chloridum)
- •Бария сульфат для рентгеноскопии (barii sulfas pro roentgeno)
- •Магния сульфат (Magnesii sulfas)
- •Магния оксид (Magnesii oxidum)
- •Серебра нитрат (Argenti nitras)
- •Цинка оксид (Zinci oxydum)
- •Цинка сульфат (Zinci sulfas)
- •Железа глюконат
- •Железа фумарат
- •Цисплатин (Cisplatinum)
- •Йодированный [I 125] альбумин для инъекций, меченный.
- •Натрия йодида [i131] раствор
- •Приложение 12 Частные фармакопейные статьи для лс галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Приложение 13 Частные фармакопейные статьи для лс альдегидов и углеводов
Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
VI группы периодической системы элементов
Перечень лекарственных веществ p-элементов VI группы ПСЭ в соответствие с учебной программой:
Кислород/Oxygen
Вода очищенная /Aqua purificata
Вода для инъекций /Aqua pro Injectionibus
Раствор пероксида водорода /Solutio Hydrogenii peroxydi diluta
Магния пероксид /Magnesii peroxidum
Гидроперит /Hydroperiti
Натрия тиосульфат /Natrii thiosulfas
К р-элементам VI группы относятся кислород, сера, селен, теллур и полоний.
Кислород и сера - это эссенциальные элементы. Кислород - самый распространенный элемент земной коры. Он является основой жизнедеятельности животных организмов. Сера входит в состав аминокислот, пептидов, белков и ряда других биологически активных соединений. Селен (в виде селенита) обладает антиоксидантной активностью. Для теллура и полония биологическая роль не доказана, но известно, что их соединения проявляют токсические свойства.
Свойства лекарственных веществ p-элементов VII группы ПСЭ описаны в таблице 8-1:
Таблица 8-1. Лекарственные средства ЛС p-элементов VI группы ПСЭ
Лекарственное вещество Структурная формула |
Описание Фармакологическая группа, применение |
Кислород Oxygen О2
|
Кислород — бесцветный газ без запаха. При 20°C и давлении 1 атм. (101 kPa), 1 объем кислорода растворим в 32 объемах воды. Относится к группе «Антигипоксанты и антиоксиданты». Применяется при заболеваниях, сопровождающихся гипоксией: при заболеваниях органов дыхания (пневмония, отек легких и др.), сердечно-сосудистой системы, отравлениях окисью углерода, синильной кислотой, удушающими веществами (хлор, фосген и др.), а также при других заболеваниях с нарушением функции дыхания и окислительных процессов. Кислород используют в хирургии, интенсивной терапии и т.д. для гипербарической оксигенации (применение кислорода под повышенным давлением), для улучшения обменных процессов используют метод энтеральной оксигенотерапии (введения в желудок кислородного коктейля), кислород применяют для лечения гельминтозов. |
Вода очищенная Aqua purificata
Н2О
|
Бесцветная прозрачная жидкость без запаха. Применяется для приготовления нестерильных лекарственных средств, воды для инъекций, а также для проведения испытаний лекарственных средств.
|
Вода для инъекций Aqua pro Injectionibus
Н2О |
Бесцветная прозрачная жидкость без запаха. Применяется в качестве растворителя при приготовлении лекарственных средств для парентерального применения. |
Раствор пероксида водорода Solutio Hydrogenii peroxydi diluta H2O2
|
Бесцветная прозрачная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции. Быстро разлагается под действием света, при нагревании или соприкосновении со щелочью, окисляющими или восстанавливающими веществами, с выделением кислорода. Является антисептическим, гемостатическим, дезинфицирующим, дезодорирующим лекарственным средством. Применяется наружно для первичной обработки поверхностных загрязненных ран, очищения раны от гноя и сгустков крови, остановки капиллярных кровотечений из поверхностных ран, лунки зуба и носовых кровотечений. |
Магния пероксид Magnesii peroxidum
MgO.MgO2 |
Белый или желтоватый, аморфный, легкий порошок без запаха, практически нерастворим в воде и в спирте, растворим в разведенных минеральных кислотах с выделением перекиси водорода. Относится к антисептическим и дезинфицирующим средствам. Применяют при диспепсии. Эффект частично связан с действием магния окиси, частично - с образованием перекиси водорода при растворении препарата в кислом содержимом желудка. |
Гидроперит (Мочевины пероксид) Hydroperit
OC(NH2)2.H2O2
|
Производное мочевины. Содержит около 35% перекиси водорода. Белый кристаллический порошок. Легко растворим в воде, растворим в спирте. Оказывает антисептическое, антибактериальное, дезодорирующее, гемостатическое действие. При контакте с поврежденной кожей или слизистыми оболочками высвобождается активный кислород, происходит механическое очищение раны и инактивация органических веществ. Применяется при воспалении слизистых оболочек и кожи, гнойных ранах, капиллярном кровотечении из поверхностных ран, носовом кровотечение; стоматите, тонзиллите. |
Натрия тиосульфат Natrii thiosulfas
Na2S2O3.5H2O
|
Прозрачные, бесцветные кристаллы. Выветривается в сухом воздухе. Легко растворим в воде, практически нерастворим в спирте. При 490C плавится в кристаллизационной воде. Применяется как дезинтоксикационное, противовоспалительное, десенсибилизирующее, противочесоточное средство. Образует нетоксичные или малотоксичные соединения с солями тяжелых металлов, галогенами, цианидами. При отравлении соединениями мышьяка, ртути, свинца образуются неядовитые сульфиты. Противочесоточная активность обусловлена способностью распадаться в кислой среде с образованием серы и сернистого ангидрида, которые оказывают повреждающее воздействие на чесоточного клеща и его яйца. |
Кислород/Oxygen
О2 Mr 32,00
Содержание действующего вещества в субстанции должно составлять не менее 99,5% V/V.
Кислород - важнейший биогенный химический элемент, обеспечивающий дыхание большинства живых организмов на Земле. Атом кислорода обладает высокой реакционной способностью, генерирует в организме высокоактивные свободные радикалы и нерадикальные частицы - активные формы кислорода (АФК).
При полном восстановлении молекула кислорода превращается в воду:
О2 + 4е + 4 Н+→ 2 Н2О
При неполном восстановлении образуются АФК:
О2 + е → О2• – супероксидный анион-радикал
О2 + е + Н+ → НОО• – гидропероксильный радикал
О2 + 2е + 2Н+ → Н2О2 – пероксид водорода
О2 + 3е + 3Н+ → НО• + Н2О – гидроксильный радикал
В организме АФК выполняют функции, связанные с их включением в продуцирование энергии, фагоцитоз, регулирование клеточного роста, синтез биологически активных соединений. При избыточном накоплении АФК могут выступать в роли повреждающих частиц, атакующих липиды клеточных мембран, белки, полисахариды, нуклеиновые кислоты. С процессами ПОЛ связывают преждевременное старение, заболевания сердечно-сосудистой системы, атеросклероз и др.
Определение подлинности
1. Вспышка и яркое горение тлеющей лучинки, внесенной в сосуд с кислородом.
2. При смешивании кислорода со щелочным раствором пирогаллола развивается темно-коричневое окрашивание.
3. Идентификация при помощи парамагнитного анализатора кислорода.
Оценка чистоты
Диоксид углерода (СО2) (не более 300 ppm V/V). Содержание диоксида углерода определяют при помощи инфракрасного анализатора.
Оксид углерода (СО) (не более 5 ppm V/V). Содержание оксида углерода определяют при помощи инфракрасного анализатора.
Вода (не более 67 ppm V/V). Содержание воды определяют при помощи электролитического гидрометра.
Количественное определение кислорода проводят волюмометрическим методом (ГФ), или с использованием парамагнитного анализатора (ЕР).
Хранение Сжиженный кислород хранят в баллонах, окрашенных в синий цвет. Резьбу редуктора баллона нельзя смазывать жиром или органическими смазками (т.к. возможно самовозгорание).
Вода очищенная /Aqua purificata
H2O Mr 18.02
Вода – неоднородное вещество по своему изотопному составу: 99,73 % приходится на обычную (протиевую) воду Н2О16, из тяжелых разновидностей в природной воде больше всего содержится: Н2О18 (0,2 мол. доли, %), Н2О17 (0,04 мол. доли, %), НDО16 (0,03 мол. доли, %). Содержание остальных разновидностей тяжелой воды, в том числе и тритиевой Т2О (3Н – сверхтяжелый водород), составляет не более 10-5 мол. доли, %.
Вода как слабый электролит подвергается ионизации:
Н2О
+ Н2О
![]() Н3О+
+ ОН-
Н3О+
+ ОН-
Константа ионного произведения воды при 250С:
КН2О=[Н+] · [ОН-] =10-7 ·10-7=10-14
Для воды рН=7. На воздухе рН очищенной воды может колебаться в интервале от 5 до 7, что связано с растворением в воде CO2.
В соответствие с НД рН воды очищенной – от 5,0 до 7,0. К 100 мл воды очищенной прибавляют 0,3 мл насыщенного раствора калия хлорида и определяют рН полученного раствора потенциометрически.
Кислотность или щелочность. К 20 мл воды очищенной прибавляют 0,05 мл 0,1 % раствора фенолового красного. Если появилась желтая окраска, то она должна измениться на красную от прибавления не более 0,1 мл 0,01 моль/л раствора натрия гидроксида. Если появилась красная окраска, то она должна измениться на желтую от прибавления не более 0,15 мл 0,01 моль/л раствора хлористоводородной кислоты.
Электропроводность. Определение проводят с помощью оборудования – кондуктометров, внесенных в Государственный реестр средств измерений.
Предельно допустимые значения электропроводности воды очищенной зависят от температуры. Так, при температуре 25ºС электропроводность воды очищенной должна составлять 5,1 мкСм/см3.
Сухой остаток. 100 мл воды очищенной выпаривают досуха и сушат при температуре от 100 до 105 ºС до постоянной массы. Остаток не должен превышать 0,001 %.
Восстанавливающие вещества. 100 мл воды очищенной доводят до кипения, прибавляют 0,1 мл 0,02 М раствора калия перманганата и 2 мл серной кислоты разведенной 16 %, кипятят 10 мин; розовая окраска должна сохраниться.
MnO4- + 8H+ + 5e = Mn2+ + 4H2O
Углерода диоксид. При взбалтывании воды очищенной с равным объемом известковой воды в наполненном доверху и хорошо закрытом сосуде не должно быть помутнения в течение 1 ч.
СО2 + Са(ОН)2 ® СаСО3 ¯ + Н2О
Нитраты и нитриты. К 5 мл воды очищенной осторожно прибавляют 1 мл свежеприготовленного раствора дифениламина; не должно появляться голубого окрашивания.

Аммоний. 10 мл воды очищенной должны выдерживать испытание на аммоний с использованием эталонного раствора, содержащего 1 мл стандартного раствора аммоний-иона (2 мкг/мл) и 9 мл воды, свободной от аммиака (не более 0,00002 %).
NН3 + 2К2НgI4 + 3КОН [ОНg2NН2 ]I- + 7КI + 2Н2О
Примечание. Стандартный раствор аммоний-иона (2 мкг/мл) готовят разбавлением стандартного раствора аммоний-иона (200 мкг/мл) водой, свободной от аммиака.
Хлориды. К 10 мл воды очищенной прибавляют 0,5 мл азотной кислоты, 0,5 мл 2 % раствора серебра нитрата, перемешивают и оставляют на 5 мин. Не должно быть опалесценции.
HNO3
Аg+ + Cl- АgСl
Сульфаты. К 10 мл воды очищенной прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 1 мл 5 % раствора бария хлорида, перемешивают и оставляют на 10 мин. Не должно быть помутнения.
НСl
Ва2+ + SО42- ВаSО4
Кальций и магний. К 100 мл воды очищенной прибавляют 2 мл буферного раствора аммония хлорида рН 10,0, 50 мг индикаторной смеси протравного черного 11 и 0,5 мл 0,01 моль/л раствора натрия эдетата; должна наблюдаться чисто голубая окраска раствора.
Тяжелые металлы. 120 мл испытуемой воды очищенной упаривают до объема 20 мл. Оставшийся после упаривания воды объем смеси V=10 мл должен выдерживать испытание на тяжелые металлы с использованием эталонного раствора, содержащего 1 мл стандартного раствора свинец-иона (5 мкг/мл) и 9 мл испытуемой воды очищенной (не более 0,00001 % в испытуемой воде очищенной).
СН3СООН
Рb2+ + S2- РbS
Примечание. Стандартный раствор свинец-иона (5 мкг/мл) готовят разбавлением стандартного раствора свинец-иона (100 мкг/мл) испытуемой водой очищенной.
Микробиологическая чистота. Не более 100 микроорганизмов в 1 мл при отсутствии бактерий сем. Enterobacteriaceae, Staphylococcus aureus, Pseudomonas aeruginosa.
Испытание проводят методом мембранной фильтрации. Объем образца для испытания должен составлять не менее 50 мл.
Хранение и распределение. Вода очищенная хранится и распределяется в условиях, предотвращающих рост микроорганизмов и исключающих возможность любой другой контаминации.
Вода для инъекций/Aqua pro Injectionibus
H2O Mr 18.02
Воду для инъекций получают дистилляцией или обратным осмосом из воды очищенной или из воды, которая соответствует требованиям на питьевую воду. Части аппаратуры, которые контактируют с водой, должны быть изготовлены из инертных материалов. Первую порцию полученного дистиллята отбрасывают.
Вода для инъекций не должна содержать антимикробных консервантов или других добавок. При изготовлении стерильных лекарственных средств, которые изготавливают в асептических условиях и не подвергают последующей стерилизации, вода для инъекций должна быть стерильной.
рН. От 5,0 до 7,0. К 100 мл воды для инъекций прибавляют 0,3 мл насыщенного раствора калия хлорида и определяют рН полученного раствора потенциометрически.
Кислотность или щелочность. К 20 мл воды для инъекций прибавляют 0,05 мл 0,1 % раствора фенолового красного. Если появилась желтая окраска, то она должна измениться на красную от прибавления не более 0,1 мл 0,01 моль/л раствора натрия гидроксида. Если появилась красная окраска, то она должна измениться на желтую от прибавления не более 0,15 мл 0,01 моль/л раствора хлористоводородной кислоты.
Электропроводность.
Предельно допустимые значения электропроводности воды для инъекций зависят от температуры. Так, при температуре 25ºС электропроводность воды для инъекций должна составлять 1,3 мкСм/см3.
Сухой остаток. 100 мл воды для инъекций выпаривают досуха и сушат при температуре от 100 до 105 ºС до постоянной массы. Остаток не должен превышать 0,001 %.
Восстанавливающие вещества. 100 мл воды для инъекций доводят до кипения, прибавляют 0,1 мл 0,02 М раствора калия перманганата и 2 мл серной кислоты разведенной 16 %, кипятят 10 мин; розовая окраска должна сохраниться.
Углерода диоксид. При взбалтывании воды для инъекций с равным объемом известковой воды в наполненном доверху и хорошо закрытом сосуде не должно быть помутнения в течение 1 ч.
Нитраты и нитриты. К 5 мл воды для инъекций осторожно прибавляют 1 мл свежеприготовленного раствора дифениламина; не должно появляться голубого окрашивания.
Аммоний. 10 мл воды для инъекций должны выдерживать испытание на аммоний с использованием эталонного раствора, содержащего 1 мл стандартного раствора аммоний-иона (2 мкг/мл) и 9 мл воды, свободной от аммиака (не более 0,00002 %).
Примечание. Стандартный раствор аммоний-иона (2 мкг/мл) готовят разбавлением стандартного раствора аммоний-иона (200 мкг/мл) водой, свободной от аммиака.
Хлориды. К 10 мл воды для инъекций прибавляют 0,5 мл азотной кислоты, 0,5 мл 2 % раствора серебра нитрата, перемешивают и оставляют на 5 мин. Не должно быть опалесценции.
Сульфаты. К 10 мл воды для инъекций прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 1 мл 5 % раствора бария хлорида, перемешивают и оставляют на 10 мин. Не должно быть помутнения.
Кальций и магний. К 100 мл воды для инъекций прибавляют 2 мл буферного раствора аммония хлорида рН 10,0, 50 мг индикаторной смеси протравного черного 11 и 0,5 мл 0,01 моль/л раствора натрия эдетата; должна наблюдаться чисто голубая окраска раствора.
Тяжелые металлы. 120 мл испытуемой воды для инъекций упаривают до объема 20 мл. 10 мл оставшейся после упаривания воды должны выдерживать испытание на тяжелые металлы с использованием эталонного раствора, содержащего 1 мл стандартного раствора свинец-иона (5 мкг/мл) и 9 мл испытуемой воды для инъекций (не более 0,00001 % в испытуемой воде для инъекций).
Примечание. Стандартный раствор свинец-иона (5 мкг/мл) готовят разбавлением стандартного раствора свинец-иона (100 мкг/мл) испытуемой водой для инъекций.
Микробиологическая чистота. Не более 10 микроорганизмов в 100 мл при отсутствии бактерий сем. Enterobacteriaceae, Staphylococcus aureus, Pseudomonas aeruginosa.
Испытание проводят методом мембранной фильтрации. Объем образца для испытания составляет 200 мл.
Бактериальные эндотоксины. Менее 0,25 ЕЭ/мл.
Хранение и распределение. Воду для инъекций используют свежеприготовленной или хранят и распределяют в условиях, предотвращающих рост микроорганизмов и исключающих возможность любой другой контаминации, но не более 1 сут.
Раствор пероксида водорода /Solutio Hydrogenii peroxydi diluta
H2O2 Мr 34,01
Содержание H2O2 от 2,5% до 3,5% m/m.
Водные растворы водорода пероксида проявляют слабые кислотные свойства (рКа=11,65). Водорода пероксид высокой чистоты и его разбавленные растворы при комнатной температуре устойчивы, но в присутствии ионов d-элементов, например, серебра Ag+, и при воздействии УФ-излучения разлагаются с выделением газообразного кислорода O2 по реакции диспропорционирования:
2H2O2 O2 + 2H2O
Пероксид водорода характеризуется окислительно-восстановительной двойственностью.
H2O2 – окислитель: H2O2+ 2H+ +2e 2 H2O
H2O2 + 2e 2OH-
H2O2 – восстановитель: H2O2 O2 + 2H+ + 2e
H2O2 + 2OH- O2+ 2H2O + 2e
Во избежание разложения водорода пероксид хранят в темных склянках в прохладном месте.
Определение подлинности
1. К 2 мл препарата добавьте 0.2 мл разведенной серной кислоты и 0.2 мл 0.02М раствора калия перманганата. Раствор остаётся бесцветным или приобретает слабо розовую окраску в течение 2 минут.
2KМnO4 + 5Н2О2 + 3Н2SО4 ® 2MnSO4 + К2SО4 + 8Н2O + 5O2
2. К 0.5 мл препарата добавьте 1 мл разведенной серной кислоты, 2 мл эфира, 0.1мл раствора калия хромата и встряхните. Эфирный слой окрашивается в синий цвет.
K2Cr2O7+H2SO4(разб.) + 4 H2O2 (конц) 2[Cr(H2O)O(O2)2] + 3H2O + K2SO4
пероксохромат
[Cr(H2O)O(O2)2]р-р + Lж [Cr(L)O(O2)2]+ H2O
(синее окрашивание в органическом растворителе L)
Оценка чистоты.
Кислотность. К 10 мл добавьте 20 мл воды и 0,25 мл раствора метилового красного. Не менее чем 0,05 мл и не более чем 1 мл 0,1М раствора натрия гидроксида требуется для изменения окраски индикатора.
Органические стабилизаторы. Встряхните 20 мл с 10 мл хлороформа и затем отберите 2 аликвоты, каждая по 5 мл. Выпаривайте хлороформный слой при температуре не выше 250С и высушите остаток в эксикаторе. Остаточная масса не должна быть более 5 мг (250 ppm).
Нелетучий остаток. Поместите 10 мл вещества в платиновом тигле. Выпарите раствор досуха на водяной бане и высушите остаток при температуре 1000С-1050С. Весовой остаток не должен быть более 20 мг (2 г/л).
Количественное определение.
Разбавьте 10 г препарата до 100 мл водой. К 10 мл этого раствора прибавьте 20 мл разведенной серной кислоты. Титруйте 0.02М раствором калия перманганата до появления розовой окраски.
1мл 0.02моль/л калия перманганата соответствует 1.701мг Н2О2 или 0.56 мл кислорода.
Хранение. В защищенном от света месте. Если раствор не содержит стабилизатор, хранить при температуре ниже 150С.
Магния пероксид /Magnesii peroxidum
MgO.MgO2 Мr 56,30
Магния пероксид является смесью магния пероксида (MgO2) и магния оксида (MgO); содержит не менее 22,0% и не более 28,0% MgO2.
Определение подлинности
1. Растворите около 15 мг препарата в 2 мл разбавленной азотной кислоты и нейтрализуйте раствором разбавленного натрия гидроксида. Раствор дает реакцию на ион магния.
MgO2 + Н2SО4 MgSO4 + H2O2
MgCl2 + Na2HPO4 + NH3 NH4MgPO4 + 2NaCl
2. Растворите около 15 мг препарата в 2 мл разбавленной серной кислоты и разбавьте до 10 мл водой. Перемешайте 1 мл раствора с 5 мл эфира и 0,5 мл раствора калия дихромата. Эфир приобретает голубую окраску.
MgO2 + Н2SО4 MgSO4 + H2O2
K2Cr2O7 + H2SO4 (разб.) + 4 H2O2 (конц) 2[Cr(H2O)O(-O-О-)2] + 3H2O + K2SO4
[Cr(H2O)O(-O-О-)2](р-р) + L(ж) = [Cr(L)O(-О-О-)2] (синий р-р) + H2O
Оценка чистоты.
Раствор S1. Растворите 5,0 г препарата в 40 мл хлороводородной кислоты. Осторожно выпарьте раствор до объема 10 мл и разбавьте до 10 мл смесью равных объемов уксусной кислоты и дистиллированной воды. При необходимости отфильтруйте в предварительно прокаленный фарфоровый тигель или тигель из кварцевого стекла подходящей пористости для получения чистого фильтрата. Сохраните осадок для теста на вещества, нерастворимые в кислотах.
Раствор S2. Разбавьте 5 мл раствора S1 дистилированной водой до 25 мл.
Цветность. Окраска раствора S1 не превосходит эталон цветности В4.
Вещества, нерастворимые в кислотах - не более 0,1%.
Кислотность или щелочность. К 2,0 г препарата добавьте 100 мл свободной от СО2 воды и нагрейте до кипения в течение 5 минут. Отфильтруйте в горячем состоянии через фильтр из метало-керамического стекла (40), дайте остыть и разбавьте до 100 мл водой. К 15 мл фильтрата добавьте 0,1 мл раствора фенолфталеина. Раствор должен иметь красную окраску. Не более 0,2 мл 0,1 моль/л кислоты хлороводородной необходимо для изменения цвета индикатора. Сохраните фильтрат для проведения теста на растворимые вещества.
Растворимые вещества. Возьмите 50 мл полученного в ходе теста на кислотность или щелочность фильтрата, выпарьте до сухого состояния и высушите при 1000С-1050С. Масса остатка - не более 15 мг (1,5 %).
Хлориды. Растворите 50 мг в 5 мл разбавленной азотной кислоты и разбавьте до 15 мл водой. Раствор должен выдержать испытания на предельное содержание хлоридов (0,1 %).
Сульфаты. Разбавьте 3 мл раствора S2 дистилированной водой до 15 мл. Полученный раствор должен соответствовать нормам испытаний на предельное содержание сульфатов (0,5%).
Мышьяк. 5 мл раствора S1 соответствует нормам испытаний на предельное содержание на мышьяк (4 ppm).
Кальций. Разбавьте 1 мл раствора S2 дистилированной водой до 15 мл. Полученный раствор должен соответствовать нормам испытаний на предельное содержание кальция (1 %).
Железо. Разбавьте 2 мл раствора S2 дистилированной водой до 10 мл. Полученный раствор должен соответствовать нормам испытаний на предельное содержание железа (500 ppm).
Тяжелые металлы. К 20 мл раствора S1 добавьте 15 мл хлороводородной кислоты и встряхивайте с 25 мл метил изобутил кетоном в течение 2 мин. Оставьте стоять, затем отделите и выпарите водный слой. Растворите сухой остаток в 1,5 мл уксусной кислоты и разбавьте дистиллированной водой до 30 мл. Приготовьте раствор сравнения, используя стандартный раствор свинца. (1 ppm Pb).
Количественное определение.
Растворите 80,0 мг препарата, осторожно перемешивая, в предварительно охлажденной до 20оС смеси серной кислоты (10 г) и 90 мл воды. Оттитровать 0,02 моль/л раствором калия перманганатом до слабо розового окрашивания.
1 мл 0,02 моль/лраствора калия перманганата эквивалентен 2,815 мг MgO2.
Хранение. В защищенном от света месте.
Гидроперит/Hydroperit
OC(NH2)2.H2O2 Мr 94,07
Гидроперит представляет собой эквимолярную смесь мочевины и пероксида водорода. Содержание перекиси водорода составляет около 35 %. Применяется в виде таблеток (Тabulettae Нуdroperiti) по 1,5 г в упаковке по 6 штук. Одна таблетка гидроперита массой 1,5 г соответствует 15 мл 3% раствора пероксида водорода. При растворении таблетки в стакане воды получают 0,25% раствор пероксида водорода.
Реакции подлинности
А. Реакции на пероксид водорода
Б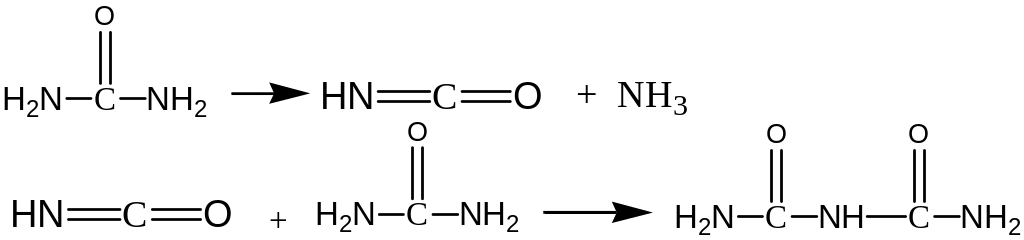 .
Мочевину
в гидроперите определяют по биуретовой
реакции:
.
Мочевину
в гидроперите определяют по биуретовой
реакции:
фиолетовая окраска
Количественное определение
Содержание пероксида водорода в таблетках гидроперита устанавливают методом йодометрического титрования (заместительное титрование):
2KI + H2O2 + H2SO4 I2 + K2SO4 + 2H2О
I2 + 2Nа2S2O3 2 NaI + Na2S4O6
Титрант – 0,1 моль/л раствор натрия тиосульфата. Индикатор – крахмал. Титруют до исчезновения синего окрашивания.
Хранение. В сухом, защищенном от света месте, в хорошо закрытой таре при температуре не выше + 20 0С.
