
- •Часть I
- •Часть I
- •Оглавление
- •Введение
- •Лабораторно-практическое занятие № 1 Введение в фармацевтическую химию. Понятие о нормативной документации в фармации.
- •Знакомство с правилами безопасной работы в химической лаборатории.
- •Вопросы для обсуждения на семинаре.
- •3. Лабораторная работа Сравнительный анализ фс фармакопей различных стран
- •Лабораторно-практическое занятие № 2 Общие реакции подлинности лекарственных средств различных химических классов
- •1. Вопросы для обсуждения на семинаре.
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Общие фармакопейные реакции подлинности
- •Лабораторно-практическое занятие № 3 Оценка качества лекарственных средств по показателю «чистота». Часть 1.
- •Оценка чистоты лекарственных средств: определение допустимых и недопустимых примесей
- •Лабораторно-практическое занятие № 4 Оценка качества лекарственных средств по показателю «чистота». Часть 2.
- •1. Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи
- •3. Лабораторная работа – 45 мин Оценка качества лекарственных средств по показателю «чистота»
- •Растворимость левомицетина
- •4. Защита лабораторной работы – 30 мин
- •Лабораторно-практическое занятие № 5 Оценка качества лекарственных средств по показателю «количественное определение»
- •Вопросы для обсуждения на семинаре:
- •Решить ситуационные задачи Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •2. Образцы тестовых вопросов:
- •3. Лабораторная работа – 45 мин Количественное определение действующего вещества в лекарственной субстанции титриметрическим методом
- •Лабораторно-практическое занятие № 6 Контрольная работа №1 «Общие вопросы фармацевтической химии»
- •Защита контрольной работы – 90 мин.
- •Лабораторно-практическая работа № 7 Фармацевтический анализ лекарственных средств p-элементов VII группы периодической системы элементов
- •Препараты галогенов
- •Абсорбционный комплекс синего цвета
- •Препараты галогенидов
- •1. Реакции на натрий.
- •Светло-желтый
- •2. Реакции на калий
- •Светло-желтый
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов VII группы псэ
- •Лабораторно-практическая работа № 8 Фармацевтический анализ лекарственных средств р-элементов
- •VI группы периодической системы элементов
- •Тиосульфат натрия/Natrii thiosulfas
- •1. Семинар - 90 мин
- •Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств р-элементов VI группы
- •Лабораторно-практическое занятие № 9 Фармацевтический анализ лекарственных средств p-элементов V группы периодической системы элементов
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементами V группы периодической системы элементов
- •Лабораторно-практическое занятие № 10 Фармацевтический анализ лекарственных средств р-элементов III-IV групп периодической системы элементов
- •(Бура/ Borax)
- •Семинар - 90 мин
- •Контрольный тест - 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс р-элементов III-IV групп
- •Лабораторно-практическое занятие № 11 Контрольная работа № 2 Фармацевтический анализ лекарственных средств p-элементов VII, VI, V, IV, III групп периодической системы элементов
- •1. Контрольный тест - 45 мин
- •2. Подготовка ответа на вопросы билета – 45 мин
- •Решите задачи:
- •3. Защита контрольных работ – 90 мин.
- •Лабораторно - практическое занятие №12 Фармацевтический анализ лекарственных средств s-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе магния
- •Лекарственные средства на основе кальция
- •Лекарственные средства на основе бария
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс s-элементов I-II групп псэ
- •Лабораторно-практическое занятие № 13 Фармацевтический анализ лекарственных средств d-элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе серебра
- •Коллоидные препараты серебра
- •Лекарственные средства на основе цинка
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d- элементов I-II групп периодической системы элементов
- •Лекарственные средства на основе железа
- •Лекарственные средства на основе платины
- •Радиофармацевтические препараты
- •Гомеопатические лекарственные средства
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •3. Лабораторная работа – 45 мин Фармацевтический анализ лс d-элементов VIII группы псэ
- •Лабораторно-практическое занятие № 16 Фармацевтический анализ лекарственных средств – галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Лекарственные средства – галогенопроизводные ациклических алканов
- •Лекарственные средства на основе спиртов
- •Лекарственные средства на основе эфиров
- •1. Семинар - 90 мин
- •2. Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лекарственных средств на основе спиртов
- •Лабораторно-практическое занятие № 17 Фармацевтический анализ лекарственных средств альдегидов и углеводов
- •Лекарственные средства альдегидов
- •Лекарственные средства на основе углеводов
- •1. Семинар - 90 мин
- •2.Контрольный тест – 15 мин
- •Лабораторная работа – 45 мин Фармацевтический анализ лс альдегидов и углеводов
- •Лабораторно-практическое занятие № 18 Итоговое занятие
- •Приложение 1 Правила безопасной работы в лаборатории
- •Частные фармакопейные статьи к лабораторно-практическому занятию№1
- •Приложение 2 Общие фармакопейные статьи (Государственная фармакопея XI) определение температуры плавления
- •Определение температурных пределов перегонки
- •Определение плотности
- •Растворимость
- •Определение показателя преломления (рефрактометрия)
- •Определение оптического вращения (поляриметрия)
- •Определения, основанные на измерении поглощения электромагнитного излучения
- •Спектрофотометрия
- •Спектрофотометрия в ультрафиолетовой и видимой областях
- •Определение степени белизны порошкообразных лекарственных средств
- •Определение рН
- •Определение окраски жидкостей
- •Определение прозрачности и степени мутности жидкостей
- •Приложение 3 Оценка качества лс по показателю «чистота», «количественное определение».
- •В лекарственных препаратах
- •Приложение 4 Частные фармакопейные статьи для лс р-элементов VII группы псэ (ер, перевод с английского)
- •Калия бромид (Kalii Bromidum)
- •Калия йодид (Kalii iodidum)
- •Натрия бромид ( Natrii Bromidum)
- •Натрия йодид ( Natrii iodidum)
- •Натрия фторид (Natrii fluoridum)
- •Натрия хлорид (Natrii chloridum)
- •Вода очищенная в резервуарах
- •Вода для инъекций (Aqua pro injectionibus)
- •Стерильная вода для инъекций
- •Раствор водорода пероксида (3%) (Solutio Hydrogenii peroxydi 3%)
- •Магния пероксид (Magnesii peroxydum)
- •Натрия тиосульфат (Natrii thiosulfas)
- •Натрия тетраборат (Natrii tetraboras) (Бура Borax)
- •Алюминия гидроксид (Aluminii hydroxidum)
- •Алюминия фосфат (Aluminii рhosphaS)
- •Натрия гидрокарбонат (Natrii hydrocarbonas)
- •Лития карбонат (Lithii carbonas)
- •Кальция хлорид (Сalcii chloridum)
- •Бария сульфат для рентгеноскопии (barii sulfas pro roentgeno)
- •Магния сульфат (Magnesii sulfas)
- •Магния оксид (Magnesii oxidum)
- •Серебра нитрат (Argenti nitras)
- •Цинка оксид (Zinci oxydum)
- •Цинка сульфат (Zinci sulfas)
- •Железа глюконат
- •Железа фумарат
- •Цисплатин (Cisplatinum)
- •Йодированный [I 125] альбумин для инъекций, меченный.
- •Натрия йодида [i131] раствор
- •Приложение 12 Частные фармакопейные статьи для лс галогенпроизводных углеводородов, спиртов, простых и сложных эфиров
- •Приложение 13 Частные фармакопейные статьи для лс альдегидов и углеводов
Препараты галогенидов
Кислота хлороводородная /Acidum hydrochloricum dilutum
Содержание HCl 24,8% до 25,2%. Плотность 1,122-1,124г/см3. В фармакопейном анализе применяется в качестве реактива.
Кислота хлороводородная разведенная/Acidum hydrochloricum dilutum
HCl Mr 36.46
Содержание HCl 8,2%-8,4%. Плотность 1,038-1,039 г/см3.
Состав:
кислота хлороводородная –1 часть
вода - 2 части
Ранее применялась внутрь в каплях и микстурах при недостаточной кислотности желудочного сока. В мировых фармакопеях как ЛС не представлена. Иногда используют совместно с препаратами железа, так как HCl способствует улучшению его всасывания. Высшая разовая доза 40 капель, суточная –120 капель.
Определение подлинности
1. Реакция на хлориды
HCl + AgNO3 HNO3 AgCl¯ + HNO3
Белый осадок AgCl нерастворим в азотной кислоте, но растворим в растворе аммиака:
AgCl¯ + 2NH3.H2O ® [Ag(NH3)2]Cl + 2H2O
2. Сильная кислота (рН ≤ 4,0)
3. Выдерживает тест на количественное определение
Оценка чистоты
Хлор. К 60 мл ЛС, добавляем 50 мл воды, 1 мл 10% раствора KI, 0,5 мл крахмала. Раствор оставляют на 2 мин., любое появившиеся синее окрашивание должно исчезнуть при добавлении натрия тиосульфата (1 ppm).
Определяют примеси сульфатов (5 ppm), тяжелых металлов (2 ppm Pb), потерю в весе при высушивании (максимум 0.01 %).
Количественное определение.
К 6,00 г ЛС добавляют 30 мл воды. Титруют 1 М раствором натрия гидроксида. Индикатор - метиловый красный:
HCl + NaOH ® NaCl + H2O
1 мл 1 моль/л раствора NaOH соответствует 36,46 мг HCl.
Фармацевтический анализ ЛС калия и натрия хлоридов рассмотрим на примере натрия хлорида.
Натрия хлорид / Natrii chloridum
NaCl
Mr 58.44
Определение подлинности
1. Реакции на натрий.
А. К 2 мл прибавляют 2 мл 15 % раствора калия карбоната и нагревают до кипения; осадок не образуется. К раствору прибавляют 4 мл раствора калия пироантимоната и нагревают до кипения. Охлаждают в ледяной воде и при необходимости потирают внутренние стенки пробирки стеклянной палочкой; образуется плотный осадок белого цвета.
Na+ + [Sb(OH)6]- ® Na[Sb(OH)6]¯
Б. Соль натрия, смоченная хлористоводородной кислотой 25 % и внесенная в бесцветное пламя, окрашивает его в желтый цвет.
2. Реакция на хлориды (см. выше раздел по хлороводородной кислоте).
Оценка чистоты
Раствор С. Растворите 20 г препарата в воде без углекислоты, приготовленной из дистиллированной воды и разбавьте до 100 мл тем же растворителем.
Прозрачность раствора. Раствор должен быть прозрачным и бесцветным.
Кислотность или щелочность. К 20 мл раствора С добавьте 0,1 мл раствора бромтимолового синего. Не более чем 0,5 мл 0,01М кислоты хлороводородной или 0,01М натрия гидроксида требуется для того, чтобы изменить цвет индикатора.
Бромиды. К 1 мл раствора С добавьте 4 мл воды, 2 мл раствора фенолового красного и 1 мл 0,1 г/л раствора хлорамина и перемешайте. Через 2 минуты добавьте 0,15 мл 0,1М натрия тиосульфата, смешайте и разбавьте до 10 мл водой. Абсорбция раствора, измеренная при 590 нм (раствор сравнения – вода), не должна превышать абсорбцию стандартного раствора калия бромида 50 мкг/мл (50 ррm).
Ферроцианиды. Растворите 2 г препарата в 6 мл воды. Добавьте 0,5 мл смеси из 5 мл 10 г/л раствора железо-аммоний-сульфат, 2,5 г/л раствора серной кислоты и 95 мл 10 г/л раствора сульфата железа. Не должно появляться голубого окрашивания в течение 10 минут.
Йодиды. 5 мл раствора С по каплям добавьте в свежеприготовленную смесь из 0,15 мл раствора натрия нитрита, 2 мл 0,5М серной кислоты, 25 мл раствора крахмала и 25 мл воды. 5 минут держите при дневном свете. Раствор не должен быть голубым.
Нитриты. К 10 мл раствора С добавьте 10 мл воды. Измерьте абсорбцию раствора при 354 нм. Абсорбция должна быть не более, чем 0,01.
Фосфаты. Разбавьте 2 мл раствора С до 100 мл водой. Содержание фосфатов не должно превышать 25 ррm.
Сульфаты. 7,5 мл раствора С разбавьте до 30 мл дистиллированной водой. Содержание сульфат-ионов не должно превышать 0,2 ррm.
Алюминий. Растворите 2 г препарата в 100 мл воды и добавьте 10 мл ацетатного буфера (рН 6,0). Содержание алюминия не должно превышать 0,2 ррm.
Мышьяк. 5 мл раствора С сравнить с эталоном на мышьяк. Содержание мышьяка не должно превышать 1 ррm.
Барий. К 5 мл раствора С добавьте 5 мл дистиллированной воды и 2 мл разведенной серной кислоты. После 2 часов опалесценция в растворе не должна быть интенсивнее, чем в смеси из 5 мл раствора С и 7 мл дистиллированной воды.
Тяжелые металлы. 12 мл раствора С сравните с эталоном на тяжелые металлы. Содержание тяжелых металлов не должно превышать 5 ррm. Приготовьте стандарт, используя стандартный раствор свинца – 1 ррm свинца.
Железо. 10 мл раствора С сравните с эталоном на железо. Содержание железа не должно превышать 2 ррm. Приготовьте стандарт, используя смесь из 4 мл стандартного раствора железа (1 ррm железа) и 6 мл воды.
Магний и щелочноземельные металлы (не более 100 ррm в пересчёте на кальций). 10 мл раствора сравните с эталоном на магний и щелочноземельные металлы. Необходимый объем 0,01М эдетата натрия не должен превышать 2,5 мл.
Калий. Растворы для гемодиализа должны содержать не более 500 ррm калия, определенного атомно-эмиссионной спектрометрией.
Потеря в массе при высушивании. Не более, чем 0,5%, при высушении 1 г при 1000 – 1050 С в течение 2 часов.
Бактериальные эндотоксины. Растворы для парентерального использования должны содержать не более 5 I.U.эндотоксина на грамм.
Количественное определение.
Растворите 50,0 мг вещества в 50 мл воды и титруйте 0,1 моль/л раствором серебра нитрата. Точку эквивалентности определяется потенциометрически.
1мл 0,1моль/л раствора серебра нитрата соответствует 5,844 мг натрия хлорида.
NaCI + AgNO3 ® AgCI¯ + NaNO3
Лекарственного вещества в субстанции должно быть не менее 99,0% и не более 100,5%, в пересчёте на абсолютно сухое вещество.
Фармацевтический анализ ЛС калия и натрия бромидов рассмотрим на примере калия бромида.
Калия бромид / Kalii bromidum
KBr Мr 119.0
Определение подлинности
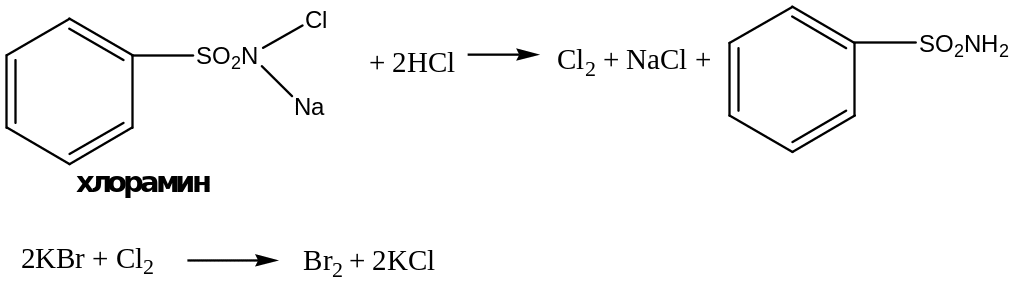 1.
Реакции на бромиды.
1.
Реакции на бромиды.
А. К 1 мл раствора бромида (2–30 мг бромид-иона) прибавляют 1 мл хлористоводородной кислоты разведенной 8,3 %, 0,5 мл 5 % раствора хлорамина, 1 мл хлороформа и взбалтывают; хлороформный слой окрашивается в желто-бурый цвет.
Б. К 2 мл раствора бромида (2–10 мг бромид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл 2 % раствора серебра нитрата; образуется желтоватый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и трудно растворимый в 10 % растворе аммиака
KBr + AgNO3 ® AgBr ¯ + KNO3
