
- •8.2. Водный дефицит
- •8.2.1. Понижение водного потенциала растительных клеток как стратегия избежания обезвоживания
- •8.2.2. Осмолиты
- •8.2.2.1. Свойства и функции осмолитов
- •8.2.2.2. Биосинтез некоторых наиболее распространенных осмолитов
- •8.2.3. Белки, образующиеся в клетках растений при дегидратации
- •8.2.3.2. Шапероны и ингибиторы протеаз
- •8.2.3.3. Протеазы и убиквитины
- •8.2.3.4. Аквапорины
- •8.2.4. Защитные и регуляторные функции белков, индуцируемых водным дефицитом
- •8.2.5. Регуляция экспрессии генов, индуцируемых водным дефицитом Рецепция сигнала
8.2.3. Белки, образующиеся в клетках растений при дегидратации
В формирование механизмов устойчивости растений к водному дефициту вовлечены белки, выполняющие различные функции. Многие из них синтезируются de novo как ответная реакция растения на дегидратацию.
8.2.3.1. Lea-белки
Часть индуцируемых водным дефицитом белков защищает цитоплазматические биополимеры и формируемые ими клеточные структуры от повреждений, вызываемых дегидратацией (рис. 8.9). К ним относятся Lea (late embryogenesis abundant)-белки, которые сначала были идентифицированы как продукты генов LEA, экспрессирующихся в семенах в фазе их созревания и высушивания. Позже некоторые Lea-белки были обнаружены в вегетативных тканях растений в период потери ими воды при водном, солевом и низкотемпературном стрессах.
Lea-белки в подавляющем большинстве гидрофильны, что согласуется с их цитоплазматической локализацией. Многие из них обогащены аланином и глицином и лишены цистеина и триптофана. Lea-белки в соответствии с их аминокислотными последовательностями и структурой объединяют в пять групп (1 — 5). Существуют предположения о специфических функциях белков каждой группы. Lea-белки группы 1 характеризуются высоким содержанием заряженных аминокислот и глицина, что позволяет им эффективно связывать воду. Наличие Lea-белков этой группы в цитоплазме придает ей высокую водоудерживающую способность.
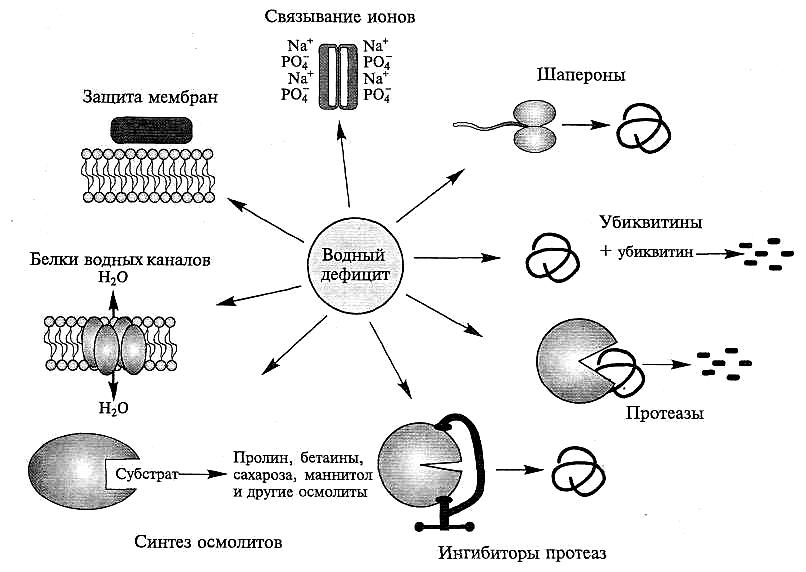
Рис. 8.9. Протекторные функции белков, индуцируемых водным дефицитом
(Е.Вгау, 1993).
Образующиеся белки поддерживают метаболизм и физиологические процессы в период потери клеткой воды и последующего восстановления оводненности в ходе осморегуляторного процесса
Предполагается, что Lea-белки группы 2 выполняют функции шаперонов. Образуя комплексы с другими белками, они предохраняют последние от повреждений в условиях дегидратации клетки. Некоторые Lea-белки (группы 3 и 5) участвуют в связывании ионов, которые концентрируются в цитоплазме при потере клетками воды. Наличие гидрофобной области у этих белков приводит к формированию гомодимера с гидрофобными последовательностями, обращенными друг к другу, тогда как заряженные области на наружных поверхностях белка участвуют в связывании ионов. Lea-белки группы 4 могут замещать воду в примембранной области и этим поддерживать структуру мембран при дегидратации. Lea белки играют важную роль в устойчивости растений к водному дефициту. На ряде видов растений показана корреляция между выживаемостью при водном дефиците и накоплением в их клетках Lea-белков. Например, сверхэкспрессия генов, кодирующих Lea-белки в трансформантах риса (Oryza sativa), коррелировала с высокой устойчивостью растений к водному дефициту.
8.2.3.2. Шапероны и ингибиторы протеаз
Шаперонами называют белки, которые связывают полипептиды во время их сворачивания (folding), т.е. при формирования третичной структуры, и сборки белковой молекулы из субъединиц, т. е. при формировании четвертичной структуры. Взаимодействуя с полипептидами, шапероны предотвращают ошибки в сворачивании и сборке и этим препятствуют аггрегации полипептидных цепей. Некоторые шапероны играют роль «ремонтных станций», исправляющих неверное сворачивание. Одна из главных функций шаперонов — сворачивание и разворачивание (unfolding), а также сборка и разборка белков при их транспорте через мембраны. Полипептидная цепь может пройти через пору в мембране лишь в развернутом виде. Некоторые содержащиеся в цитозоле шапероны взаимодействуют с вновь синтезированными полипептидными цепями и поддерживают их линейную структуру, так что полипептидные цепи могут сразу транспортироваться в нужный компартмент клетки. Другие шапероны связываются с аминокислотами полипептидной цепи, как только она покажется на другой стороне мембраны, и осуществляют сворачивание. При дегидратации клеток тенденция к повреждениям и денатурации белков усиливается, поэтому защитная роль шаперонов в этих условиях возрастает. Стрессовые условия активируют биосинтез шаперонов в клетках (см. рис. 8.9).
При осмотическом стрессе происходит также индукция биосинтеза ингибиторов протеаз, препятствующих протеолитическому расщеплению белков, которые при дегидратации клетки сохраняют свою структуру и функциональные свойства (см. рис. 8.9).
