
- •Понятия «химический процесс», «химический реактор». Требования, предъявляемые к химическим реакторам.
- •Технологические критерии оценки эффективности протекания процесса в химическом реакторе: степень превращения реагента, выход продукта, связь между ними.
- •Уровень химического процесса и уровень химического реактора в иерархической структуре химического производства.
- •Химический процесс на молекулярном и макроуровне, учёт взаимного влияния химической реакции и процессов переноса импульса, массы и теплоты. Кинетическая и диффузионная области процесса.
- •Общая характеристика гомогенных процессов. Аппаратурное оформление гомогенных некаталитических процессов.
- •Гомогенные некаталитические процессы: термодинамические закономерности влияния температуры на степень превращения реагента (выход продукта).
- •Гомогенные некаталитические процессы: термодинамические закономерности влияния давления на степень превращения реагента (выход продукта).
- •Гомогенные некаталитические процессы: термодинамические закономерности влияния концентраций реагентов, продуктов и инертных примесей на равновесие реакций.
- •Кинетические закономерности гетерогенных некаталитических процессов. Пути интенсификации гетерогенных процессов.
- •Гетерогенные некаталитические процессы в системе «газ-твердое тело»: модель с фронтальным перемещением зоны реакции, ее характеристика.
- •Гетерогенные некаталитические процессы в системе «газ-твердое тело»: вывод уравнения скорости процесса, его анализ.
- •Гетерогенные некаталитические процессы «газ-твердое тело»: закономерности, области протекания, пути интенсификации, их теоретическое обоснование.
- •Гетерогенные некаталитические процессы в системе «газ-твердое тело»: лимитирующая стадия, способы ее определения.
- •Аппаратурное оформление гетерогенных некаталитических процессов в системе «газ - твердое тело».
- •Аппаратурное оформление гетерогенных некаталитических процессов в системе «жидкость - твердое тело».
- •Гетерогенные некаталитические процессы в системе «газ-жидкость»: пленочная модель, ее характеристика.
- •Гетерогенные некаталитические процессы «газ-жидкость»: кинетические закономерности, теоретическое обоснование путей интенсификации.
- •Аппаратурное оформление гетерогенных некаталитических процессов в системе «газ-жидкость».
- •Аппаратурное оформление гетерогенных некаталитических процессов в системе «жидкость - жидкость».
- •Промышленный катализ: сущность, механизм, назначение.
- •Виды катализа, классификация механизмов катализа.
- •Стадии гетерогенно-каталитического процесса на твердом катализаторе.
- •Технологические характеристики твердых катализаторов.
- •Отравление и регенерация катализаторов. Регенератор катализатора «крекинг-флюид» процесса.
- •Состав и способы изготовления контактных масс.
- •Аппаратурное оформление гетерогенных каталитических процессов.
- •Классификация химических реакторов.
- •Моделирование химических реакторов: понятие об элементарном объеме и элементарном промежутке времени, уравнение материального баланса химического реактора (в общем виде) и его анализ.
- •Общая характеристика идеальных моделей химических реакторов (допущения об идеальности, характер изменения параметров в зависимости от объема реактора и от времени).
- •Модель реактора идеального смешения периодического действия (рис-п), работающего в изотермическом режиме. Вывод характеристического уравнения.
- •Модель реактора идеального смешения непрерывного действия (рис-н), работающего в изотермическом режиме. Вывод характеристического уравнения.
- •Модель реактора идеального вытеснения (рив), работающего в изотермическом режиме. Вывод характеристического уравнения.
- •Модель каскада проточных реакторов идеального смешения (рис-к), работающего в изотермическом режиме.
- •Сравнение эффективности работы изотермических химических реакторов, описываемых различными моделями, по селективности протекания целевой реакции.
- •Сравнение эффективности работы изотермических химических реакторов, описываемых различными моделями, по выходу продукта.
- •Уравнение теплового баланса химического реактора в общем виде, его анализ. Тепловые режимы работы реакторов.
- •Модель реактора идеального смешения непрерывного действия (рис-н), работающего адиабатическом режиме.
- •Графическое решение модели реактора рис-н, работающего адиабатическом режиме, для необратимых эндо- и экзотермических реакций.
- •Графическое решение модели реактора рис-н, работающего адиабатическом режиме, для обратимых эндо- и экзотермических реакций.
- •Реализация оптимальных температурных режимов в каскаде рив при проведении обратимых экзотермических реакций.
- •Реализация оптимального температурного режима в каскадах рис, рив при проведении обратимых эндотермических реакций.
- •Реализация оптимального температурного режима в каскадах рис, рив при проведении эндотермических реакций.
- •Сопоставление конструкции аксиальных и радиальных реакторов установок каталитического риформинга.
- •Устройство аксиальных реакторов гидрогенизационных процессов.
- •Устройство реакторов «крекинг-флюид» процесса.
- •Устройство реакторов производства алкилата.
- •Устройство реакторов коксования нефтяных остатков.
Аппаратурное оформление гетерогенных некаталитических процессов в системе «газ-жидкость».
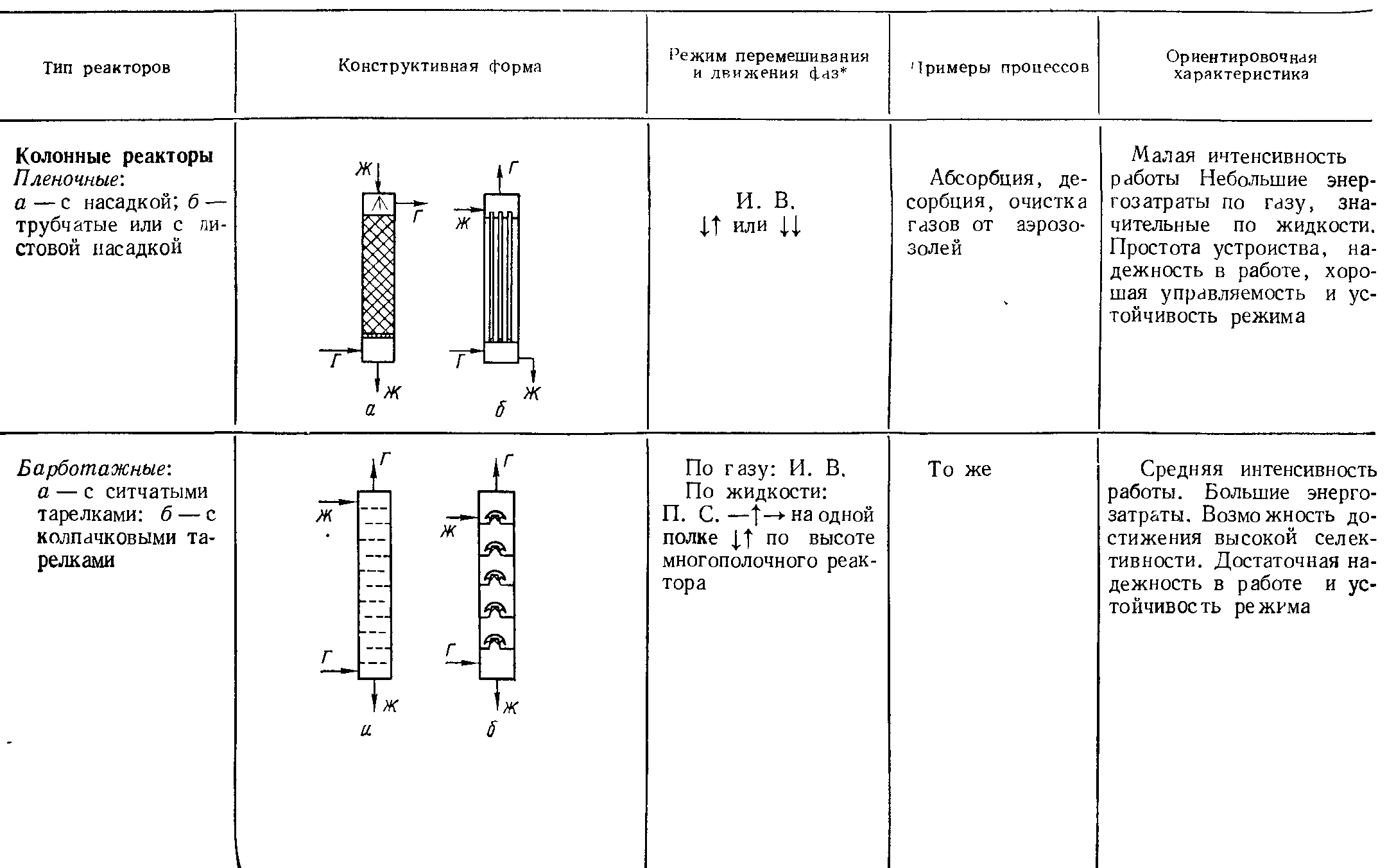
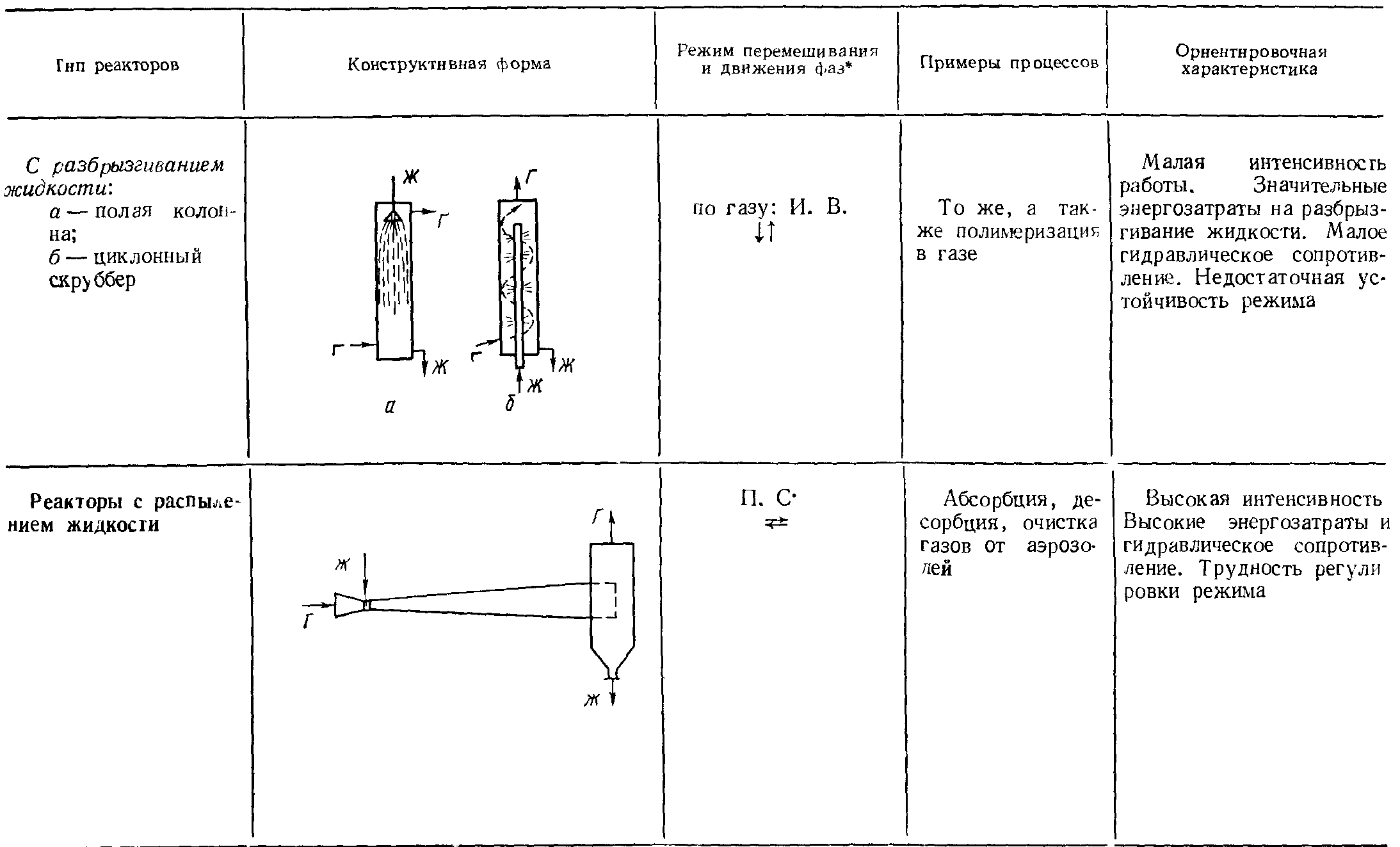
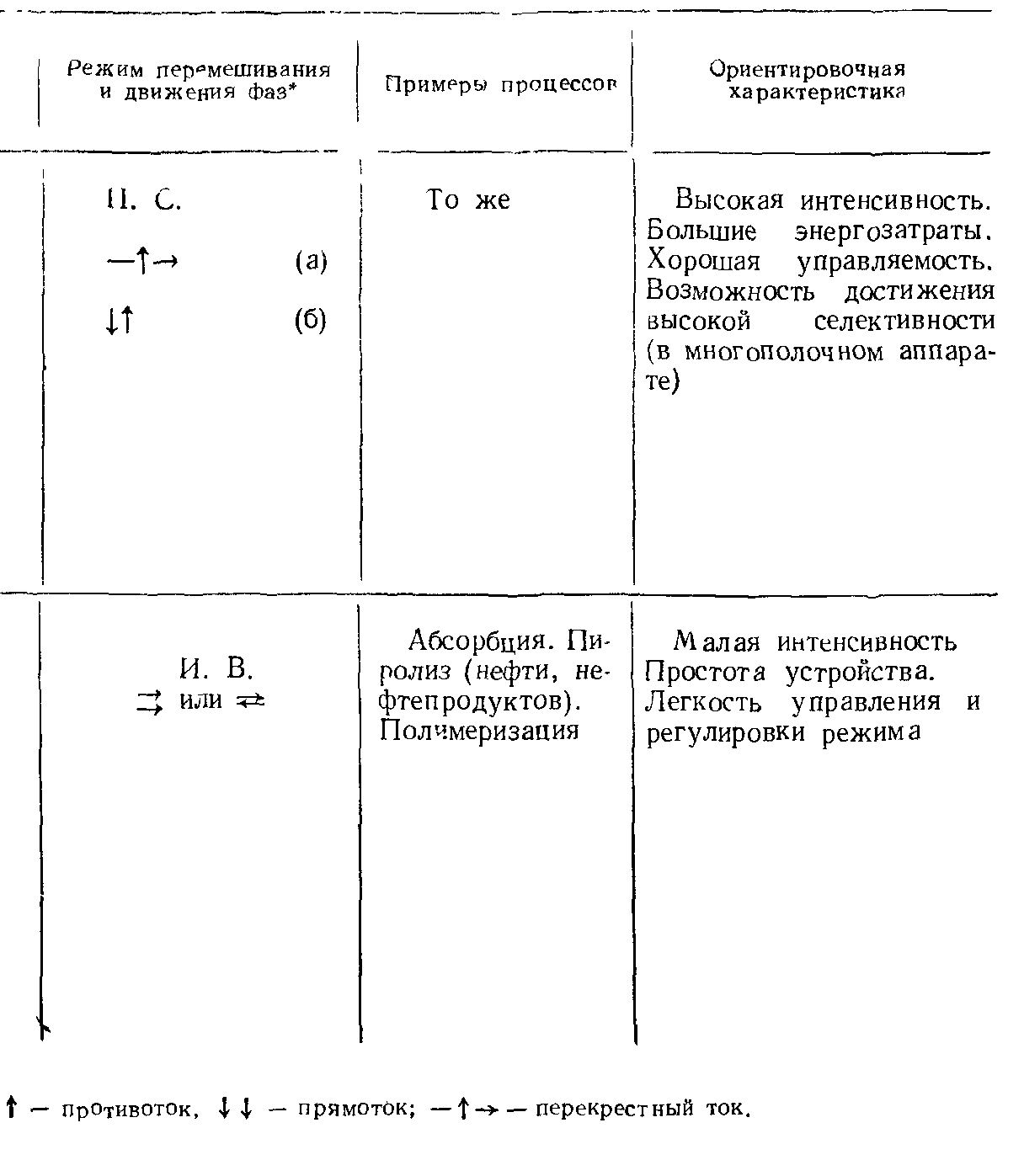
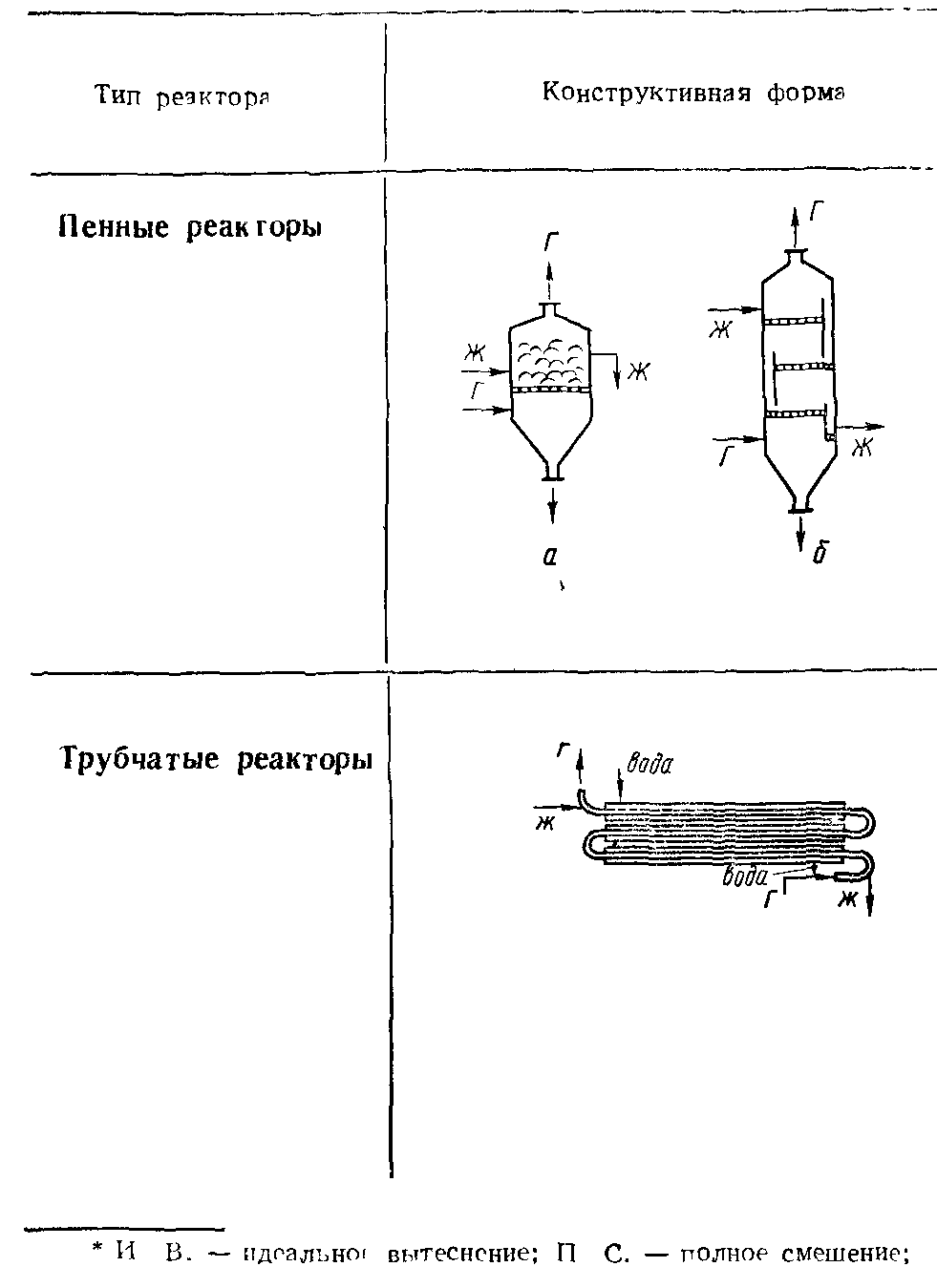
Аппаратурное оформление гетерогенных некаталитических процессов в системе «жидкость - жидкость».
Гетерогенные реакции могут протекать в системе, состоящей из двух или более несмешивающихся или частично смешивающихся жидкостей. Скорость процесса зависит от скорости диффузии компонентов по направлению к поверхности раздела фаз. Поэтому хорошее перемешивание может значительно уменьшить сопротивление диффузии и одновременно увеличить поверхность контакта (межфазную поверхность) несмешивающихся фаз.
Реакторы, используемые для проведения этих процессов, должны быть просты по конструкции и, кроме того, удовлетворять следующим требованиям:
иметь поверхность, достаточную для быстрого удаления тепла реакции в случае, когда скорость реакции становится очень большой.
обеспечивать наибольшую поверхность контакта между органическим веществом и агентом.
оказывать сопротивление коррозийному воздействию реагентов и продуктов реакции.
иметь автоматическую систему питания по крайней мере одного из реагентов, чтобы температура, при которой проводится процесс, не превышала допускаемого максимума.
Реакторы могут работать периодически, полунепрерывно и непрерывно. Такие реакторы почти всегда снабжены перемешивающим устройством. Поэтому для обеспечения заданной степени превращения при минимальном объеме перемешивания и непрерывном режиме работы используют систему последовательно соединенных в ряд реакторов (каскад, батарея).
Промышленный катализ: сущность, механизм, назначение.
Катализ – наиболее эффективное и рациональное средство ускорения химических реакций. Каталитические процессы применяются в промышленности в большом масштабе, причем область их применения прогрессивно растет. Подавляющее большинство новых производств, освоенных за последние годы химической промышленностью, включают каталитические процессы. Каталитические реакции подчиняются общим законам химии и термодинамики, но действие катализаторов значительно облегчает практическое осуществление ряда химических реакций. В присутствии катализаторов эти реакции ускоряются в тысячи и миллионы раз, протекают при более низких температурах, что экономически выгодно. Ряд промышленных процессов удалось осуществить только благодаря применению катализаторов.
При внесении катализаторов энергетический уровень реагирующих молекул не меняется. Действие катализатора не смещает равновесие реакции, а лишь ускоряет достижение равновесия при данной температуре. В присутствии катализатора в равной мере увеличиваются константы скорости прямой и обратной реакций и поэтому положение равновесия не меняется. Поскольку катализатор не влияет на равновесие, то катализ является мягким приемом интенсификации химических реакций, не имеющим ограничений, характерных, например, для применения высоких температур.
Сущность ускоряющего действия катализаторов состоит в понижении энергии активации химической реакции в результате изменения реакционного пути с участием катализатора или вследствие осуществления реакции по цепному механизму при инициирующем действии катализатора.
В первом случае реакция протекает через ряд элементарных стадий, которые требуют в совокупности меньшей энергии активации, чем прямая реакция без катализатора.
С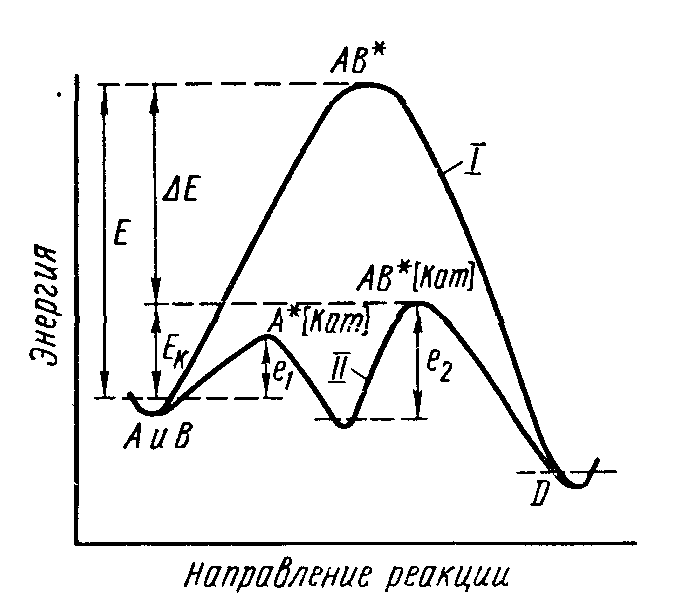 нижение
энергии активации не является единственной
причиной резкого повышения скорости
каталитических реакций по сравнению с
некаталитическими. Таким образом, при
открытии нового реакционного пути
катализатор является активным участником
процесса, причем это участие выражается
в образовании с реагирующими веществами
неустойчивых промежуточных соединений
- активных комплексов, после распада
которых катализатор регенерируется.
Вследствие регенерации катализатора
после каждого цикла промежуточных
взаимодействий он остается теоретически
неизменным.
нижение
энергии активации не является единственной
причиной резкого повышения скорости
каталитических реакций по сравнению с
некаталитическими. Таким образом, при
открытии нового реакционного пути
катализатор является активным участником
процесса, причем это участие выражается
в образовании с реагирующими веществами
неустойчивых промежуточных соединений
- активных комплексов, после распада
которых катализатор регенерируется.
Вследствие регенерации катализатора
после каждого цикла промежуточных
взаимодействий он остается теоретически
неизменным.
