
- •Понятия «химический процесс», «химический реактор». Требования, предъявляемые к химическим реакторам.
- •Технологические критерии оценки эффективности протекания процесса в химическом реакторе: степень превращения реагента, выход продукта, связь между ними.
- •Уровень химического процесса и уровень химического реактора в иерархической структуре химического производства.
- •Химический процесс на молекулярном и макроуровне, учёт взаимного влияния химической реакции и процессов переноса импульса, массы и теплоты. Кинетическая и диффузионная области процесса.
- •Общая характеристика гомогенных процессов. Аппаратурное оформление гомогенных некаталитических процессов.
- •Гомогенные некаталитические процессы: термодинамические закономерности влияния температуры на степень превращения реагента (выход продукта).
- •Гомогенные некаталитические процессы: термодинамические закономерности влияния давления на степень превращения реагента (выход продукта).
- •Гомогенные некаталитические процессы: термодинамические закономерности влияния концентраций реагентов, продуктов и инертных примесей на равновесие реакций.
- •Кинетические закономерности гетерогенных некаталитических процессов. Пути интенсификации гетерогенных процессов.
- •Гетерогенные некаталитические процессы в системе «газ-твердое тело»: модель с фронтальным перемещением зоны реакции, ее характеристика.
- •Гетерогенные некаталитические процессы в системе «газ-твердое тело»: вывод уравнения скорости процесса, его анализ.
- •Гетерогенные некаталитические процессы «газ-твердое тело»: закономерности, области протекания, пути интенсификации, их теоретическое обоснование.
- •Гетерогенные некаталитические процессы в системе «газ-твердое тело»: лимитирующая стадия, способы ее определения.
- •Аппаратурное оформление гетерогенных некаталитических процессов в системе «газ - твердое тело».
- •Аппаратурное оформление гетерогенных некаталитических процессов в системе «жидкость - твердое тело».
- •Гетерогенные некаталитические процессы в системе «газ-жидкость»: пленочная модель, ее характеристика.
- •Гетерогенные некаталитические процессы «газ-жидкость»: кинетические закономерности, теоретическое обоснование путей интенсификации.
- •Аппаратурное оформление гетерогенных некаталитических процессов в системе «газ-жидкость».
- •Аппаратурное оформление гетерогенных некаталитических процессов в системе «жидкость - жидкость».
- •Промышленный катализ: сущность, механизм, назначение.
- •Виды катализа, классификация механизмов катализа.
- •Стадии гетерогенно-каталитического процесса на твердом катализаторе.
- •Технологические характеристики твердых катализаторов.
- •Отравление и регенерация катализаторов. Регенератор катализатора «крекинг-флюид» процесса.
- •Состав и способы изготовления контактных масс.
- •Аппаратурное оформление гетерогенных каталитических процессов.
- •Классификация химических реакторов.
- •Моделирование химических реакторов: понятие об элементарном объеме и элементарном промежутке времени, уравнение материального баланса химического реактора (в общем виде) и его анализ.
- •Общая характеристика идеальных моделей химических реакторов (допущения об идеальности, характер изменения параметров в зависимости от объема реактора и от времени).
- •Модель реактора идеального смешения периодического действия (рис-п), работающего в изотермическом режиме. Вывод характеристического уравнения.
- •Модель реактора идеального смешения непрерывного действия (рис-н), работающего в изотермическом режиме. Вывод характеристического уравнения.
- •Модель реактора идеального вытеснения (рив), работающего в изотермическом режиме. Вывод характеристического уравнения.
- •Модель каскада проточных реакторов идеального смешения (рис-к), работающего в изотермическом режиме.
- •Сравнение эффективности работы изотермических химических реакторов, описываемых различными моделями, по селективности протекания целевой реакции.
- •Сравнение эффективности работы изотермических химических реакторов, описываемых различными моделями, по выходу продукта.
- •Уравнение теплового баланса химического реактора в общем виде, его анализ. Тепловые режимы работы реакторов.
- •Модель реактора идеального смешения непрерывного действия (рис-н), работающего адиабатическом режиме.
- •Графическое решение модели реактора рис-н, работающего адиабатическом режиме, для необратимых эндо- и экзотермических реакций.
- •Графическое решение модели реактора рис-н, работающего адиабатическом режиме, для обратимых эндо- и экзотермических реакций.
- •Реализация оптимальных температурных режимов в каскаде рив при проведении обратимых экзотермических реакций.
- •Реализация оптимального температурного режима в каскадах рис, рив при проведении обратимых эндотермических реакций.
- •Реализация оптимального температурного режима в каскадах рис, рив при проведении эндотермических реакций.
- •Сопоставление конструкции аксиальных и радиальных реакторов установок каталитического риформинга.
- •Устройство аксиальных реакторов гидрогенизационных процессов.
- •Устройство реакторов «крекинг-флюид» процесса.
- •Устройство реакторов производства алкилата.
- •Устройство реакторов коксования нефтяных остатков.
Гомогенные некаталитические процессы: термодинамические закономерности влияния давления на степень превращения реагента (выход продукта).
Давление влияет на увеличение скорости как прямой, так и обратной реакции пропорционально числу реагирующих молекул. Таким образом, давление влияет через увеличение концентраций реагентов, что практически относится к реакциям, идущим в газовой среде, особенно с уменьшением объема. Давление сдвигает равновесие реакции, если она идет с изменением объема (по принципу Ле Шателье), и ускоряет реакции из-за увеличения плотности и, следовательно, концентрации реагирующих веществ. Если равновесие не лимитируется, то влияние давления зависит от порядка реакции:
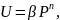
где β – коэффициент, зависящий от константы скорости реакции и концентрации реагирующих веществ; Р – безразмерное давление, т.е. отношение фактического давления к нормальному (атмосферному); n – порядок реакции.
Таким образом, чем выше порядок реакции и чем чище исходная газовая смесь, тем целесообразнее применять давление. Применение давления выгодно и потому, что оно позволяет уменьшить диаметр трубопроводов, размеры аппаратов, но при этом увеличивается толщина их стенок. Давление на скорость реакций в растворах влияет очень мало, но с увеличением давления быстро возрастает вязкость жидкостей, что может привести к переходу реакции из кинетической в диффузионную область. По тому, как сказывается давление на жидкофазные гомогенные реакции, их можно разбить на три группы: 1) мономолекулярные реакции разложения, замедляемые давлением; 2) нормальные бимолекулярные реакции, ускоряемые давлением; 3) медленные бимолекулярные реакции, значительно ускоряемые давлением.
Гомогенные некаталитические процессы: термодинамические закономерности влияния концентраций реагентов, продуктов и инертных примесей на равновесие реакций.
В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево. Увеличивая концентрацию одного из реагентов (создавая его избыток), можно повысить степень превращения другого. Этим широко пользуются в химической технологии, добиваясь полного превращения дорогостоящего компонента сырья.
Введение инертного газа в систему при P = const подобно эффекту уменьшения общего давления. Если реакция протекает с уменьшением числа молей (∆n < 0), разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов. С увеличением числа молей (∆n > 0) равновесие смещается вправо. Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых ∆n < 0, стремятся к уменьшению накопления инертных газов в системе.
Кинетические закономерности гетерогенных некаталитических процессов. Пути интенсификации гетерогенных процессов.
Механизм гетерогенных процессов сложнее, чем механизм гомогенных процессов. Особенностью гетерогенных процессов является то, что прежде чем произойдёт химическая реакция, должен осуществиться перенос реагентов из одной фазы к поверхности раздела фаз или в объём другой фазы. Перенос вещества происходит в результате диффузии, абсорбции, адсорбции, испарения и т.п. Гетерогенные процессы протекают на поверхности соприкосновения реагирующих фаз.
При анализе гетерогенных процессов выделяют два случая. В первом случае скорость химической реакции больше скорости диффузии, следовательно, диффузия будет лимитирующей стадией, и процесс протекает в диффузионной области. Во втором случае скорость химической реакции мала по сравнению со скоростью диффузионных процессов, и лимитирующей стадией будет химическая реакция. Такие гетерогенные процессы протекают в кинетической области.
Итак, гетерогенные процессы протекают в несколько стадий. Скорости отдельных стадий могут существенно различаться и по-разному зависеть от изменения параметров технологического режима. Например, температура неодинаково влияет на скорости химической реакции и диффузии.
П![]() од
скоростью гетерогенного химического
процесса понимают количество одного
из реагентов или продуктов реакции,
которое прореагирует или образуется в
единицу времени на единице поверхности
раздела фаз:
од
скоростью гетерогенного химического
процесса понимают количество одного
из реагентов или продуктов реакции,
которое прореагирует или образуется в
единицу времени на единице поверхности
раздела фаз:
где i – стехиометрический коэффициент i-го реагента или продукта; F – реакционная поверхность.
Уравнение скорости гетерогенного ХТП можно записать и следующим образом:
![]()
где К – коэффициент массопередачи (зависит от химической природы и физических характеристик реагентов, их агрегатного состояния, гидродинамики процессов, конструкции реактора и др.); Fуд – удельная поверхность контакта фаз, приходящаяся на единицу объёма или массы; ΔС – движущая сила процесса (разность концентраций, давлений).
Для увеличения скорости гетерогенных процессов необходимо:
увеличивать поверхность контакта фаз (независимо от области протекания процесса);
увеличивать движущую силу процесса (независимо от области протекания процесса);
увеличивать коэффициент массопередачи.
