
75 Последовательные реакции первого порядка
Последовательными называются такие реакции, которые протекают через ряд последовательных стадий по схеме:
![]() .
.
Здесь каждой буквой обозначается отдельная стадия процесса. Реакции подобного типа широко распространены в природе. В общем случае число ступеней в последовательных реакциях может быть и больше трёх, причём каждая из ступеней может быть не мономолекулярной, а более сложной. К реакциям этого типа относятся, в частности, реакции гидролиза сложных эфиров дикарбоновых кислот, или сложных эфиров гликолей, или дигалогенпроизводных и т.д.
Примером последовательных реакций может служить гидролиз трисахарида рафинозы, который происходит через стадии образования дисахарида, а последний образует уже моносахариды:
1)
![]()
![]()
![]()
2)
![]()
![]()
Расчёт кинетики последовательных реакций можно произвести, если принять, что в начальный момент времени есть только вещество А. Применим к этой системе закон действующих масс и принцип независимости химических реакций:
![]()
с начальными условиями
![]()
![]()
Р
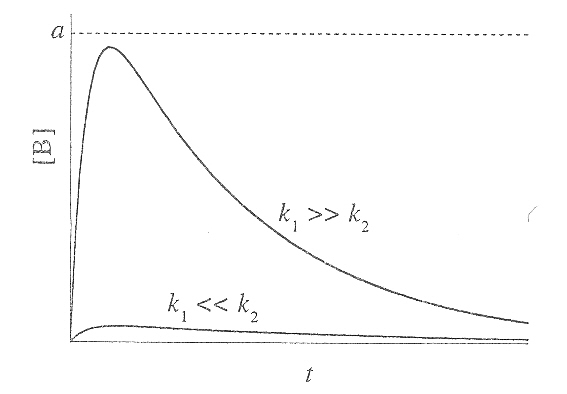
Рис.
15.2. Зависимость концентрации
промежуточного продукта от времени в
системе двух последовательных реакций
при различных соотношениях констант
скорости первой и второй стадии.
веществ:
![]()
Концентрация промежуточного вещества достигает максимума при
![]()
Величина этого максимума
определяется отношением констант
![]() .
Если оно мало, то промежуточный продукт
быстро накапливается и медленно
расходуется. Если же оно велико, т.е.
.
Если оно мало, то промежуточный продукт
быстро накапливается и медленно
расходуется. Если же оно велико, т.е.
![]() ,
то промежуточный продукт не успевает
накапливаться и его концентрация в
любой момент времени мала (рис. 15.2.).
,
то промежуточный продукт не успевает
накапливаться и его концентрация в
любой момент времени мала (рис. 15.2.).
76 Обратимые реакции первого порядка
Обратимыми называются такие реакции, скорость которых равна разности между скоростями прямой и обратной реакции:
![]() .
.
Примером обратимой реакции может служить реакция образования сложного эфира
![]()
В этом случае скорость прямой реакции с течением времени убывает, а скорость обратной реакции возрастает до тех пор, пока обе скорости не выравняются и не наступит так называемое состояние динамического равновесия.
Для обратимых реакций первого порядка:
![]()
Закон действующих масс записывается следующим образом:
![]()
Если начальные
концентрации веществ А и В обозначить,
соответственно, a и b
и ввести степень превращения x
![]() то кинетическое уравнение приобретает
вид:
то кинетическое уравнение приобретает
вид:
![]()
Решение этого уравнения можно выразить через степень превращения, соответствующую достижению равновесия:
![]() или
или
![]()
г
![]() откуда следует:
откуда следует:
![]()
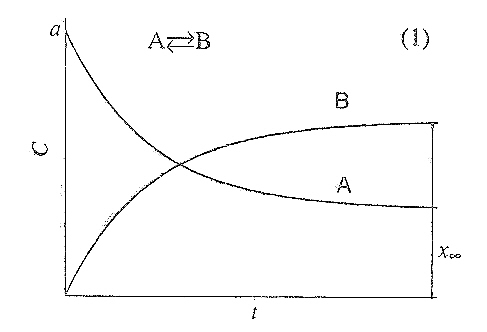
Рис. 15.3. Зависимость
концентраций реагента и продукта от
времени для обратимой реакции первого
порядка.![]() наступает равновесие
наступает равновесие
которое, характеризуется константой:
![]()
Кинетические кривые для обратимых реакций 1-го порядка приведены на рис. 15.3.
