
70 Скорость химической реакции
Скорость химической реакции определяется как изменение концентрации веществ в единицу времени в единице объёма.
П
 ри
этом концентрацию обычно выражают
числом молей вещества на единицу объёма
реакционной смеси (обычно на 1л), время
– в секундах, минутах и т. п. Чтобы
вычислить скорость реакции, необходимо
знать, насколько изменилась концентрация
одного из реагирующих веществ в единицу
времени. Например, за какой-то промежуток
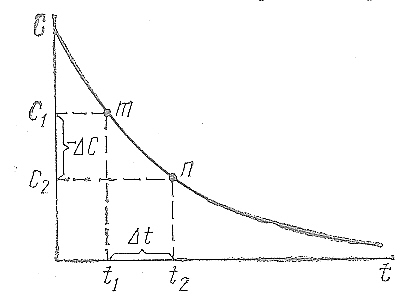
времени ∆t
= t2
– t1
концентрация реагирующих веществ
уменьшается на - ∆С = С1
– С2
(рис. 14.1).
Тогда средняя скорость реакции за
промежуток времени ∆t
ри
этом концентрацию обычно выражают
числом молей вещества на единицу объёма
реакционной смеси (обычно на 1л), время
– в секундах, минутах и т. п. Чтобы
вычислить скорость реакции, необходимо
знать, насколько изменилась концентрация
одного из реагирующих веществ в единицу
времени. Например, за какой-то промежуток
времени ∆t
= t2
– t1
концентрация реагирующих веществ
уменьшается на - ∆С = С1
– С2
(рис. 14.1).
Тогда средняя скорость реакции за
промежуток времени ∆t
vср = - ∆С / ∆t (14.1.)
З
Рис. 14.1. Кинетическая
кривая для реагентов реакции.
Средняя скорость не отражает истинной скорости в каждый момент времени, поэтому математически истинную скорость v реакции в данный момент принято выражать отношением бесконечно малого изменения концентрации dC к бесконечно малому отрезку времени dt, в течение которого произошло изменение концентрации:
v = ± dC / dt (14.2.)
Если изучается изменение концентрации одного из исходных веществ, то dC / dt > 0, если одного из продуктов реакции, то dC / dt > 0. Скорость реакции всегда считается положительной, а отношение в правой части уравнения может быть или положительным, или отрицательным.
Закон действующих масс для скоростей. Константа скорости реакции. Порядок и молекулярность реакций.
Реакции можно поделить на простые – идут в одну стадию и сложные – многостадийные. Рассмотрим простые реакции.
Скорость химической
реакции по закону действия масс
пропорциональна концентрации реагирующего
вещества в данный момент времени. Так,
для реакции типа
![]() скорость
реакции может быть выражена следующим
кинетическим уравнением:
скорость
реакции может быть выражена следующим
кинетическим уравнением:
v = - dCА / dt = kCA, (14.3)
где CА – концентрация вещества А в данный момент; k – коэффициент пропорциональности, который носит название константы скорости химической реакции.
При взаимодействии двух веществ или более, т.е. для реакции типа
а А
+ bВ
сС
А
+ bВ
сС
математическое выражение скорости будет
v = k (CA)γa (CВ) γb (14.4)
Показатель степени (γx) называется порядком реакции по данному реагенту, а сумма ∑γx – общим порядком, или просто порядком реакции.
В простых случаях показатели степени совпадают со стехиометрическими коэффициентами:
γa = а, γb = b и т. д..
Но при сложном механизме реакций эти величины могут различаться. Тем не менее, почти всегда будем предполагать, что порядок реакции по реагенту совпадает с соответствующими стехиометрическими коэффициентами. В таблице 14.1 в общем виде представлены реакции разных порядков и соответствующие уравнения скорости.
Таблица 14.1.
Реакции 1-го порядка |
|
|
Реакции 2-го порядка |
|
|
Реакции 3-го порядка |
|
|
Есть ещё одно близкое понятие – молекулярность реакции: количество одновременно реагирующих молекул. Во многих случаях, как видно из таблицы, молекулярность совпадает с порядком реакции. В реакциях 2-го порядка реагируют две (разные или одинаковые) молекулы, а в реакциях 3-го порядка – три молекулы. Заметим: тримолекулярные реакции очень редки, так как в таких реакциях должно происходить одновременное столкновение трёх молекул, вероятность чего весьма невелика. Понятно, что не бывает четырёхмолекулярных реакций. Если же в уравнении реакции фигурируют 4 или больше молекул реагентов, это означает, что на самом деле здесь – не простая, а сложная реакция, идущая в несколько стадий. И на каждой стадии обычно реагируют не больше двух молекул, т.е. и молекулярность, и порядок равны двум.
Но порядок реакции и её молекулярность иногда не совпадают. Это бывает, когда реагент фигурирует в уравнении реакции, но его концентрация не влияет на скорость реакции. Вот два примера.
Катализируемая реакция:
 А
катализатор
В (14.5)
А
катализатор
В (14.5)
Если вещество А – в избытке, то скорость определяется лишь количеством катализатора, т. е. От концентрации вещества А не зависит:
v = k (14.6)
В данном случае имеет место реакция нулевого порядка, так как ∑γx = 0.
Реакция, где один из реагентов – в большом избытке. Так, например, обстоит дело в реакциях гидролиза:
А + Н2О = Р1 + Р2 (14.7,а)
Формально эту реакцию можно записать и как реакцию второго порядка:
v = k САСН2О (14.7, б)
но концентрация воды – это фактически постоянная величина, которую можно ввести в константу скорости:
v = k’ СА, где k’ = k СН2О (14.7, в,г)
Тогда получается, что данная бимолекулярная реакция имеет первый порядок.
Константа скорости и период полупревращения
Как следует из обобщённого дифференциального уравнения (14.4), скорость реакции зависит не только от концентрации реагентов, но и от фигурирующей в уравнении константы k, называемой константой скорости. Очевидно, что последняя равна скорости при единичных концентрациях реагентов. Значение этой константы для каждой реакции своё и определяется природой реагирующих веществ, механизмом реакции и температурой. Таким образом, константа скорости является важнейшей характеристикой реакции. Размерность k легко определить, исходя из соответствующего дифференциального уравнения (табл. 14.2). Как видно размерность зависит от порядка реакции.
Таблица 14.2.
|
|
|
|
|
|
Кроме
константы скорости, важной кинетической
характеристикой реакции является период
полупревращения,
![]() .
Это такое
время, за которое концентрация какого-либо
из реагентов снижается до среднего
уровня между начальным и конечным
значениями:
.
Это такое
время, за которое концентрация какого-либо
из реагентов снижается до среднего
уровня между начальным и конечным
значениями:
![]() .
(14.8.)
.
(14.8.)
