
- •Перелік умовних скорочень
- •Зв’язок роботи з науковими програмами, планами, темами:
- •Мета дослідження:
- •Завдання дослідження:
- •Практичне значення отриманих результатів:
- •Впровадження результатів досліджень:
- •Особистий внесок пошукача:
- •Апробація результатів роботи:
- •Розділ 1
- •1.1. Етіологічний чинник varicella zoster інфекції
- •1.2. Епідеміологія та контроль за вітряною віспою
- •1.3. Сучасні уявлення про патогенез вітряної віспи
- •1.4. Імунопатогенетичні особливості вітряної віспи
- •1.5. Питання адаптації військовослужбовців
- •1.6. Клінічні прояви вітряної віспи
- •1.7. Сучасна діагностика varicella zoster інфекції
- •1.8. Лікування вітряної віспи у дорослих
- •1.9. Профілактика вітряної віспи
- •Висновки до розділу 1.
- •Розділ 2
- •2.1. Дизайн дослідження та характеристика обстежених хворих
- •2.1.1. Дизайн дослідження, критерії включення / виключення
- •2.1.2. Характеристика обстежених хворих
- •2.2. Характеристика та схеми застосування досліджуваних препаратів
- •2.3. Методи дослідження
- •2.3.1. Клінічна діагностика
- •2.3.2. Лабораторна діагностика
- •Загальний аналіз крові
- •Визначення деяких імунологічних показників
- •Визначення фенотипу лімфоїдних клітин непрямим імунофлуоресцентним методом на проточному цитофлуориметрі
- •Визначення цитокінів методом кількісного імуноферментного аналізу
- •Молекулярно-біологічний метод
- •2.4. Методи статистичного аналізу
- •Висновки до розділу 2.
- •Розділ 3
- •3.1. Епідемічна ситуація з вітряної віспи у Збройних силах України
- •3.2. Клінічні прояви вітряної віспи у військовослужбовців
- •Динаміка захворюваності на вітряну віспу за 5 років
- •Розподіл хворих за ступенем тяжкості перебігу та формою вітряної віспи
- •Динаміка змін загального рівня лейкоцитів та лейкоформули, % (m±m)
- •3.3 Вірусний профіль при вітряній віспі у дорослих хворих
- •3.4. Імунопатогенетичні зміни при вітряній віспі у військовослужбовців
- •3.4.1. Стан клітинної та гуморальної ланки імунної відповіді
- •Динаміка деяких показників гуморальної ланки імунної відповіді (m±m)
- •Динаміка змін показників гуморальної ланки імунної відповіді
- •3.4.2. Стан цитокінової ланки імунітету
- •Показники досліджуваних цитокінів по групам (m±m)
- •Динаміка змін досліджуваних цитокінів по групах
- •3.5. Ускладнення вітряної віспи у дорослих хворих
- •Динаміка виявлення ускладнених форм вітряної віспи за 5 років
- •Взаємозв’язок тривалості висипу та наявності пустулізації*
- •Висновки до розділу 3.
- •Розділ 4
- •4.1. Застосування аміксину у дорослих хворих на вітряну віспу
- •4.1.1 Клінічна ефективність аміксину та особливості вірусного профілю
- •Частота клінічних ознак у хворих на вітряну віспу
- •Динаміка змін лейкограми крові під впливом аміксину (м±m)
- •4.1.2. Імуномодулююча активність аміксину
- •4.1.2.1. Вплив аміксину на основні компоненти клітинного та гуморального імунітету
- •Динаміка імунологічних показників клітинної ланки* при застосуванні аміксину (м±m)
- •Динаміка деяких імунологічних показників гуморальної ланки* при застосуванні аміксину (м±m)
- •4.1.2.2. Вплив аміксину на цитокінову регуляцію імунної відповіді
- •4.1.3. Небажані явища лікування аміксином
- •4.2. Застосування лімфоміозоту з енгістолом у хворих на вітряну віспу
- •4.2.1. Клінічна ефективність лімфоміозоту з енгістолом та особливості вірусного профілю
- •Динаміка змін лейкограми крові
- •4.2.2. Імуномодулююча активність лімфоміозоту та енгістолу
- •4.2.2.1. Вплив лімфоміозоту з енгістолом на основні компоненти клітинного та гуморального імунітету
- •Динаміка деяких імунологічних показників клітинної ланки* при застосуванні антигомотоксичних препаратів (м±m)
- •4.2.2.2. Вплив лімфоміозоту з енгістолом цитокінову регуляцію імунної відповіді
- •Динаміка змін цитокінового профілю, залежно від схеми лікування (м±m)
- •4.2.3. Небажані явища антигомотоксичної терапії
- •Висновки до розділу 4.
- •Розділ 5
- •Нозологічна структура інфекційної захворюваності
- •Аналіз і узагальнення результатів дослідження
- •Висновки
- •Практичні рекомендації
- •Додаток а
- •Додаток б
- •Д одаток в
- •Референтні значення деяких імунологічних показників крові
- •Додаток г
- •Референтні значення деяких цитокінів крові*
- •Додаток д
- •Додаток е Етапи дискримінантного аналізу (скорочено)
- •Список використаних джерел
Динаміка змін лейкограми крові під впливом аміксину (м±m)
Показник |
І група (АМ) |
Контрольна група |
Р |
||
М |
m |
М |
m |
||
До лікування |
|||||
Лейкоцити |
5,4 |
1,3 |
5,7 |
1,5 |
0,269 |
Моноцити, % |
10,7 |
3,5 |
11,3 |
0,4 |
0,356 |
Лімфоцити, % |
23,1 |
9,7 |
22,0 |
1,7 |
0,618 |
Гранулоцити, % |
66,2 |
10,6 |
66,7 |
1,7 |
0,840 |
Після лікування |
|||||
Лейкоцити |
6,1 |
1,1 |
6,1 |
0,9 |
0,921 |
Моноцити, % |
11,1 |
2,7 |
11,7 |
0,3 |
0,024 |
Гранулоцити, % |
60,6 |
7,6 |
58,1 |
7,2 |
0,125 |
Лімфоцити, % |
28,3 |
8,0 |
30,4 |
7,5 |
0,209 |
Примітка. М – середня арифметична, m – похибка середньої арифметикної, Р – достовірність за коефіцієнтами Стьюдента, Фішера (тут і надалі – авт.).
В обох групах зафіксовано зміни лейкограми у вигляді моноцитозу, при чому рівень моноцитів, % (2) в І групі збільшився, однак був значимо меншим у порівнянні з КГ (р=0,024). Щодо інших складових лейкограми достовірних відмінностей зафіксовано не було (р>0,1).
За задумом дослідження у різних біологічних середовищах організму хворих на ВВ за допомогою ПЛР оцінювали наявність ДНК VZV перед початком лікування (кров, слина та рідина везикули) на 2,0±0,2 добу, та його завершенням, тобто в періоді клінічного одужання, переважно в останній день перебування хворого у стаціонарі (кров та слина) в середньому на 9,8±0,2 добу.
До лікування вірусний профіль у хворих І групи характеризувався VZV ДНК-емією у 27 (60%) з 45 хворих, а в слині та вмісті везикул у всіх 45 (100%) хворих. Для порівняння, серед хворих КГ 35 (83,33%) осіб мали VZV ДНК-емію до лікування, різниця відсотків між групами значима (р=0,017). Водночас, показники детекції ДНК VZV в слині та вмісті везикул аналогічні дослідній групі.
П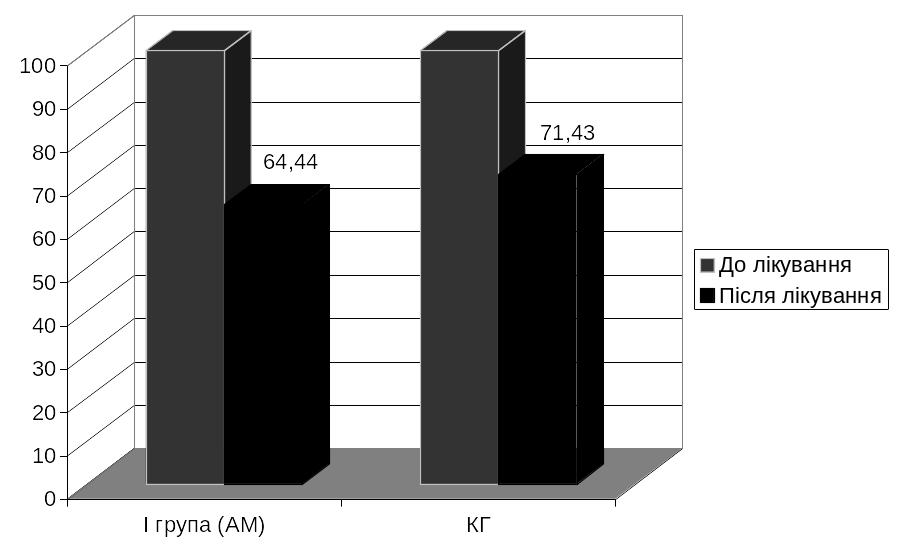 ри
повторному дослідженні на момент виписки
із стаціонару продовження реплікації
вірусу в крові зафіксовано у одного
(2,22%) хворого з дослідної групи. Цікавим
спостереженням при дослідженні слини
у реконвалесцентів, виявилося присутність
ДНК VZV у слині 29 (64,44%) хворих І групи, що
може відігравати певну роль у підтриманні
епідемічного процесу в організованому
військовому колективі (див. рис. 4.1).
ри
повторному дослідженні на момент виписки
із стаціонару продовження реплікації
вірусу в крові зафіксовано у одного
(2,22%) хворого з дослідної групи. Цікавим
спостереженням при дослідженні слини
у реконвалесцентів, виявилося присутність
ДНК VZV у слині 29 (64,44%) хворих І групи, що
може відігравати певну роль у підтриманні
епідемічного процесу в організованому
військовому колективі (див. рис. 4.1).
Рис. 4.1. Частота детекції ДНК VZV в слині у реконвалесцентів, по групах
Аналіз вірусної відповіді при лікуванні АМ показав, що повне звільнення досліджуваних біологічних рідин від ДНК VZV (кров та слина) спостерігалось у 15 (33,33%) хворих, проти 12 (28,57%) хворих з КГ, а різниця відсотків була не достовірна (р>0,1). У 30 (66,67%) хворих І групи відмічено часткову елімінацію збудника ВВ (найчастіше ДНК VZV виявлялась в слині), що збіглося з показником КГ – 30 (71,43%) хворих відповідно, без статистичних відміностей різниці відсотків (р>0,1).
На рис. 4.1 показано, що в результаті застосування аміксину у хворих І групи частота виявлення ДНК VZV у слині була дещо нижчою за показник КГ. З іншого боку, зниження рівню детекції вірусу в слині може свідчити про позитивний вплив застосування АМ у хворих на ВВ, принаймні на прискорення елімінації VZV із слинних залоз.
При аналізі структури ускладнень ВВ у хворих І групи (АМ) виявлено, що 23 (51,11%) хворих мали неускладнений перебіг, а найчастішим ускладненям була бактеріальна інфекція з боку шкіри, яка викликала розвиток пустул у 17 (37,78%) хворих. Подинокий характер носили ускладнення у вигляді синусіту або тонзиліту, та нефриту – по 2 (4,44%) хворих, а у одного (2,22%) хворого розвинулась пневмонія. Порівняння з даними КГ також показало, що у 23 (54,76%) хворих перебіг ВВ характеризувався відсутністю ускладнень, а 15 (35,71%) хворих мали ускладнення з боку шкіри. При цьому, різниця відсотків обох показників достовірно не відрізнялась.
Клінічне спостереження №1.
Хворий Б., 19 років, захворів на гострий гнійний гайморит та фронтит, з приводу якого був госпіталізований до клініки оториноларингології ГВМКЦ «ГВКГ», призначено комбіноване лікування (цефтріаксон по 1,0 г внутрім’язево 2 рази на день, дексаметазон по 8 мг внутрівенно 5 днів, симптоматичні засоби).
На 5-у добу госпіталізації на тлі фебрильної лихоманки з’явились характерні клінічні ознаки вітряної віспи (поліморфний висип на шкірі голови, тулуба, рук), в зв’язку з чим хворого переведено до КІЗ ГВМКЦ «ГВКГ», де розпочато лікування АМ за схемою. Враховуючи появу нового рясного макуло-папуло-везикульозного висипу у термін до 48 годин від появи ВВ, до лікування додано пероральний ацикловір по 800 мг х 5 разів на добу (рис. 4.2).

Рис. 4.2. Шкірні прояви вітряної віспи у хворого Б.
Протягом наступних 4-х діб зберігалась фебрильна лихоманка, а висип хворого трансформувався на пустульозний з геморагічним просяканням. Розвинувся виражений інтоксикаційний синдром, температура тіла підвищилась до 40,6ºС (токсико–резорбтивна лихоманка), що вимагало переводу хворого до відділення реанімації та інтенсивної терапії для інфекційних хворих. У лікуванні додатково призначили нормальний людський імуноглобулін по 10 доз протягом 3–х діб, продовжили застосування цефтріаксону. У загальному аналізі крові спостерігалась лейкопенія 3,5 х 109/л (в лейкограмі лімфоцитів – 14,8%, моноцитів 5,2%, гранулоцитів 80%) та тромбоцитопенія – тромбоцити 144 тис./мл, а рівень еритроцитів та гемоглобіну був в межах фізіологічної норми – 5,18 х 1012/л та 164 г/л відповідно.На 12-ту добу хворий переведений до планового відділення, висип присох, сформувались рясні кірочки (рис. 4.3).
Рис. 4.3. Період регресу висипу (формування кірочок) у хворого Б.
На 22-гу добу у хворого на тулубі, руках, обличчі після відторгнення кірочок залишились рубчики до 3–5 мм в діаметрі (рис. 4.4).
У результаті лікування відмічено позитивний ефект на лабораторні показники у вигляді: лейкоцити підвищились до 5,8 х 109/л (лейкограма: лімфоцити – 41,1%, моноцити 8,3%, гранулоцитів 50,6%), тромбоцити підвищились до 241 тис/мл.
Імунологічний профіль хворого характеризувався наступними показниками до та після лікування відповідно: CD3+ – 643; 1012 кл/мл; CD4+ – 390; 612кл/мл; CD8+ – 257; 432 кл/мл; CD16+ – 174; 153 кл/мл; CD19+ – 111; 181 кл/мл; IgG – 12,6; 15,1 г/л; IgM – 1,4; 0,8 г/л; IgA – 1,7; 1,4 г/л; ЦІК – 50; 64 од. опт. щільн./мл; СН50 – 72; 59 гемат.од./мл; ФЧ – 2,7; 3,8. Виявлені порушення свідчили про наявність імунної супресії на тлі застосування стероїдних препаратів (дексаметазон), активну участь системи комплементу в імунологічних реакціях та схильність до автоімунних реакцій.
Рис. 4.4. Період регресу висипу (формування віспинок) у хворого Б.
Цитокінова ланка імунітету характеризувалась наступними показниками до та після лікування відповідно: TNF-α – 216,32; 393,28 пг/мл; ІL-1β – 315,42; 1163,74 пг/мл; ІL-4 – 115,26; 623,4 пг/мл; ІL-8 – 78,48; 275,12 пг/мл; IFN-γ – 59,62; 15,33 пг/мл. Це характеризує спрямованість імунної відповіді у напрямку більше Th1, ніж Th2 поляризації.
До лікування вірусний профіль хворого характеризувався наявністю ДНК VZV лише в слині та везикулах. На 17 добу від початку захворювання ВВ в слині повторно була виявлена ДНК VZV, що може свідчити про заразність слини хворого.
Симптоматичне лікування продовжили до моменту відпадіння кірочок та на 22-у добу хворий після проходження військово-лікарської комісії був виписаний до підрозділу після перенесеної Вітряної віспи, атипової (пустульозно-геморагічної) форми, тяжкого перебігу.
Клінічне спостереження №2.
Хворий Х., 18,8 років, поступив на лікування з діагнозом ВВ, середньої тяжкості. У першу добу розпочато лікування АМ за схемою, а на другий день висип почав прогресувати в бульозний (рис. 4.5)

Рис. 4.5. Бульозні елементи висипу у хворого Х.
Загальна кількість бул, що утворились упродовж наступних 1–2 днів становила до 20; діаметр бул різним від 2,0 до 4,0 см, при цьому свербіж був відсутній, а порушення загального самопочуття не відмічалось. Температура тіла максимальна – 38,2°С, знизилась до субфебрильної на кінець другої доби.
В загальному аналізі крові суттєвих змін не спостерігалось : лейкоцити 6,0 х 109/л (лейкограма: лімфоцити – 29,9%, моноцити 10,9%, гранулоцити 59,2%), еритроцити 4,39 х 1012/л, гемоглобін 135 г/л, тромбоцити 182 тис/мл.
Динаміка регресу висипу характеризувалась поступовою трансформацією бульозних елементів, які на 6-ту добу були присохли та утворили великі поверхневі кірки.
Після відпадіння поверхневих кірок на місцях бул утворились рожеві плями з ніжним епідермісом (рис. 4.6).

Рис. 4.6. Період регресу висипу у хворого Х.
Імунологічний профіль хворого характеризувався наступними показниками до та після лікування відповідно: CD3+ – 1022; 1207 кл/мл, CD4+ – 422; 641кл/мл, CD8+ – 568; 594 кл/мл, CD16+ – 309; 277 кл/мл, CD19+ – 173; 223 кл/мл, IgG – 9,7; 9,0 г/л, IgM – 0,9; 1,2 г/л, IgA – 0,7; 1,8 г/л, ЦІК – 63; 83 од. опт. щільн./мл, СН50 – 69; 69 гемат.од./мл, ФЧ – 3,4; 3,3. В даному випадку імунний дисбаланс у хворого не зафіксований, проте відмічалось збільшення кількості ЦІК, що свідчить про схильність до автоімунних реакцій.
Цитокінопродукція у даного хворого характеризувалась наступними показниками до та після лікування відповідно: TNF-α – 398,69; 279,78 пг/мл, ІL-1β – 1075,33; 977,15 пг/мл, ІL-4 – 540,28; 696,93 пг/мл, ІL-8 – 486,68; 582,13 пг/мл, IFN-γ – 8,07; 7,27 пг/мл. Поляризація імунної відповіді у хворого також відбувалась більше в напрямку Th1, ніж Th2. Характерними рисами було зниження рівнів TNF-α та низькі рівні IFN-γ впродовж захворювання.
Молекулярно-генетичний аналіз крові, слини та вмісту везикул у хворого показав присутність ДНК VZV на початку лікування. Після завершення лікування (на 15 добу захворювання) виявлена наявність ДНК VZV в слині, що може свідчити про уповільнення елімінації вірусу зі слини та відігравати рольу формуванні резервуару збудника в колективі.
