
- •Перелік умовних скорочень
- •Зв’язок роботи з науковими програмами, планами, темами:
- •Мета дослідження:
- •Завдання дослідження:
- •Практичне значення отриманих результатів:
- •Впровадження результатів досліджень:
- •Особистий внесок пошукача:
- •Апробація результатів роботи:
- •Розділ 1
- •1.1. Етіологічний чинник varicella zoster інфекції
- •1.2. Епідеміологія та контроль за вітряною віспою
- •1.3. Сучасні уявлення про патогенез вітряної віспи
- •1.4. Імунопатогенетичні особливості вітряної віспи
- •1.5. Питання адаптації військовослужбовців
- •1.6. Клінічні прояви вітряної віспи
- •1.7. Сучасна діагностика varicella zoster інфекції
- •1.8. Лікування вітряної віспи у дорослих
- •1.9. Профілактика вітряної віспи
- •Висновки до розділу 1.
- •Розділ 2
- •2.1. Дизайн дослідження та характеристика обстежених хворих
- •2.1.1. Дизайн дослідження, критерії включення / виключення
- •2.1.2. Характеристика обстежених хворих
- •2.2. Характеристика та схеми застосування досліджуваних препаратів
- •2.3. Методи дослідження
- •2.3.1. Клінічна діагностика
- •2.3.2. Лабораторна діагностика
- •Загальний аналіз крові
- •Визначення деяких імунологічних показників
- •Визначення фенотипу лімфоїдних клітин непрямим імунофлуоресцентним методом на проточному цитофлуориметрі
- •Визначення цитокінів методом кількісного імуноферментного аналізу
- •Молекулярно-біологічний метод
- •2.4. Методи статистичного аналізу
- •Висновки до розділу 2.
- •Розділ 3
- •3.1. Епідемічна ситуація з вітряної віспи у Збройних силах України
- •3.2. Клінічні прояви вітряної віспи у військовослужбовців
- •Динаміка захворюваності на вітряну віспу за 5 років
- •Розподіл хворих за ступенем тяжкості перебігу та формою вітряної віспи
- •Динаміка змін загального рівня лейкоцитів та лейкоформули, % (m±m)
- •3.3 Вірусний профіль при вітряній віспі у дорослих хворих
- •3.4. Імунопатогенетичні зміни при вітряній віспі у військовослужбовців
- •3.4.1. Стан клітинної та гуморальної ланки імунної відповіді
- •Динаміка деяких показників гуморальної ланки імунної відповіді (m±m)
- •Динаміка змін показників гуморальної ланки імунної відповіді
- •3.4.2. Стан цитокінової ланки імунітету
- •Показники досліджуваних цитокінів по групам (m±m)
- •Динаміка змін досліджуваних цитокінів по групах
- •3.5. Ускладнення вітряної віспи у дорослих хворих
- •Динаміка виявлення ускладнених форм вітряної віспи за 5 років
- •Взаємозв’язок тривалості висипу та наявності пустулізації*
- •Висновки до розділу 3.
- •Розділ 4
- •4.1. Застосування аміксину у дорослих хворих на вітряну віспу
- •4.1.1 Клінічна ефективність аміксину та особливості вірусного профілю
- •Частота клінічних ознак у хворих на вітряну віспу
- •Динаміка змін лейкограми крові під впливом аміксину (м±m)
- •4.1.2. Імуномодулююча активність аміксину
- •4.1.2.1. Вплив аміксину на основні компоненти клітинного та гуморального імунітету
- •Динаміка імунологічних показників клітинної ланки* при застосуванні аміксину (м±m)
- •Динаміка деяких імунологічних показників гуморальної ланки* при застосуванні аміксину (м±m)
- •4.1.2.2. Вплив аміксину на цитокінову регуляцію імунної відповіді
- •4.1.3. Небажані явища лікування аміксином
- •4.2. Застосування лімфоміозоту з енгістолом у хворих на вітряну віспу
- •4.2.1. Клінічна ефективність лімфоміозоту з енгістолом та особливості вірусного профілю
- •Динаміка змін лейкограми крові
- •4.2.2. Імуномодулююча активність лімфоміозоту та енгістолу
- •4.2.2.1. Вплив лімфоміозоту з енгістолом на основні компоненти клітинного та гуморального імунітету
- •Динаміка деяких імунологічних показників клітинної ланки* при застосуванні антигомотоксичних препаратів (м±m)
- •4.2.2.2. Вплив лімфоміозоту з енгістолом цитокінову регуляцію імунної відповіді
- •Динаміка змін цитокінового профілю, залежно від схеми лікування (м±m)
- •4.2.3. Небажані явища антигомотоксичної терапії
- •Висновки до розділу 4.
- •Розділ 5
- •Нозологічна структура інфекційної захворюваності
- •Аналіз і узагальнення результатів дослідження
- •Висновки
- •Практичні рекомендації
- •Додаток а
- •Додаток б
- •Д одаток в
- •Референтні значення деяких імунологічних показників крові
- •Додаток г
- •Референтні значення деяких цитокінів крові*
- •Додаток д
- •Додаток е Етапи дискримінантного аналізу (скорочено)
- •Список використаних джерел
Молекулярно-біологічний метод
Метод заснований на дослідженні родо- або видоспецифічних послідовностей дезоксирибонуклеінової (ДНК) або рибонуклеінової кислоти (РНК) мікроорганізму, що дозволяє судити про наявність збудника у зразку від хворого (специфічність понад 99%) [303].
Для дослідження використовувалась тест-система для визначення VZV (НПФ «ДНК-Технология», Россия) за допомогою ампліфікатору «My Cycler» («Bio-Rad», США).
Зразки крові відбирались в стерильну пробірку типу «Vacutainer» з EDTA (4,5мл), зразки слини – в суху чисту пробірку типу «Eрpendorf» (KJ072), а зразки вмісту везикул – в пробірку типу «Eрpendorf» (KJ072) з транспортним середовищем. Після відстоювання зразків крові в пробіркках «Vacutainer» з EDTA – мікропіпеткою в суху чисту пробірку типу «Eрpendorf» (KJ072) відбиралась надосадова рідина (плазма), яка заморожувалась до -70°С.
У всіх стаціонарних хворих досліджували кров, слину та вміст везикул на присутність генетичного матеріалу VZV до лікування (період розпалу хвороби) та у періоді реконвалесценції (перед випискою зі стаціонару). При повторному обстеженні хворих на ВВ, які перебували в періоді реконвалесценції (клінічне одужання), в якості біоматеріалу досліджувалась лише кров та слина.
Облік результатів ПЛР – аналізу проводився за визначенням на електрофореграмі специфічних полос ампліфікованої ДНК (269 пар нуклеотидів для VZV, 590 пар нуклеотидів для внутрішнього контролю) за допомогою електрофоретичної камери з фотометричною документуючою системою «Gel Doc» («Bio-Rad») з наступною обробкою результатів за допомогою комп’ютерного програмного забезпечення «Quantity One» 4.6.1. (рис. 2.4).
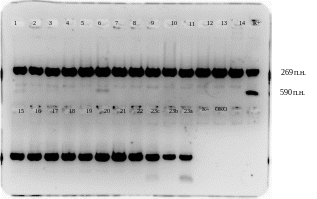
Рис. 2.4. Фотометричний відбиток результату ПЛР дослідження:
«К+» – позитивний контроль ампліфікації, вказує відповідну довжину пар нуклеотидів;
«ОКО» – негативний контроль виділення;
«К–» – негативний контроль ампліфікації;
«1 – 22» – біологічний матеріал з везикул від окремих пацієнтів;
«23с» – біологічний матеріал з везикули пацієнта;
«23b» – біологічний матеріал зі слини пацієнта;
«23a» – біологічний матеріал з крові пацієнта.
Інтерпретація зображення з монітору (рис. 2.4) чітко визначає, що зразки номер 1–22 та 23с містять ДНК VZV у везикулах, а результат дослідження розцінено як позитивний. Відповідно, зразок номер 23b містить ДНК VZV у слині, а 23а – у крові, що також розцінюється як позитивний результат.
2.4. Методи статистичного аналізу
Статистична обробка отриманих даних проводилась на персональному комп’ютері, після створення автором бази даних за допомогою програми Microsoft Office Excel 2003 (стовпчики відповідали досліджуваним перемінним, рядки окремим спостереженням – хворі з ВВ). Для більш коректного статистичного аналізу отриманих даних застосовували пакет прикладних статистичних програм Statistica 8.0 [304, 305].
Первинна статистична обробка створеної бази даних встановила наявність наступних категорій перемінних: кількісні, біноміальні, категорії та мітки. З урахуванням цього, а також поставлених завданнь дослідження, були застосовані наступні методи статистичної обробки інформації:
визначення нормального розподілу величин;
описова статистика;
параметричне та непараметричне порівняння незалежних груп (коефіцієнт Стьюдента або Фішера, критерій Мана-Уїтні);
побудова таблиць частот та зв’язаності (кростабуляції) з визначенням відношення шансів та достовірності (тест Макнемара для залежних груп);
параметричний та непараметричний кореляційний аналіз;
багатофакторний (дискримінантний) аналіз.
При проведені перевірки отриманих даних на нормальність розподілу величин, були побудовані гістограми розподілу ознак. Аналіз гістограм встановив, що розподіл досліджуваних кількісних ознак наближається до нормального. З цього випливає, що до отриманих даних можуть бути застосовані параметричні методи статистики (t-критерій Стьюдента / Фішера).
Для одержаних результатів встановили критичний рівень статистичної значущості р<0,05, який розцінювали як достовірний.
Таблиці зв’язаності давали змогу оцінити значення абсолютних частот двох чи більше ознак, розташованих у стовпчиках та рядках відповідно. Кростабуляція дозволяє сумістити частоти появи спостережень на різних рівнях факторів та проаналізувати зв’язки між табульованими факторами.
Відношення шансів (ВШ) підраховували на підставі аналізу чотирьохпольної таблиці за формулою 2.1.
ВШ = А х D : B х C |
(2.1) |
де А – верхнє ліве, В – верхнє праве, С – нижнє ліве та D – нижнє праве поля чотирьохпольної таблиці якісних ознак, що відображують абсолютні частоти.
Довірчі інтервали (CI) ВШ визначались за методом Woolf [304].
При проведенні кореляційного аналізу вимірювали значення коефіцієнта кореляції в інтервалі від -1 до +1, при чому функціональну лінійну залежність зі знаком «-» вважали негативною (оберненою), а залежність зі знаком «+» – позитивною (прямою), тощо. При цьому, при інтерпретації кореляційного статистичнго зв’язку, спирались у першу чергу на вірогідність коефіціенту кореляції (р<0,05), а в другу – на числове значення коефіцієнта кореляції, який умовно поділяє зв’язок на слабкий (|r|<0,25) – в дослідженні не враховувався, помірний (|r|=0,25–0,75) та сильний (|r|>0,75) [304, 306].
За допомогою багатофакторного (дискримінантного) аналізу вирішували дві задачі: 1.) прогнозування віднесення об’єкту до тієї чи іншої групи за діагностичною ознакою, 2.) визначення найбільш інформативних ознак з певного, чисельного набору ознак. Проведення дискримінантного аналізу вимагало створення вирішального правила у вигляді регресійного рівняння, за яким класифікували ознаки. Достовірно значущим вважали вірогідність точності моделі р<0,05, при цьому, гранична чутливість моделі має наближатись до 90%.
