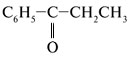
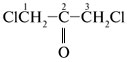- •1 Вопрос:
- •2 Вид: Классы органических соединений
- •2 Вопрос:
- •3 Вопрос:
- •4 Вопрос:
- •5 Вопрос:
- •6 Вопрос:
- •7 Вопрос:
- •8 Вопрос:
- •Получение гликолей.
- •Химические свойства гликолей.
- •1. С галогенводородными кислотами
- •Применение.
- •Тринитрат Глицерина (Тринитроглицерин).
- •Сложные эфиры высших карбоновых кислот (жиры и масла).
- •10 Вопрос:
- •Вопрос 11. Карбонильные соединения. Реакции альдегидов и кетонов, обусловленные активностью атомов водорода при α-углеродном атоме. Альдольная конденсация.
- •12 Вопрос:
- •13 Вопрос:
- •1.Теоретическая часть.
- •1.2. Физические свойства.
- •1.4. Химические свойства карбоновых кислот.
- •1.4.1. Кислотность
- •1.4.2. Превращение карбоновых кислот в функциональные производные
- •1.4.2.1. Галогенангидриды кислот
- •1.4.2.2. Сложные эфиры карбоновых кислот.
- •1.4.2.3. Ангидриды кислот.
- •1.4.2.4. Амиды кислот.
- •1.4.2.5. Нитрилы карбоновых кислот
- •14 Вопрос:
- •15 Вопрос:
- •16 Вопрос:
- •17 Вопрос:
- •18 Вопрос:
- •19 Вопрос:
- •20 Вопрос:
- •21 Вопрос:
- •22 Вопрос:
- •23 Вопрос:
- •26 Вопрос:
- •27 Вопрос:
- •28 Вопрос:
- •29 Вопрос:
- •Кетонное
- •Кислотное
- •30 Вопрос:
- •31 Вопрос:
- •1. Методы получения
10 Вопрос:
Карбонильными соединениями называют органические вещества, в молекулах которых имеется группа >С=О (карбонил или оксогруппа).
Общая формула карбонильных соединений:
|
В зависимости от типа заместителя Х эти соединения подразделяют на: альдегиды ( Х = Н ); кетоны ( Х = R, R' ); карбоновые кислоты ( Х = ОН ) и их производные ( Х = ОR, NH2, NHR, Hal и т.д.).
Алифатические и ароматичексие:



|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химические формулы и названия кетонов по номенклатуре ИЮПАК и по рациональной номенклатуре (в скобках)
Линейные кетоны (насыщенные) |
Разветвленные кетоны |
Ненасыщенные кетоны |
Ароматические кетоны |
пентанон-2 метилпропилкетон) |
2-метилпентанон-3 (изопропилэтилкетон) |
пентен-1-он-3 (винилэтилкетон) |
ацетофенон (метилфенилкетон) |
1,3-дихлорпропанон-2 (бис-хлорметилкетон) |
4-бром-3-метилбутанон-2 (2-бромизопропилметилкетон) |
пентен-4-он-2 (аллилметилкетон) |
пропиофенон (фенилэтилкетон) |
Гомологический ряд и их номенклатура
Простейший альдегид, называемый муравьиным альдегидом или формальдегидом, содержит альдегидную группу, связанную с атомом водорода, и имеет строение
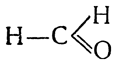
, или сокращенно
Н—СНО. В остальных альдегидах предельного ряда место одного атома водорода занимает алкил: СnС2n+1—СНО.
Альдегиды можно также рассматривать как вещества, происшедшие от замещения в парафиновых углеводородах атома водорода на альдегидную группу, т. е. как однозамещенные производные углеводородов гомологического ряда метана. Следовательно, здесь гомология и изомерия те же, что и для других однозамещенных производных предельных углеводородов.
Названия альдегидов производятся от тривиальных названий кислот с тем же числом атомов углерода в молекуле. Так, альдегид СН3—СНО называется уксусным альдегидом или ацетальдегидом, СН3СН2—СНО — пропионовым альдегидом, СН3СН2СН2—СНО — нормальным масляным альдегидом или бутиральдегидом, (СН3)2СН—СНО — изомасляным альдегидом, альдегиды С4Н9—СНО — валериановыми альдегидами и т. д.
По женевской номенклатуре, названия альдегидов производятся от названий углеводородов, имеющих то же число углеродных атомов, с присоединением к окончанию ан слога аль, например метаналь Н—СНО, этаналь СН3—СНО, 2-метилпропаналь СН3СН(СН3)—СНО и т. д.
Гомологический ряд кетонов и их номенклатура
Простейший из кетонов имеет строение СН3—СО—СН3 и называется диметилкетоном или ацетоном. От ацетона можно произвестигомологический ряд последовательным замещением атомов водорода на метил. Таким образом, следующий гомолог ацетона — метилэтилкетонимеет строение СН3—СО—СН2—СН3. Третий гомолог может существовать в трех изомерных формах:

Названия кетонов, так же как и названия альдегидов, по женевской номенклатуре, производятся от названий углеводородов с тем же числом атомовуглерода, с присоединением к окончанию ан слога он и прибавлением цифры, обозначающей место атома углерода карбонильной группы, считая от начала нормальной углеродной цепи; ацетон, таким образом, носит название пропанон, диэтилкетон — пентанон-3, метилизопропилкетон — 2-метилбутанон и т. д
Альдегиды и кетоны с одинаковым числом атомов углерода в молекуле изомерны друг другу. Общая формула для гомологических рядов предельныхальдегидов и кетонов: СnН2nО.
Строение карбонильной группы:
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3-связи (одна из них - связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в -связи С–О, две другие содержат неподеленнные электронные пары. -Связь образована р-электронами атомов углерода и кислорода. |
|

Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные -электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.
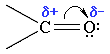
Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+.
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С2–C5 и кетоны С3–С4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Отличие связи С=О от связи С=С: Двойная связь С=О, подобно связи С=С, представляет собой комбинацию s - и p-связей (они изоэлектронны). Однако, между этими двумя двойными связями имеются существенные различия:
- C=O значительно прочнее С=С;
- энергия связи С=О (179 ккал/моль) больше, чем энергия двух связей С-О (85.5 ккал/моль), в то время как энергия связи С=С (146 ккал/моль) меньше суммы энергий двух связей С-С (82.6. ккал/моль);
- связь С=О в отличие от С=С полярна.
При этом p-связь поляризована сильнее, чем s-связь. Таким образом, атом углерода карбонильной группы является электронодефицитным центром, а кислорода - электроноизбыточным.
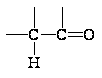
d+ d-
Кроме тогo, карбонильная группа увеличивает кислотность атомов Н у соседнего атома С, приводя к увеличению кинетической кислотности (увеличению полярности связи С-Н из-за - I-эффекта карбонильной группы) и термодинамической кислотности (стабилизация образующегося карбаниона за счет мезомерного эффекта).
В молекулах карбонильных соединений имеется несколько реакционных центоров.
Электрофильный центр - карбонильный атом углерода, возникновение частичного положительного заряда на котором обусловлено полярностью связи С=О. Электрофильный центр участвует в реакциях нуклеофильного присоединения.
Получение
Наиболее часто применяющимися способами получения альдегидов являются окисление и каталитическое дегидрирование первичных спиртов.
А)
![]()
Альдегиды получаются также путем отщепления водорода от первичных спиртов при пропускании их паров над нагретыми до 600° латунными или цинковыми стружками, играющими роль катализатора:
![]()
CH3CH2OH + CuO→Cu+H2O+CH3-CH=O
Б) Дегидрирование первичных спиртов. Реакцию проводят, пропуская пары спирта над нагретым до 200-300С катализатором, в качестве которого используются медь, никель, кобальт и др.
O II R–CH2–OH ––t,kat R–C I H |
(альдегид) + H2 |
2) Альдегиды получают гидролизом дигалогенопроизводных углеводородов, однако только тех, у которых оба атома галогена расположены у одного из концевых атомов углерода.
CH3–CH2– |
|
+ 2H2O [CH3–CH2– |
|
] + 2HCl |
1,1- дихлорпропан |
1,1-пропандиол | | |
|||
CH3CH2COH+ H2O
При действии воды на дигалогеналкил в щелочной или кислой среде реакция его гидролиза проходит стадию образования двухатомного спирта, содержащего две гидроксильных группы у одного атома углерода. Такие спирты вследствие своей неустойчивости в момент образования теряют воду и образуют альдегиды.
3. Уксусный альдегид получают гидратацией ацетилена по реакции Кучерова.
|
|
O II |
HCCH + H2O ––HgSO4 [H2 |
C=C |
H] –– CH3–C |
|
|
I H уксусный альдегид |
4) Разработан метод получения уксусного альдегида окислением этилена кислородом воздуха в присутствии солей меди и палладия.
O II 2CH2=CH2 + O2 ––CuCl2,PbCl2 2CH3–C I H уксусный альдегид
|
5) Для получения кетонов большое значение имеет метод сухой перегонки кальциевых или бариевых солей карбоновых кислот: t=400
![]()
6) Оксосинтез является наиболее важным процессом для получения альдегидов с тремя атомами углерода и выше. В этой реакции алкены реагируют с синтез-газом (CO + H2) с образованием альдегида, содержащего на один атом углерода больше, чем исходный алкен. T=100-200, 10-20мПа (кат. Co+ ThO2+MgO)

7) Реакция Фриделя — Крафтса — типичное электрофильное замещение в ароматическом ядре.(катализатор AI CI3)
CH3COCl +C6H6→CH3COC6H5+HCI
Окисление, восстановление
Присоединение водорода к альдегидам осуществляется в присутствии катализаторов (Ni, Co, Pd и др.) и приводит к образованию первичных спиртов.
O II R–C + H2 ––Ni R–CH2–OH(первичный спирт) I H |
Все чаще в качестве восстанавливающего агента применяют алюмогидрид лития LiAlH4 и борогидрид натрия NaBH4. Помимо реакций присоединения по карбонильной группе для альдегидов характерны также реакции окисления.
А кетоны до вторичных спиртов Окисление. Альдегиды легко окисляются, образуя соответствующие карбоновые кислоты.
O II R–C I H |
––[O] |
O II R–C (кислота) I OH |
a) аммиачный раствор оксида серебра [Ag(NH3)2]OH при нагревании с альдегидами окисляет альдегид до кислоты (в виде ее аммониевой соли) с образованием свободного металлического серебра. Эта реакция, получившая поэтому название "серебряного зеркала", служит качественной реакцией на альдегиды.
O II CH3–C+ 2[Ag(NH3)2OH ––t CH3COONH4(ацетат аммония) + 2Ag + 3NH3 + H2O I H |
b) еще одной характерной реакцией является окисление альдегидов гидроксидом меди (II).
O II CH3–C I H |
+ 2Cu(OH)2(голубой) ––t CH3– |
O II C (уксусная к-та) + Cu2O(красный) +2H2O I OH |
С) кетоны окис-ся трудно, с разрывом связи С-С