
- •1 Вопрос:
- •2 Вид: Классы органических соединений
- •2 Вопрос:
- •3 Вопрос:
- •4 Вопрос:
- •5 Вопрос:
- •6 Вопрос:
- •7 Вопрос:
- •8 Вопрос:
- •Получение гликолей.
- •Химические свойства гликолей.
- •1. С галогенводородными кислотами
- •Применение.
- •Тринитрат Глицерина (Тринитроглицерин).
- •Сложные эфиры высших карбоновых кислот (жиры и масла).
- •10 Вопрос:
- •Вопрос 11. Карбонильные соединения. Реакции альдегидов и кетонов, обусловленные активностью атомов водорода при α-углеродном атоме. Альдольная конденсация.
- •12 Вопрос:
- •13 Вопрос:
- •1.Теоретическая часть.
- •1.2. Физические свойства.
- •1.4. Химические свойства карбоновых кислот.
- •1.4.1. Кислотность
- •1.4.2. Превращение карбоновых кислот в функциональные производные
- •1.4.2.1. Галогенангидриды кислот
- •1.4.2.2. Сложные эфиры карбоновых кислот.
- •1.4.2.3. Ангидриды кислот.
- •1.4.2.4. Амиды кислот.
- •1.4.2.5. Нитрилы карбоновых кислот
- •14 Вопрос:
- •15 Вопрос:
- •16 Вопрос:
- •17 Вопрос:
- •18 Вопрос:
- •19 Вопрос:
- •20 Вопрос:
- •21 Вопрос:
- •22 Вопрос:
- •23 Вопрос:
- •26 Вопрос:
- •27 Вопрос:
- •28 Вопрос:
- •29 Вопрос:
- •Кетонное
- •Кислотное
- •30 Вопрос:
- •31 Вопрос:
- •1. Методы получения
4 Вопрос:
Арены- это непредельные углеводороды, которые можно рассматривать, как производные простейшего из них- бензола.
sp2 гибридизация, при этом sp2 гибридные атомы углерода образуют особую ароматическую связь засчет взаимного перекрывания негибридизованных Р-облаков в цикле. Р-электроны распределяются симметрично вокруг кольца и могут перемещаться по кольцу в том или ином направлении.


Критерии ароматичности:
Легкость образования в различных реакциях.
Устойчивость к окислению
Трудное протекание реакций присоединения
Легкость протекания реакций замещения водорода
Физические: выигрыш в энергии при переходе незамкнутой системы к циклическим.
Принцип Хюккеля: количество π -электронов образующих π -связи в ароматических соединениях должно равняться N=4n+2
Реакции электрофильного замещения: все эти реакции являются каталитическими. Катализатор необходим для генерации электрофила.
Реакции Фриделя-Крафтца идут с использованием кислот Льюиса AlCl3, FeCl3, Fe и т.д.


Реакции сульфанирования и нитрования идут в присутствии серной кислоты.

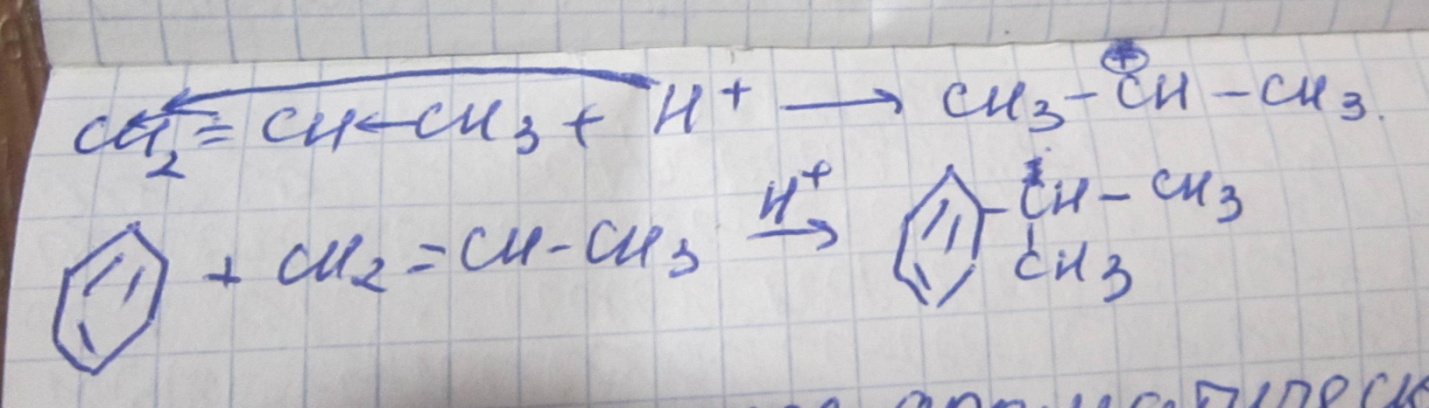
Реакция алкилирование алкенами. Катализатор- минеральная кислота Н+

Особенности реакции алкилирования.
Алкилирование по Фриделю-Крафтцу

Алкилирование алкенами.
Электрофильное ароматическое замещение идет с образованием σ и π комплексов в 3 стадии.

3 стадия
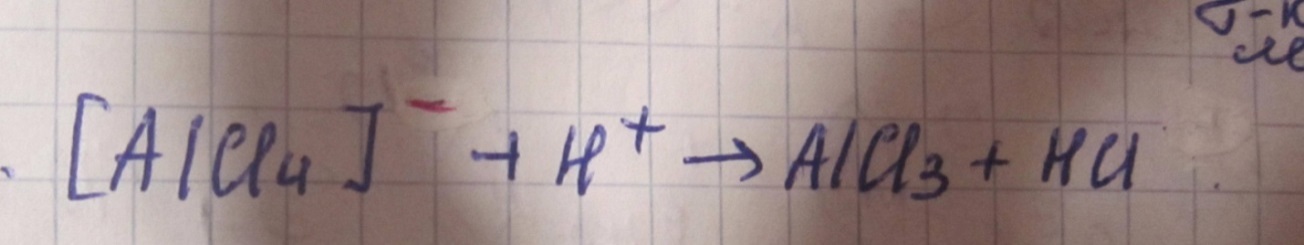
5 Вопрос:
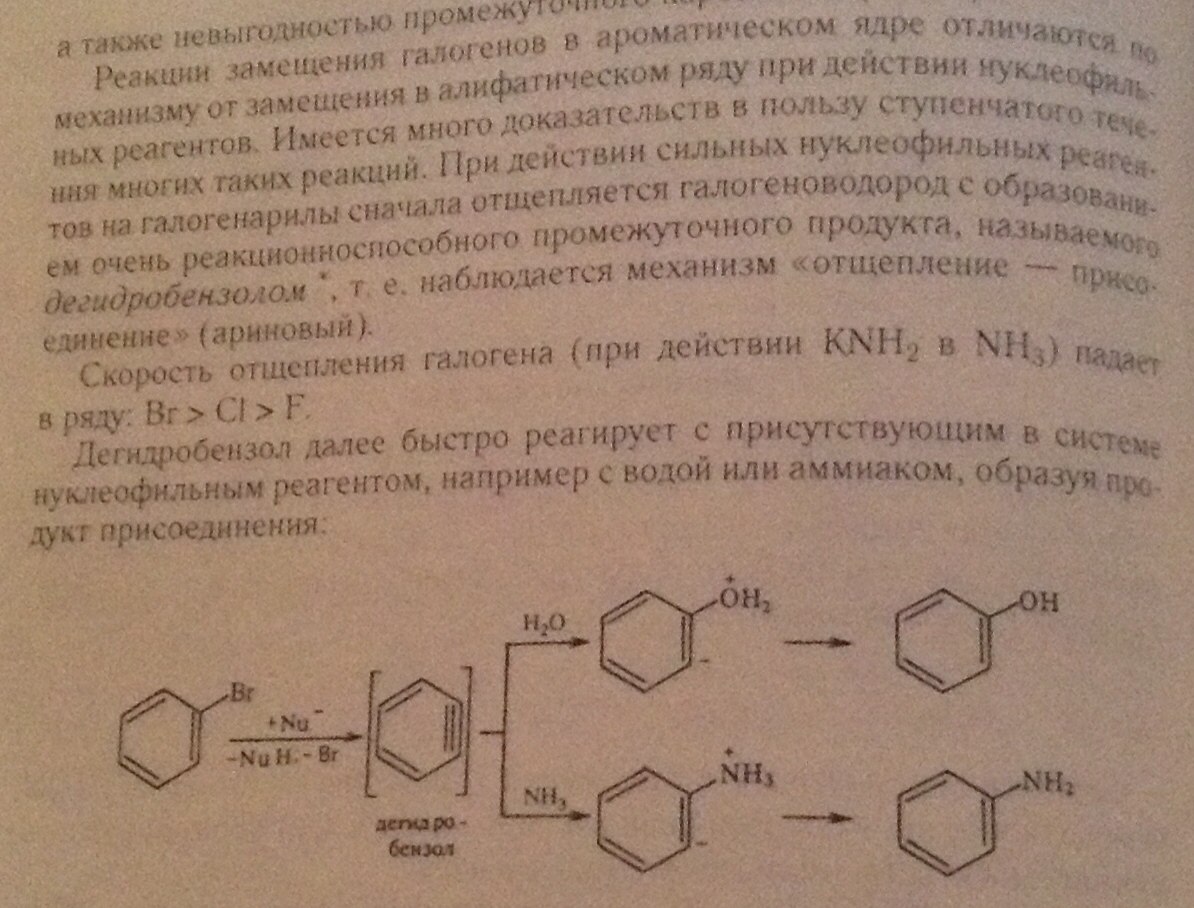
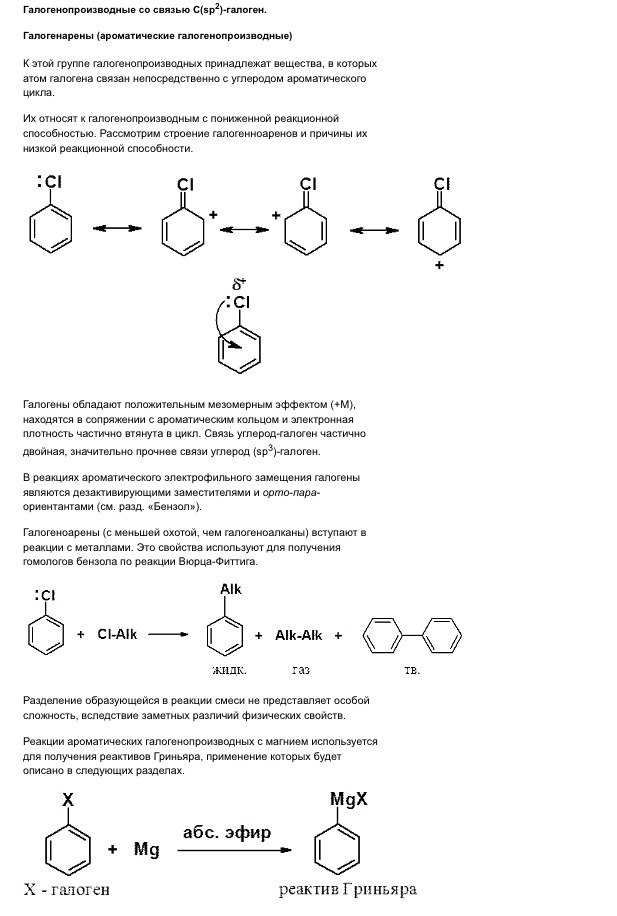
Галогенопроизводные ароматических углеводородов
Ароматические галогенопроизводные разделяются по строению,свойствам и методам получения на 2 группы:1)соединения, содержащие галоген в ядре; 2)соединения, содержащие галоген в боковой цепи
Бензол образует 1 моногалогенозамещ. , 3 дигалогеннозамещен. , 3 тетрагалогенозамещ. 1 пента- и 1 гексагалогенозамещ.
Толуолу отвечают 4 моногалогенозамещ-ых, из которых 1 имеет галоген в боковой цепи:
1)Орто-хлортолуол 2)Мета-хлортолуол 3)Пара-хлортолуол
4)Хлористый бензил Ar-CH2Cl
Хлорирование бензола С6Н6 + 3CI2 = С6Н6CI6
Хлорирование в боковую цепь

Химические свойства

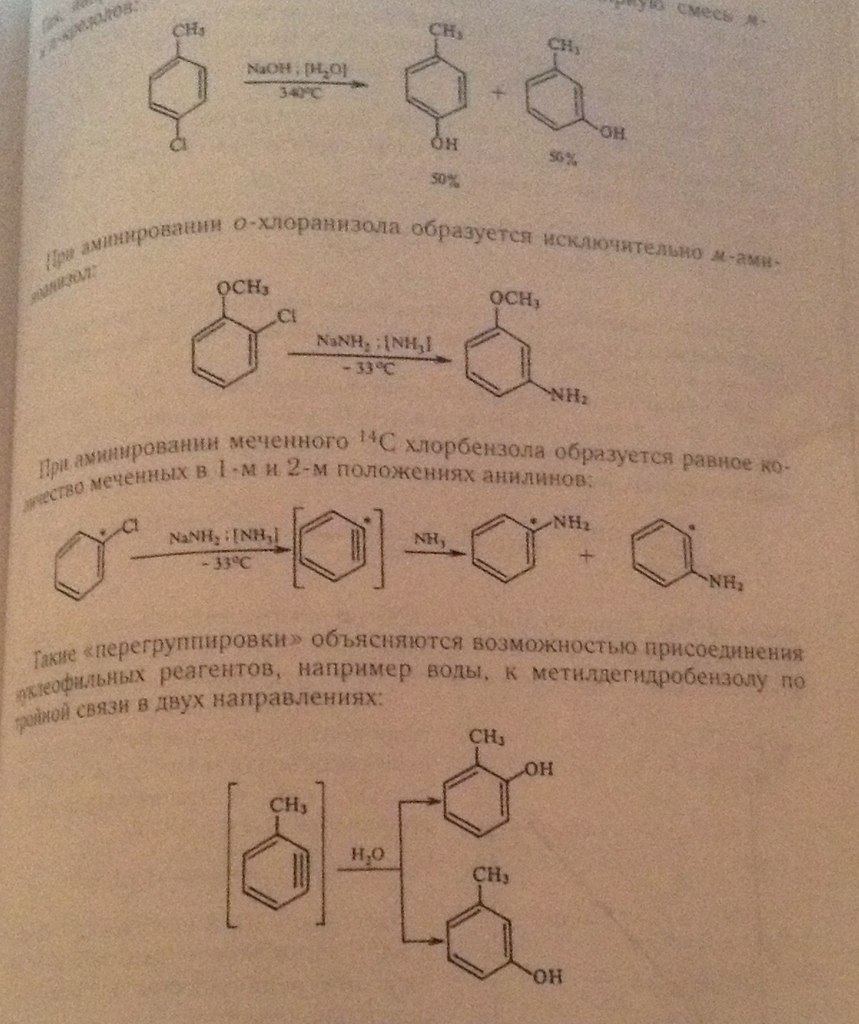
6 Вопрос:
Гидроксипроизводные углеводородов Спирты
Номенклатура:
ИЮПАК:согласно ей все спирты имеют суффикс –ОЛ
Рациональная(заместительная) метанол карбинол
По УВ-радикалу метиловый спирт
Спирты классифицируются следующим образом (в скобках приведены примеры):
По числу гидроксильных групп:
— одноатомные спирты (метанол); — двухатомные спирты (этиленгликоль); — трехатомные спирты (глицерин); — четырёхатомные спирты (пентаэритрит); — многоатомные спирты (пятиатомный спирт: ксилит).
В зависимости от насыщенности углеводородного заместителя:
— предельные (насыщенные) спирты (бутанол); — непредельные (ненасыщенные) спирты (аллиловый спирт, пропаргиловый спирт); — ароматические спирты (бензиловый спирт).
В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
— ациклические (алифатические) спирты (этанол); — алициклические спирты (циклогексанол).
В зависимости от числа заместителей при α-углеродном атоме:
— первичные спирты (этанол); — вторичные спирты (пропанол-2); — третичные спирты (2-метилпропанол-2).
Физические свойства
Молекулы спиртов, подобно молекуле воды, имеют угловое строение. Угол R−O−H в молекуле метанола равен 108,5°]. Атом кислорода гидроксильной группы находится в состоянии sp³-гибридизации. Спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений. Так, из ряда монозамещённых производных метана, метанол имеет необычно высокую температуру кипения, несмотря на относительно небольшую молекулярную массу:
Молекулярные массы и температуры кипения метана и некоторых его производных
|
Метан CH4 |
Метанол CH3OH |
Хлорметан CH3Cl |
Нитрометан CH3NO2 |
Бромметан CH3Br |
Молярная масса, г/моль |
16,04 |
32,04 |
50,48 |
61,04 |
94,94 |
Температура кипения, °С |
−161,5 |
64,5 |
−24,2 |
101,2 |
3,6 |
Высокие температуры кипения спиртов объясняются наличием межмолекулярных водородных связей.. Энергия водородной связи значительно ниже, чем энергия ковалентной химической связи. Так, например, для метанола энергия водородной связи составляет 16,7 кДж/моль , тогда как связи C–H, C–O и O–H имеют энергию 391,7, 383,5 и 428,8 кДж/моль соответственно. Тем не менее, влияние водородных связей на физические свойства спиртов весьма значительное.

Молекулы спирта, имея две полярных связи C−O и O−H, обладают дипольным моментом(~5,3—6,0·10−30 Кл·м). Электростатические заряды в молекуле метанола составляют: на атоме углерода 0,297 e; на атоме гидроксильного водорода 0,431 e; на атоме кислорода −0,728 e. Вместе с тем, энергия ионизацииспиртов ниже, чем у воды (10,88 эВ для метанола против 12,61 эВ для воды), что объясняется электронодонорным эффектом алкильной группы.
Следует отметить, что влияние гидроксильной группы особенно велико на соединения с небольшой углеводородной цепочкой. Так, например, метанол и этанол неограниченно смешиваются с водой и имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, в то время как высшие спирты гидрофобны и мало отличаются по свойствам от соответствующих углеводородов.
