
- •1 Вопрос:
- •2 Вид: Классы органических соединений
- •2 Вопрос:
- •3 Вопрос:
- •4 Вопрос:
- •5 Вопрос:
- •6 Вопрос:
- •7 Вопрос:
- •8 Вопрос:
- •Получение гликолей.
- •Химические свойства гликолей.
- •1. С галогенводородными кислотами
- •Применение.
- •Тринитрат Глицерина (Тринитроглицерин).
- •Сложные эфиры высших карбоновых кислот (жиры и масла).
- •10 Вопрос:
- •Вопрос 11. Карбонильные соединения. Реакции альдегидов и кетонов, обусловленные активностью атомов водорода при α-углеродном атоме. Альдольная конденсация.
- •12 Вопрос:
- •13 Вопрос:
- •1.Теоретическая часть.
- •1.2. Физические свойства.
- •1.4. Химические свойства карбоновых кислот.
- •1.4.1. Кислотность
- •1.4.2. Превращение карбоновых кислот в функциональные производные
- •1.4.2.1. Галогенангидриды кислот
- •1.4.2.2. Сложные эфиры карбоновых кислот.
- •1.4.2.3. Ангидриды кислот.
- •1.4.2.4. Амиды кислот.
- •1.4.2.5. Нитрилы карбоновых кислот
- •14 Вопрос:
- •15 Вопрос:
- •16 Вопрос:
- •17 Вопрос:
- •18 Вопрос:
- •19 Вопрос:
- •20 Вопрос:
- •21 Вопрос:
- •22 Вопрос:
- •23 Вопрос:
- •26 Вопрос:
- •27 Вопрос:
- •28 Вопрос:
- •29 Вопрос:
- •Кетонное
- •Кислотное
- •30 Вопрос:
- •31 Вопрос:
- •1. Методы получения
22 Вопрос:
Амины - это органические производные аммиака в которых один, два или все три атома водорода замещены на углеводородные радикалы.
Бывают: первичные, вторичные, третичные.
Могут быть: алифатические, ароматические, смешанными.
Способы получения аминов!!



Химические свойства!!
Химическое поведение аминов полностью определяется наличием на атоме азота НЭП (Не поделенной электронной пары). В связи с чем амины являются основаниями и могут выступать в качестве нуклеофильных реагентов.
Основность аминов.
NH3 + HCLNH4Cl
Основность аминов зависит от их строения:
Алифатические радикалы благодаря своему донорному индукционному эффекту увеличивают основность аминов. NH3 < NH2-R < R-NH-R < R-N(R)-R (NH3 Самое слабое основание, Третичные амины самые сильные основания).
Арильные радикалы благодаря эффекту сопряжения между НЭП и ароматическим ядром уменьшают основность аминов.

Изменить основность ароматических аминов можно введением в ядро заместителей:
Донорные заместители увеличивают основность. Акцепторные заместители еще больше уменьшают основность.(Донорные-заместители 1 рода, Акцепторные-заместители 2 рода).
Хим. Реакции:
Основание.

Алкилирование. C6H5NH2 + CH3-CH2-Cl[C6H5-NH2+-CH2-CH3]Cl + NaOHC6H5-NH-CH2-CH3 + NaCl + H2O
Ацилирование. При нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов.
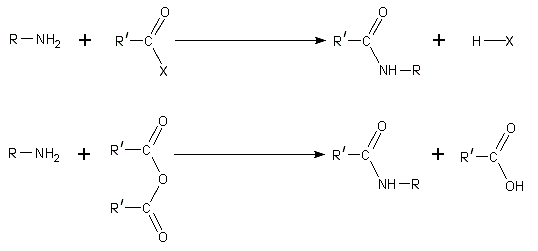
![]()
Взаимодействие аминов с карбонильными соединениями.

5.Взаимодействие аминов с азотистой кислотой (HNO2). Амины взаимодействую с кислотой по разному в зависимости от их строения.
Первичные амины с азотистой кислотой вступают в реакцию диазонирования, с образованием солей диазония.

Вторичные амины вступают в реакцию нитрозирования по аминогруппе

Третичные смешаные амины вступают в реакцию нитрозирования по ароматическому ядру.
Реакции по ароматическому ядру!!
Нитрование.
Нитрование анилина(как пример) необходимо проводить с защитой аминогруппы от окисления.
Защита осуществляется с помощью реакции ацилирования:


23 Вопрос:
Азо- и диазо- соединения.
Взаимодействие первичных ароматических аминов с азотистой кислотой(HNO2),как раз является получением солей диазония.

Соли
диазония весьма неустойчивы и уже при
комнатной температуре разлагается с
выделением азота. Эта неустойчивость
и связанная с ней большая химическая
активность позволяют использовать
диазониевые соли для разнообразных
синтезов. Из реакций солей диазония
отметим следующие:
1.
Реакции, сопровождающиеся выделением
азота и замещением диазогруппы на
гидроксил, галоид или циан (а также и на
водород при действии энергичных
восстановителей).

2.
Реакции сочетания с ароматическими
соединениями, содержащими подвижный
атом водорода. При этом отщепляется
хлористый водород и образуется устойчивое
окрашенное азосоединение:

Строение метилового оранжевого.


Строение.

26 Вопрос:
Оптическая изомерия: молочная, яблочная, винная кислоты. Асимметрический атом углерода. Энантиомеры. Диастереомеры. Рацемат. Методы разделения рацематов.
Молочная кислота – важный промежуточный продукт обмена веществ у животных, растений, микроорганизмов.Образуется при брожении сахаристых веществ под влиянием различных бактерий молочнокислого брожения при скисании молока, квашении капусты, солении овощей, созревание сыра.

 Изомер
D-
левовращающий, изомер L-правовращающий.
Изомер
D-
левовращающий, изомер L-правовращающий.


Асимметрически атом углерода (хиральный центр)- это по крайней мере один атом углерода, связанный с четырьмя различными группами.
Энантиомеры— пара стереоизомеров, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве. Они имеют одинаковые физические и химические свойства, но различаются оптическими свойствами.
Диастереомеры — стереоизомеры, не являющиеся зеркальными отражениями друг друга.Отличаются физическими свойствами, а иногда и химическими.
Рацемат — эквимолярная смесь двух энантиомеров. Рацематы не обладают оптической активностью, а также отличаются по свойствам от индивидуальных энантиомеров. Равные количества право и левовращающихся изомеров одного и того же вещества могут дать оптически недеятельное молекулярное соединение- рацемат.
Существует три метода разделения рацематов:
1) Механический отбор.
При определенных условиях соли рацемической смеси кислот кристаллизируются в виде правой и левой форм отдельно, причем их кристаллы по форме относят друг к другу как предмет к зеркальному изображению-они энантиоморфны. Такие кристаллы можно механически разделить, например, с помощь сильной лупы и пинцета.
2)Биологический отбор.
Различные микроорганизмы способны потреблять в процессе жизнедеятельности какую либо одну из оптичечки активных форм, обычно ту, которая более распространена в природе. Другая форма остается в чистом состоянии и может быть выделена из остатков.
3) Кристаллизация диастереомеров.
Метод сводится к тому, что из смеси оптических изомеров получают смесь диастреомеров, которую и раскристаллизовывают. Дейтсвуют на смесь двух изомеров какой либо кислоты оптически активным основанием, получают две соли, представляющие собой диастереомеры. После разделения диастереомерных солей из них выделяют действием более сильных кислот две кислоты- оптические антиподы.




