- •1 Вопрос:
- •2 Вид: Классы органических соединений
- •2 Вопрос:
- •3 Вопрос:
- •4 Вопрос:
- •5 Вопрос:
- •6 Вопрос:
- •7 Вопрос:
- •8 Вопрос:
- •Получение гликолей.
- •Химические свойства гликолей.
- •1. С галогенводородными кислотами
- •Применение.
- •Тринитрат Глицерина (Тринитроглицерин).
- •Сложные эфиры высших карбоновых кислот (жиры и масла).
- •10 Вопрос:
- •Вопрос 11. Карбонильные соединения. Реакции альдегидов и кетонов, обусловленные активностью атомов водорода при α-углеродном атоме. Альдольная конденсация.
- •12 Вопрос:
- •13 Вопрос:
- •1.Теоретическая часть.
- •1.2. Физические свойства.
- •1.4. Химические свойства карбоновых кислот.
- •1.4.1. Кислотность
- •1.4.2. Превращение карбоновых кислот в функциональные производные
- •1.4.2.1. Галогенангидриды кислот
- •1.4.2.2. Сложные эфиры карбоновых кислот.
- •1.4.2.3. Ангидриды кислот.
- •1.4.2.4. Амиды кислот.
- •1.4.2.5. Нитрилы карбоновых кислот
- •14 Вопрос:
- •15 Вопрос:
- •16 Вопрос:
- •17 Вопрос:
- •18 Вопрос:
- •19 Вопрос:
- •20 Вопрос:
- •21 Вопрос:
- •22 Вопрос:
- •23 Вопрос:
- •26 Вопрос:
- •27 Вопрос:
- •28 Вопрос:
- •29 Вопрос:
- •Кетонное
- •Кислотное
- •30 Вопрос:
- •31 Вопрос:
- •1. Методы получения
17 Вопрос:
Карбоновые кислоты – производные углеводородов, содержащие карбоксильную
группу –COOH.
.
Методы получения:
Окисление:
R-H → R’COOH
C6H5-CH3→(KMnO4, [OH-]) C6H5COOH
При окислении гомологов бензола получаются ароматические карбоновые кислоты.
Реакции оксосинтеза:
СН3-СН=СН2 + СО + Н20 → (Со(СО)4) СН3-СН2-СН2-СООН (или СН3-СН(СН3)-СООН)
Окисление первичных спиртов:
R-CH2OH→RCOOH
Гидролиз нитрилов карбоновых кислот:
СН3-С≡N+2Н2О→СН3СООН+NH3[CH3COONH4]
По данным эксперимента в карбоксилат-ионе происходит делокализация электронной плотности и образуются две = связи по длине СО-связи, в результате анион стабилизируется. Карбоновые кислоты являются кислотами средней силы и более сильные, чем спирты и фенолы. Сила кислоты зависит от радикала при карбоксильной группе: HCOOH>CH3COOH. (если присутствует донорный заместитель – кислотные свойства слабее, если акцепторный – сильнее). HCOOH>C6H5COOH>CH3COOH – объясняется влиянием кольца.
Химические свойства:
реакции карбоксилат-ионов:
СН3СООН+NaOH(H2O)→CH3COONa+H2O
декарбоксилирование:
СН3СООNa+NaOH(тв.)→(сплав)CH4+Na2CO3
2CH3COONa+H2O(эл.ток)→CH3-CH3+CO2+NaOH+H2
восстановление:
CH3COOH+Li[AlH4]→CH3-CH2-OH
взаимодействие с галогенами:
C2H5COOH+Cl2→(P)CH3-CH(Cl)-COOH
введение галогенов в α-положение силу кислоты увеличивает


+соли: CH3COOH+NaOH→CH3COONa
+ангидриды:

Малеиновая кислота — органическое соединение с формулой HOОC-CH=CH-COОH. Название по номенклатуре IUPAC — цис-бутендиовая кислота. Ее транс-изомером является фумаровая кислота. Наиболее часто она используется для получения фумаровой кислоты.

Обе кислоты обыкновенно получаются при нагревании яблочной кислоты:
![]()
При медленном, осторожном нагревании получается главным образом фумаровая кислота, при более сильном нагревании и при перегонке яблочной кислоты — малеиновая кислота.
Молекула малеиновой кислоты менее стабильна чем фумаровой кислоты. Разница их теплот сгорания равна 22.7 кДж/моль. Также малеиновая кислота хорошо растворима в воде (78.8г/л при 25 °C), а фумаровая кислота — плохо (6.3 г/л при 25 °C). Оба свойства объясняются образованием внутримолекулярных водородных связей в молекуле малеиновой кислоты.
18 Вопрос:
АРОМАТИЧЕСКИЕ:
C6H5COOH – бензойная
Фталевая кислота имеет три изомера, отличающиеся друг от друга взаимным расположением карбоксильных групп -COOH:
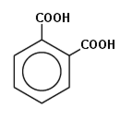
бензол-1,2-дикарбоновая кислота (ортофталевая кислота, или фталевая кислота);
бензол-1,3-дикарбоновая кислота (метафталевая кислота, или изофталевая кислота);
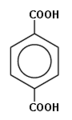
бензол-1,4-дикарбоновая кислота (парафталевая кислота, или терефталевая кислота).
ортофталевая кислота
метафталевая кислота
парафталевая кислота
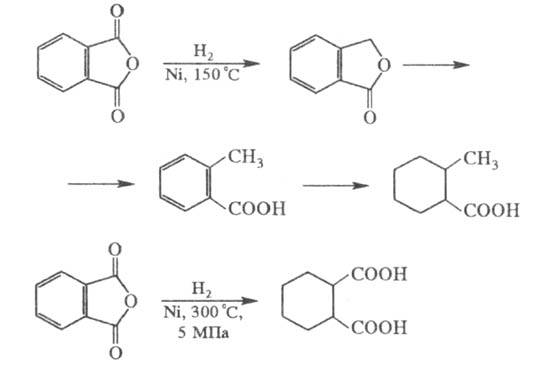
Получение:
С6H5-CH3+KMnO4+KOH→C6H5COOH

Реакция Гриньяра
Из бромбензола по реакции карбоксилирования фенилмагний бромида.
C6H5MgBr + CO2 → C6H5CO2MgBr
C6H5CO2MgBr + HCl → C6H5CO2H + MgBrCl
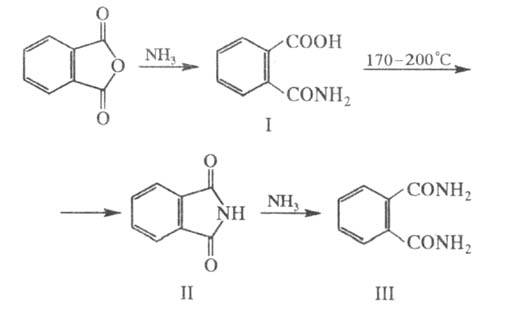
Фталевый ангидрид- ангидрид о-фталевой кислоты. Представляет собой бесцветные кристаллы, практически нерастворимые в воде, умеренно растворимые в органических растворителях. Это важный исходный продукт в производстве различных производных фталевой кислоты, сложных эфиров, фталимида, фталонитрила. Конденсацией фталевого ангидрида с фенолами получают красители, например, фенолфталеин.
Значительное количество фталевого ангидрида используется в производстве гифталевых и пенфталевых смол, промежуточных продуктов и красителей- производных флуоресцеина, родамина и антрахзинона; лекарственных средств, например, фталазола и фенилина (применяется при повышенной свертываемости крови).
Фталевый
ангидрид ( )получают
каталитическим окислением нафталина:
(С5H4-C5H4)
а также о-ксилола воздухом в газовой
сфере. Обладает
св-вами ароматических
соединений.
)получают
каталитическим окислением нафталина:
(С5H4-C5H4)
а также о-ксилола воздухом в газовой
сфере. Обладает
св-вами ароматических
соединений.