
- •1 Вопрос:
- •2 Вид: Классы органических соединений
- •2 Вопрос:
- •3 Вопрос:
- •4 Вопрос:
- •5 Вопрос:
- •6 Вопрос:
- •7 Вопрос:
- •8 Вопрос:
- •Получение гликолей.
- •Химические свойства гликолей.
- •1. С галогенводородными кислотами
- •Применение.
- •Тринитрат Глицерина (Тринитроглицерин).
- •Сложные эфиры высших карбоновых кислот (жиры и масла).
- •10 Вопрос:
- •Вопрос 11. Карбонильные соединения. Реакции альдегидов и кетонов, обусловленные активностью атомов водорода при α-углеродном атоме. Альдольная конденсация.
- •12 Вопрос:
- •13 Вопрос:
- •1.Теоретическая часть.
- •1.2. Физические свойства.
- •1.4. Химические свойства карбоновых кислот.
- •1.4.1. Кислотность
- •1.4.2. Превращение карбоновых кислот в функциональные производные
- •1.4.2.1. Галогенангидриды кислот
- •1.4.2.2. Сложные эфиры карбоновых кислот.
- •1.4.2.3. Ангидриды кислот.
- •1.4.2.4. Амиды кислот.
- •1.4.2.5. Нитрилы карбоновых кислот
- •14 Вопрос:
- •15 Вопрос:
- •16 Вопрос:
- •17 Вопрос:
- •18 Вопрос:
- •19 Вопрос:
- •20 Вопрос:
- •21 Вопрос:
- •22 Вопрос:
- •23 Вопрос:
- •26 Вопрос:
- •27 Вопрос:
- •28 Вопрос:
- •29 Вопрос:
- •Кетонное
- •Кислотное
- •30 Вопрос:
- •31 Вопрос:
- •1. Методы получения
1.4.2.5. Нитрилы карбоновых кислот
Нитрилы – токсичные, бесцветные жидкости, смешивают с водой во всех отношениях, если R = H; СН3; С2Н5; бензонитрил С6Н5СN плохо растворим в воде.
Номенклатура
CH3 – CH2 – CN - нитрил пропионовой кислоты (пропаннитрил
Получение.
1) Окислительный аммонолиз олефинов и др. углеводородов.
R – СН3 + NН3 + 1.5O2 R – С≡ N + 3Н2O
С6Н4(СН3)2![]() СН3 – С6Н4 – С ≡N
NC – С6Н4 – CN
СН3 – С6Н4 – С ≡N
NC – С6Н4 – CN
2) Дегидрирование первичных аминов.
RСН2NН2![]() R– С ≡ N
R– С ≡ N
3) Присоединение синильной кислоты.
НС
≡ СН + НСN
![]() HC = CH – C ≡ N
HC = CH – C ≡ N
акрилонитрил
4) Дегидратация амидов.

5) Из альдоксимов
![]()
6. Взаимодействие галогеналкилов с солями щелочных металлов синильной кислоты
RCl + KCN → RCN + KCl
Химические свойства
1) Кислотный и щелочной гидролиз


2) Восстановление нитрилов
R
– CN + 2H2
![]() R
- CH2 – NH2
R
- CH2 – NH2
3) Взаимодействие с кислотами
R–C≡N
+ R’-COOH
![]() R
– COOH
+ R’-C
≡N
R
– COOH
+ R’-C
≡N
При условии: pK R-COOH < pK R’-COOH
4) Взаимодействие с газообразным хлоридом водорода.

1.4.2.6. Азиды кислот

Получение
1) Из хлорангидрида кислот

2) Взаимодействие гидразидов кислот с азотистой кислотой.
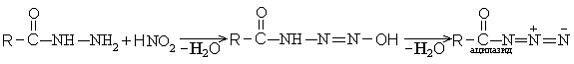
Химические свойства
Реaкция Курциуса

1.4.2.7. Гидразиды кислот.

Получение

где Х=Hlg; OR; NH2; OCOR?
Химические свойства
Гидразиды кислот являются основаниями. С сильными кислотами образуют соли

с азотистой кислотой образуют азиды кислот.
1.4.2.8. Гидроксамовые кислоты

Получение

Химические свойства.
1) Гидроксамовые кислоты не устойчивые при нагревании. Образуют комплексы с d-металлами

2) Разложение под действием Р2О5

1.4.3. Восстановление карбоновых кислот


1.4.4. Декарбоксилирование карбоновых кислот.
Легкость декарбоксилирования зависит от природы кислот:

Введение в ?-положение к карбоксильной группе электроноакцепторных групп облегчает термическое декарбоксилирование.

![]()
Декарбоксилирование серебряных солей в присутствии Br2, Cl2 приводит к образованию аксилгалогенидов (реакция Хунсдикера)
![]()
1.4.5. Реакции ?-углеродных атомов к СООН
1)Реакция Гелля – Фольгарда – Зелинского
CH3CH2COOH + Br2 → CH3CH(Вr)COOH + HBr
Хлор реагирует в присутствии Р аналогично, но менее селективно

Образующие ?-галогенкислоты легко замещаются на нуклеофильные реагенты
2) Реакция нитрование в ?-положение протекает легче, чем у алканов.
CH3 CH2 COOH + HONO2 → CH3 CH(NO2)COOH + Н2О
1.4.6. Реакции электрофильного замещения в ароматическом ряду.
Карбоксильная
группа является ?-электронным акцептором,
поэтому является мета-ориентантом:
2. Примеры синтезов.
Синтез бутилацетата
![]()
Синтез фталимида

Гомологический ряд
Тривиальное название Название по ИЮПАК Формула Название солей
Муравьиная кислота Метановая кислота HCOOH формиаты
Уксусная кислота Этановая кислота CH3COOH ацетаты
Пропионовая кислота Пропановая кислота C2H5COOH пропионаты
Масляная кислота Бутановая кислота C3H7COOH бутираты
Валериановая кислота Пентановая кислота C4H9COOH валераты
Капроновая кислота Гексановая кислота C5H11COOH капраты
Энантовая кислота Гептановая кислота C6H13COOH энантоаты
Каприловая кислота Октановая кислота C7H15COOH каприлаты
Пеларгоновая кислота Нонановая кислота C8H17COOH пеларогоаты
Каприновая кислота Декановая кислота C9H19COOH капринаты
Ундециловая кислота Ундекановая кислота C10H21COOH ундеканоаты
Лауриновая кислота Додекановая кислота C11H23COOH лаураты
Тридекановая кислота C12H25COOH тридеканоаты
Миристиновая к-та Тетрадекановая к-та C13H27COOH миристиаты
Пентадекановая к-та C14H29COOH пентадеканоат
Пальмитиновая к-та Гексадекановая к-та C15H31COOH пальмитаты
Маргариновая к-та Гептадекановая к-та C16H33COOH маргараты
Стеариновая к-та Октадекановая к-та C17H35COOH стеараты
- Нонадекановая кислота C18H37COOH нонадеканоаты
Арахиновая кислота Эйкозановая кислота C19H39COOH арахаты
- Генэйкозановая кислота C20H41COOH генэйкозаноаты
Бегеновая кислота Докозановая к-та C21H43COOH бегенаты
- Трикозановая кислота C22H45COOH трикозаноаты
Лигноцериновая к-та Тетракозановая к-та C23H47COOH лигноцераты
- Пентакозановая кислота C24H49COOH пентакозаноаты
Церотиновая к-та Гексакозановая к-та C25H51COOH церотитаты
- Гептакозановая кислота C26H53COOH гептакозаноаты
Монтановая кислота Октакозановая к-та C27H55COOH монтаноаты
- Нонакозановая кислота C28H57COOH нонакозаноаты
Мелиссовая к-та Триаконтановая к-та C29H59COOH мелиссаты
- Гентриаконтановая кислота C30H61COOH Гентриаконтаноаты
- Дотриаконтановая кислота C31H63COOH Дотриаконтаноаты
Псилластеариловая к-та Тритриаконтановая к-та C32H65COOH псилластеарилаты
Кислотный и щелочной гидролиз нитрилов
Окисление парафиновых углеводородов воздухом или техническим кислородом
Оксосинтез:
Карбоксилирование (карбонизация) металлорганических соединений:
