
- •Лекція вступ
- •32 Г (1 моль) — х л
- •1.2. Хімічний елемент
- •1.3. Основні закони хімії
- •2.1. Періодичний закон і періодична система хімічних елементів д. І. Менделеєва
- •2.1.2. Періодична система елементів
- •2.1.3. Розвиток періодичного закону
- •2.2.2. Характеристика орбіталей
- •2.2.3. Електронні формули
- •2.2.4. Властивості та енергетичні характеристики атомів
- •2.3.2. Ковалентний зв’язок
- •2.3.3. Йонний зв’язок
- •2.3.4. Водневий зв’язок
- •2.3.5. Металічний зв’язок
- •2.3.6. Взаємодія між молекулами
- •2.3.7. Комплексний зв’язок
- •3.1. Енергетика хімічних процесів
- •3.1.3. Ентропія, енергія Гіббса та напрямленість процесів
- •3.2.2. Фактори, що впливають на швидкість реакції
- •3.2.3. Каталіз
- •3.3.2. Хімічна рівновага
- •3.3.3. Принцип Ле Шательє
- •4.1. Розчини. Дисперсні системи
- •4.1.2. Розчини. Розчинність
- •4.1.3. Чисельне вираження складу розчинів
- •4.2.2. Дисоціація води. Водневий показник
- •4.2.3. Буферні розчини
- •4.2.4. Гідроліз солей
- •4.3.2. Ступінь окиснення
- •4.3.3. Теорія окисно-відновних реакцій
- •4.3.4. Найголовніші окисники і відновники
- •4.3.5. Класифікація окисно-відновних реакцій
- •4.3.6. Складання рівнянь окисно-відновних реакцій
- •4.4.2. Електродні потенціали
- •4.4.3. Ряд електрохімічних потенціалів металів
- •4.4.4. Електроліз
- •4.4.5. Корозія та захист металів
- •5.1. Основні класи неорганічних сполук
- •5.1.2. Оксиди
- •5.1.3. Основи
- •5.1.4. Кислоти
- •5.1.5. Амфотерні гідроксиди
- •5.1.7. Солеподібні бінарні сполуки
- •5.1.8. Галоген- і тіоангідриди
- •5.1.9. Металоїди (інтерметалоїди)
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •6.1. Ядерна хімія і радіохімія
- •6.1.2. Ядерні реакції
- •6.1.3. Вплив радіоактивності на біологічні об’єкти
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
2.2.3. Електронні формули
Розподіл електронів в атомі на енергетичних рівнях і підрівнях зображують у вигляді електронних формул. Покажемо, як їх скласти.
Кожний електрон в атомі займає вільну орбіталь з найнижчою енергією, що відповідає найсильнішому зв'язку електрона з ядром,— принцип найменшої енергії. Із збільшенням порядкового номера елемента електрони заповнюють орбіталі і рівні в порядку зростання їхніх енергій: рівні заповнюються від першого до сьомого, а підрівні — в послідовності s — р — d — f. Послідовність зростання енергії визначена дослідним шляхом. Вона називається шкалою енергії. Відповідно до неї складається ряд послідовного заповнення електронами орбіталей aтомів елементів періодичної системи. Цей ряд, в якому вертикальними лініями відокремлейі періоди, позначені зверху римськими цифрами, має вигляд
І II III IV V VI VII
1s | 2s, 2р | 3s, 3р | 4s, 3d, 4р | 5s, 4d, 5р | 6s, 4f, 5d, 6р | 7s, 5f, 6d, 7р
Орбіталь з мінімальною енергією — це 1s-орбіталь. В атома Гідрогену її займає єдиний електрон атома. Тому електронна формула, або електронна конфігурація, атома Гідрогену має вигляд 1s1.
Оскільки на одній орбіталі можуть міститися два лектрони, то обидва електрони атома Гелію розміщуються на 1s-орбіталі. Отже, електронна формула Гелію 1s2. Електронна оболонка не завершена і дуже стійка, це благородний газ.
В елементів II періоду заповнюється L-рівень (n=2), причому спочатку орбіталь s-підрівня, а потім три орбіталі р-підрівня. Третій електрон в атомі 3Lі займає 2s-орбіталь. Електронна формула Lі: 1s22s1. Електрон 2s1 зв'язаний з ядром атома значно слабкіше, ніж 1s-електрони, тому атом Літію може легко втрачати його, утворюючи йон Li+.
В атомі 4Ве четвертий електрон також розміщений на 2s-орбіталі: 1s22s2. Легше ніж інші електрони, у Ве відриваються 2s-електрони з утворенням йона Ве2+.
Оскільки 2s-орбіталь заповнена, то п'ятий електрон в атома 5В займає 2р-орбіталь. Електронна формула атома Бору: 1s22s22р1.
Далі в атомів С, N, О, F заповнюються 2p-орбіталі, закінчується заповнення в атома Ne. Запишемо їх електронні формули:
6С 1s22s22р2, 7N 1s22s22р3, 8О 1s22s22р4, 9F 1s22s22р5, 10Nе 1s22s22р6.
Починаючи з елементів III періоду, в атомів заповнюється третій М-рівень, який складається з 3s-, 3р- і 3d-підрівнів. Наприклад:
11Na 1s22s22р63s1, 17Сl 1s22s22р63s23р5.
Інколи у формулах, які зображують розподіл електронів у атомах, зазначають тільки число електронів на кожному енергетичному рівні. Тоді їх записують так:
11Na — 2 ∙ 8 ∙ 1, 17Сl — 2 ∙ 8 ∙ 7.
Під час написання електронних формул слід ураховувати так зване «проскакування» електрона. Так, електронна формула Хрому повинна бути 1s22s22р63s23р63d44s2. Однак на зовнішньому рівні в атома Хрому не два електрони, а один — другий електрон «проскочив» на d-підрівень другого ззовні рівня. У цьому випадку розташування електронів в атома Хрому таке: 1s22s22р63s23р63d54s1. Це ж саме спостерігається для Nb, Мо та інших елементів. У Рd електрони на рівнях розміщуються так: 2.8.18.18.0 (тут п'ятого енергетичного рівня взагалі немає — обидва електрони «проскочили» на сусідній рівень).
Дуже часто структуру електронних оболонок зображують за допомогою енергетичних, або квантових, комірок — це так звані графічні електронні формули. Кожна така комірка позначається клітиною: клітина — орбіталь, стрілка — електрон, напрям стрілки — напрямленість спіну, вільна клітина — вільна орбіталь, яку може займати електрон під час збудження. Згідно з принципом Паулі, в комірці може перебувати один або два електрони (якщо два електрони, то вони спарені).
Як приклад напишемо схему розподілу електронів у квантових комірках для атома:
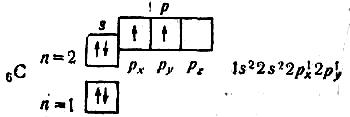
Орбіталі підрівня заповнюються так; спочатку по одному електрону з однаковими спінами, а далі по другому електрону з протилежними спінами. Оскільки на 2р-підрівні три орбіталі з однаковою енергією, то кожний з двох 2р-електронів займає по одній орбіталі (наприклад, pх і pу). Одна орбіталь залишається вільною (pz). В атомі Карбону два неспарених електрони. Справа від схеми в електронній формулі подано більш детальний запис, в якому вказано розподіл електронів на pх і pу-орбіталях. Такий запис теж часто застосовують.
В атомі Нітрогену всі три 2р-орбіталі (pх, pу, pz) зайняті поодинокими електронами:
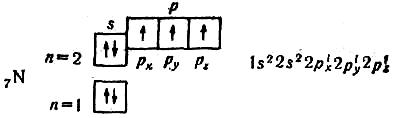
Отже, у нього три неспарених електрони. Це відображено і в детальній електронній формулі (справа від схеми).
Починаючи з атома Оксигену, 2р-орбіталі заповнюються другим електроном з протилежним спіном:
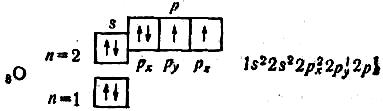
В атомі Оксигену два неспарених електрони. В атомі Флуору — один неспарений електрон:
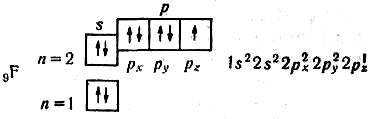
Отже, розподіляючи електрони по квантових комірках, можна виявити число неспарених електронів в атомі. В атомі Nе завершується заповнення другого рівня:
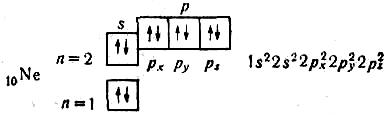
Вісім зовнішніх електронів (s2р6) утворюють дуже стійку структуру з чотирьох двохелектронних хмар. Усі електрони в атомі Неону спарені. Неон — благородний газ.
