- •Лекція вступ
- •32 Г (1 моль) — х л
- •1.2. Хімічний елемент
- •1.3. Основні закони хімії
- •2.1. Періодичний закон і періодична система хімічних елементів д. І. Менделеєва
- •2.1.2. Періодична система елементів
- •2.1.3. Розвиток періодичного закону
- •2.2.2. Характеристика орбіталей
- •2.2.3. Електронні формули
- •2.2.4. Властивості та енергетичні характеристики атомів
- •2.3.2. Ковалентний зв’язок
- •2.3.3. Йонний зв’язок
- •2.3.4. Водневий зв’язок
- •2.3.5. Металічний зв’язок
- •2.3.6. Взаємодія між молекулами
- •2.3.7. Комплексний зв’язок
- •3.1. Енергетика хімічних процесів
- •3.1.3. Ентропія, енергія Гіббса та напрямленість процесів
- •3.2.2. Фактори, що впливають на швидкість реакції
- •3.2.3. Каталіз
- •3.3.2. Хімічна рівновага
- •3.3.3. Принцип Ле Шательє
- •4.1. Розчини. Дисперсні системи
- •4.1.2. Розчини. Розчинність
- •4.1.3. Чисельне вираження складу розчинів
- •4.2.2. Дисоціація води. Водневий показник
- •4.2.3. Буферні розчини
- •4.2.4. Гідроліз солей
- •4.3.2. Ступінь окиснення
- •4.3.3. Теорія окисно-відновних реакцій
- •4.3.4. Найголовніші окисники і відновники
- •4.3.5. Класифікація окисно-відновних реакцій
- •4.3.6. Складання рівнянь окисно-відновних реакцій
- •4.4.2. Електродні потенціали
- •4.4.3. Ряд електрохімічних потенціалів металів
- •4.4.4. Електроліз
- •4.4.5. Корозія та захист металів
- •5.1. Основні класи неорганічних сполук
- •5.1.2. Оксиди
- •5.1.3. Основи
- •5.1.4. Кислоти
- •5.1.5. Амфотерні гідроксиди
- •5.1.7. Солеподібні бінарні сполуки
- •5.1.8. Галоген- і тіоангідриди
- •5.1.9. Металоїди (інтерметалоїди)
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •6.1. Ядерна хімія і радіохімія
- •6.1.2. Ядерні реакції
- •6.1.3. Вплив радіоактивності на біологічні об’єкти
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
2.2.2. Характеристика орбіталей
Якщо йдеться про ту частину електронної хмари (орбіталі), де її густина найбільша, то можна говорити про її розмір і форму. Так, залежно від величини енергії електронні хмари розрізняються за розмірами. Чим сильніше притягається електрон до ядра, тим його хмара (орбіталь) менша за розміром, але щільніша.
Орбіталі (електронні хмари) розрізняються не лише за розмірами, а й за формою. Так, єдиний електрон в атомі Гідрогену, рухаючись навколо ядра, утворює електронну хмару сферичної форми. Орбіталі, що мають форму кулі (сфери), позначають буквою s, а електрони, орбіталі яких мають сферичну форму, називають s-електронами (рис. 2).
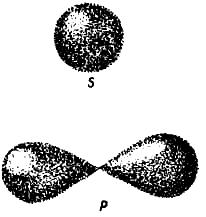
Рис. 2. Форма s- і p-орбіталей
Проте орбіталі (електронні хмари) можуть мати форму гантелі (об’ємної «вісімки») або ще складнішу.
Орбіталі, що мають форму гантелі, позначають буквою р, а електрони, орбіталі яких мають гантелеподібну форму, називають р-електронами.
Центри орбіталей збігаються з центром ядра.
р-орбіталі відрізняються одна від одної розміщенням у просторі: вони розміщуються вздовж трьох взаємно перпендикулярних осей координат (рис. 3). Орбіталі складніших форм позначаються буквами d, f та ін.
Електронні хмари різних форм відрізняються між собою ще й силою притягання до ядра. Так, s-електрони, орбіталі яких мають сферичну форму, притягаються до ядра сильніше, ніж р-електрони, орбіталі яких мають форму гантелі, а електрони з іще складнішими формами орбіталей притягаються ще слабкіше.
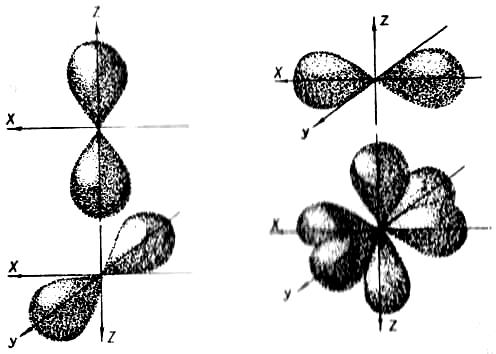
Рис. 3. Схема взаємного розміщення р-орбіталей у просторі
Загальне число електронів у атомі відповідає протонному числу, тобто порядковому номеру елемента, й утворює його електронну оболонку.
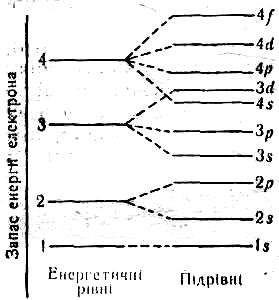
Електрони цієї оболонки мають різний запас енергії, тому одні з них сильніше притягуються до ядра і розміщуються ближче до нього, інші —слабкіше притягуються і розміщуються далі від ядра, тобто положення кожного електрона в атомі відповідає його енергетичному стану. Ось чому електрони розміщуються навколо ядра шарами — так званими електронними шарами (енергетичними рівнями).

 Кожний
електронний шар (енергетичний рівень)
складається з певної кількості орбіталей
(енергетичних підрівнів) певної форми.
Так, перший шар складається з орбіталі
одного типу — однієї s–орбіталі
(s–підрівня).
Другий шар — з орбіталей двох типів —
s
і р
(s-
і р-підрівнів).
Третій шар — з орбіталей трьох типів —
s,
р
і d
(s-,
р-
і d-підрівнів).
Виходить, який
номер шару, стільки є форм орбіталей,
що його утворюють.
Проте число орбіталей на кожному шарі
різне, воно дорівнює n2,
де n
— номер шару. Так, на першому шарі (n
= 1) одна орбіталь, на другому (n
= 2) — чотири, на третьому (n
= 3) — дев’ять і т. д.
Кожний
електронний шар (енергетичний рівень)
складається з певної кількості орбіталей
(енергетичних підрівнів) певної форми.
Так, перший шар складається з орбіталі
одного типу — однієї s–орбіталі
(s–підрівня).
Другий шар — з орбіталей двох типів —
s
і р
(s-
і р-підрівнів).
Третій шар — з орбіталей трьох типів —
s,
р
і d
(s-,
р-
і d-підрівнів).
Виходить, який
номер шару, стільки є форм орбіталей,
що його утворюють.
Проте число орбіталей на кожному шарі
різне, воно дорівнює n2,
де n
— номер шару. Так, на першому шарі (n
= 1) одна орбіталь, на другому (n
= 2) — чотири, на третьому (n
= 3) — дев’ять і т. д.
Орбіталі різні за формою, і на кожній із них може перебувати не більш ніж два електрони, а значить, загальне число електронів певного електронного шару дорівнює 2n2, де n — номер шару.
Отже,
1–й шар складається з однієї s–орбіталі;
2–й шар складається з однієї s–орбіталі і трьох р–орбіталей;
3–й шар складається з однієї s–орбіталі, трьох р–орбіталей і п'яти d–орбіталей.
Знаючи будову електронних шарів, можна уявити структуру всієї електронної оболонки атома. Для цього необхідно знати правила заповнення електронами вільних орбіталей. Ці правила подано нижче.
1. Електрони заповнюють електронні шари у порядку послаблення притягання їх до ядра (від 1–го до наступних).
 2.
Заповнення електронами орбіталей
кожного шару відбувається також у
порядку послаблення зв’язку з ядром:
спочатку заповнюються s–орбіталі,
потім р–орбіталі,
далі наступні.
2.
Заповнення електронами орбіталей
кожного шару відбувається також у
порядку послаблення зв’язку з ядром:
спочатку заповнюються s–орбіталі,
потім р–орбіталі,
далі наступні.
3. На кожній орбіталі може перебувати не більш ніж два електрони.
4. Електрони заповнюють орбіталі спочатку по одному, а якщо електронів більше за число орбіталей — то по два, тоді утворюються електронні пари.
Нижче подано схему поділу електронних шарів (енергетичних рівнів) на орбіталі (підрівні).