
- •Лекція вступ
- •32 Г (1 моль) — х л
- •1.2. Хімічний елемент
- •1.3. Основні закони хімії
- •2.1. Періодичний закон і періодична система хімічних елементів д. І. Менделеєва
- •2.1.2. Періодична система елементів
- •2.1.3. Розвиток періодичного закону
- •2.2.2. Характеристика орбіталей
- •2.2.3. Електронні формули
- •2.2.4. Властивості та енергетичні характеристики атомів
- •2.3.2. Ковалентний зв’язок
- •2.3.3. Йонний зв’язок
- •2.3.4. Водневий зв’язок
- •2.3.5. Металічний зв’язок
- •2.3.6. Взаємодія між молекулами
- •2.3.7. Комплексний зв’язок
- •3.1. Енергетика хімічних процесів
- •3.1.3. Ентропія, енергія Гіббса та напрямленість процесів
- •3.2.2. Фактори, що впливають на швидкість реакції
- •3.2.3. Каталіз
- •3.3.2. Хімічна рівновага
- •3.3.3. Принцип Ле Шательє
- •4.1. Розчини. Дисперсні системи
- •4.1.2. Розчини. Розчинність
- •4.1.3. Чисельне вираження складу розчинів
- •4.2.2. Дисоціація води. Водневий показник
- •4.2.3. Буферні розчини
- •4.2.4. Гідроліз солей
- •4.3.2. Ступінь окиснення
- •4.3.3. Теорія окисно-відновних реакцій
- •4.3.4. Найголовніші окисники і відновники
- •4.3.5. Класифікація окисно-відновних реакцій
- •4.3.6. Складання рівнянь окисно-відновних реакцій
- •4.4.2. Електродні потенціали
- •4.4.3. Ряд електрохімічних потенціалів металів
- •4.4.4. Електроліз
- •4.4.5. Корозія та захист металів
- •5.1. Основні класи неорганічних сполук
- •5.1.2. Оксиди
- •5.1.3. Основи
- •5.1.4. Кислоти
- •5.1.5. Амфотерні гідроксиди
- •5.1.7. Солеподібні бінарні сполуки
- •5.1.8. Галоген- і тіоангідриди
- •5.1.9. Металоїди (інтерметалоїди)
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •6.1. Ядерна хімія і радіохімія
- •6.1.2. Ядерні реакції
- •6.1.3. Вплив радіоактивності на біологічні об’єкти
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
2.1.3. Розвиток періодичного закону
Періодичний закон і періодична система елементів Д. І. Менделєєва відіграли і відіграють велику роль у розвитку хімічної науки. Вони допомагають хімікам орієнтуватись у безлічі фактів. Однак подальші успіхи науки не можна було б уявити без розкриття фізичного змісту періодичного закону.
В період відкриття періодичного закону і в більш пізні часи хімічні елементи розглядались у тісному зв'язку з поглядами про неподільність атомів. Проте уявлення про неподільність атомів не давало змоги зрозуміти внутрішню причину періодичності та послідовності зміни властивостей елементів залежно від їхніх протонних чисел. Атом справді не ділиться під час перебігу всіх хімічних реакцій. Принцип неподільності атомів відіграв позитивну роль у розвитку науки; незмінність, стабільність маси атома була однією з вихідних ідей Д. І. Менделєєва. Проте досить закономірно, що після завершення побудови атомістики на фундаменті неподільності атома виникла проблема його внутрішньої структури. Діалектика розвитку науки привела до заперечення того, що становило лише одну із стадій пізнання. Разом з тим пізнання будови атома було б неможливим, якби не існувало атомістичної теорії, що виходила з принципу неподільності атома. Саме періодичний закон і відкрив шлях до пізнання надр атома, і систематизація нових фактів (відкриття радіоактивності, електрона, теорія Бора тощо) набула логічної основи після того, як була зіставлена з періодичним законом.
Ще в 1886 р. великий російський вчений О. М. Бутлеров висловив думку про те, що атом подільний. Аналогічні думки майже одночасно з О. М. Бутлеровим висловлював російський вчений М. О. Морозов. Проте ці припущення на той час не могли бути підтверджені експериментальними даними.
В кінці минулого століття було встановлено ряд фактів, які свідчили про складність будови атомів. Це, насамперед, відкриття електрона англійським фізиком Дж. Томсоном у 1897 р., встановлення факту, що електрони можна пилучити з будь-якого елемента, їх випускають багато речовин під час нагрівання, освітлення, рентгенівського опромінювання, а також того, що електрони є переносниками електричного струму в металах. Отже, електрони є в атомах усіх елементів.
Електрон — це елементарна частинка з найменшим негативним електричним зарядом, який тільки може існувати (1,602 ∙ 10-19 Кл); маса електрона дорівнює 9,1∙10-31 кг. Атом електронейтральний. Отже, крім електронів в атомах повинні бути позитивно заряджені частинки.
Велику роль у розвитку теорії будови атома відіграло відкриття явища радіоактивності, вперше виявленого у сполук Урану французьким фізиком Л. Беккерелем у 1896 р. А в 1898 р. Марія Кюрі-Склодовська та П'єр Кюрі відкрили в уранових рудах два нових радіоактивних елементи — Полоній і Радій, які мали більшу радіоактивність, ніж Уран і Торій.
Радіоактивність — це явище випромінювання деякими елементами невидимого проміння, здатного проникати крізь різні речовини, в тім числі й метали, засвічувати фотоплівку, йонізувати гази.
У вивченні радіоактивності велика заслуга видатного англійського фізика Е. Резерфорда, який у 1899 р. довів, що радіоактивне випромінювання неоднорідне — під дією магнітного поля воно поділяється на три пучки: α-, β- і γ-промені. Ці промені відрізняються за проникною здатністю, а також за здатністю до взаємодії з електричним полем.
α-Промені — це потік позитивно заряджених частинок, маса яких дорівнює масі атома Гелію, а заряд цих частинок вдвічі більший, ніж заряд електрона.
β-Промені — це потік електронів, швидкість їх руху близька до швидкості Світла.
γ-Промені — жорсткі електромагнітні коливання, подібні до рентгенівських променів, вони мають дуже велику проникну здатність.
Вивчення радіоактивності підтвердило складність будови атомів.
У 1903 р. англійський фізик Дж. Томсон запропонував модель будови атома. Згідно з цією моделлю атом складається з позитивного заряду, рівномірно розподіленого по всьому об'єму атома, та електронів, що коливаються всередині цього заряду.
Видатний англійський фізик Е. Резерфорд з метою перевірки гіпотези Дж. Томсона виконав серію дослідів з розсіювання α-частинок тонкими металевими пластинками. Дослідження навело Е. Резерфорда на думку, що в атомі є важке ядро, яке займає дуже малу частку простору і в якому зосереджена переважна частина всієї маси атома; воно повинно мати позитивний заряд, оскільки відштовхує однойменно заряджені α-частинки.
Виходячи з цих міркувань, Е. Резерфорд у 1911 р. запропонував так звану ядерну (планетарну) модель будови атома, згідно з якою атом складається з позитивно зарядженого ядра, в якому зосереджена майже вся маса атома, та електронів, які обертаються навколо ядра. Сумарний негативний заряд електронів чисельно дорівнює позитивному заряду ядра. Діаметр ядра у 10 000 — 100 000 разів менший, ніж діаметр атома в цілому.
Е. Резерфорд обчислив також і заряд ядра. З його дослідів виходило, що заряд ядра (виражений в одиницях заряду електрона) чисельно дорівнює протонному числу елемента в періодичній системі. Пізніше (1913 р.) це підтвердив Г. Мозлі (закон Мозлі), виявивши простий зв'язок між довжинами хвиль певних ліній рентгенівського спектра елемента і його протонним числом.
Закон Мозлі давав змогу визначати точні значення протонних чисел маловивчених і ще не відкритих елементів і тим самим сприяв розвитку періодичного закону.
Англійський вчений Д. Чедвік у 1920 р. за розсіюванням α-частинок з великою точністю визначив заряди атомних ядер деяких елементів.
Протонне число є дуже важливою характеристикою елемента, воно виражає позитивний заряд ядра його атома. Виходячи з електронейтральності атома, можна дійти висновку, що й число електронів, які обертаються навколо ядра, дорівнює протонному числу елемента. Отже, заряд атомного ядра є тією основною величиною, від якої залежать властивості елемента і його розміщення в періодичній системі. Тому періодичний закон Менделєєва слід формулювати так: властивості елементів, а також утворених ними простих і складних речовин перебувають у періодичній залежності від величини зарядів ядер атомів елементів.
Запитання і завдання для контролю і самоконтролю знань
1. Охарактеризуйте найбільш вдалі спроби класифікації хімічних елементів до відкриття періодичного закону Д. І. Менделєєвим.
2. Зміст періодичного закону Д. І. Менделєєва. В чому полягає відмінність змісту періодичного закону від його формулювання?
3. Яка суть ранніх уявлень про складність структури атома?
Лекція 2.2. БУДОВА АТОМА
План
2.2.1. Сучасна модель стану електрона в атомі
2.2.2. Характеристика обіталей
2.2.3. Електронні формули
2.2.4. Властивості та енергетичні характеристики атомів
Література
/1/ - Романова Н. В. Загальна та неорганічна хімія. – К.: Ірпінь, ВТФ
«Перун», 2002. – 480 с. (Розділ 2. § 3.2-3.4).
/2/ - Глинка Н. Л. Общая химия. – Л.: Химия, 1987. – 704 с. (Глава ІІІ.
§ 20-37).
2.2.1. Сучасна модель стану електрона в атомі
Під час хімічних реакцій ядро атома не змінюється. Змін зазнають електронні оболонки атомів, будовою яких пояснюється багато властивостей хімічних елементів. Тому стану електронів в атомі і структурі електронних оболонок завжди приділяється велика увага при вивченні хімії.
Стан електрона в атомі описується квантового механікою, яка вивчає рух і взаємодію мікрочастинок, тобто елементарних частинок, атомів, молекул і атомних ядер. Згідно з уявленнями квантової механіки, мікрочастинки мають хвильову природу, а хвилі виявляють властивості частинок. Відносно електрона молена сказати, що він поводить себе і як частинка, і як хвиля, тобто виявляє, як і інші мікрочастинки, корпускулярно-хвильовий дуалізм (двоїстість). З одного боку, електрони як частинки чинять тиск, з другого, — потік електронів, що рухаються, супроводжується хвильовими явищами, наприклад дифракцією електронів.
Електрон в атомі не має траєкторії руху. Квантова механіка розглядає ймовірність знаходження електрона в просторі навколо ядра. Електрон, який швидко рухається, може знаходитись у будь-якій частині простору, що оточує ядро, і різні положення його розглядаються як електронна хмара з певною густиною негативного заряду. Більш наочно це можна представити так. Якби вдалося через дуже малі проміжки часу одержувати знімок положення електрона в атомі (він відобразиться на ньому у вигляді точки), то при накладанні великої кількості таких знімків можна було б одержати картину електронної хмари. І там, де точок найбільше, хмара має найбільшу густину. Максимальна густина відповідає ймовірності знаходження електрона в даній частині атомного простору. На рис. 1 зображено модель поперечного перерізу атома Гідрогену з точки зору квантової механіки. Видно, що поблизу ядра електронна густина практично дорівнює нулю, тобто електрон тут майже не буває. В міру віддалення від ядра електронна густина зростає і досягає максимального значення на віддалі 0,053 нм, а потім поступово спадає. Значить, найбільш імовірне знаходження електрона, що рухається, на віддалі 0,053 нм від ядра (на рисунку темніші місця). Чим міцніше зв'язаний електрон з ядром, тим більшу густину за розподілом заряду і тим менші розміри повинна мати електронна хмара.
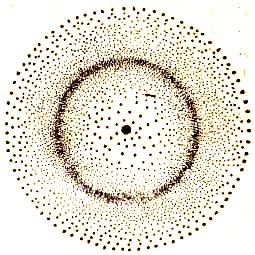
Рис. 1. Електронна хмара Гідрогену з нерівномірною густиною
Простір навколо ядра, в якому знаходження електрона найбільш імовірне, називається орбіталлю.
У ньому міститься ~ 90 % електронної хмари. Це означає, що близько 90 % часу електрон знаходиться в цій частині простору. Орбіталі атома мають різні розміри. Очевидно, що електрони, що рухаються в орбіталях меншого розміру, сильніше притягуються ядром, ніж електрони, що рухаються в орбіталях більшого розміру. Електрони, які рухаються в орбіталях близьких розмірів, утворюють електронні шари. Електронні шари називають також енергетичними рівнями. Енергетичні рівні нумерують, починаючи від ядра: 1, 2, 3, 4, 5, 6, 7. Іноді їх позначають буквами відповідно К, L, М, N, О, Р, Q.
Ціле число n, яке означає номер рівня, називається головним квантовим числом. Воно характеризує енергію електронів, що займають даний енергетичний рівень. Найменшу енергію мають електрони першого енергетичного рівня, найближчого до ядра. Порівняно з електронами першого рівня електрони наступних рівнів характеризуються більшим запасом енергії. Очевидно, слабкіше зв'язані з ядром електрони зовнішнього рівня.
Число енергетичних рівнів в атомі, заповнених електронами, чисельно дорівнює номеру періоду, в якому знаходиться елемент: в атомів елементів І періоду — один енергетичний рівень, II періоду—два, III періоду — три і т. д. Найбільше число електронів на енергетичному рівні дорівнює подвоєному квадрату номера рівня, тобто
N = 2n2, (2.2.1)
де N — число електронів; n — номер рівня (рахуючи від ядра), або головне квантове число.
Відповідно до рівняння (2.2.1), на першому, найближчому до ядра енергетичному рівні може розміститися не більше 2 електронів, на другому — не більше 8, на третьому — не більше 18, на четвертому — не більше 32.
Крім обертання навколо ядра, електрон має ще свій власний рух — спін. Спрощено спін (від англ. sріn — обертання) можна уявити як рух електрона навколо власної осі. Якщо два електрони мають однакові напрямки обертання, то говорять, що це електрони з паралельними спінами, а якщо напрямки обертання у них протилежні (один електрон обертається навколо власної осі за годинниковою стрілкою, а інший — проти годинникової стрілки), то це електрони з антипаралельними (протилежними) спінами. Два електрони з протилежними спінами створюють навколо себе магнітне поле з протилежно спрямованими силовими лініями. Це забезпечує умови для взаємного притягання електронів.
На одній орбіталі може перебувати лише два електрони, які мають протилежні (антипаралельні) спіни.
Схематично атомну орбіталь позначають так:
![]()
де квадрат — це орбіталь, а стрілки — електрони з антипаралельними спінами.
 Одноелектронна
орбіталь зображується так:
Одноелектронна
орбіталь зображується так:
![]()
