
- •Лекція вступ
- •32 Г (1 моль) — х л
- •1.2. Хімічний елемент
- •1.3. Основні закони хімії
- •2.1. Періодичний закон і періодична система хімічних елементів д. І. Менделеєва
- •2.1.2. Періодична система елементів
- •2.1.3. Розвиток періодичного закону
- •2.2.2. Характеристика орбіталей
- •2.2.3. Електронні формули
- •2.2.4. Властивості та енергетичні характеристики атомів
- •2.3.2. Ковалентний зв’язок
- •2.3.3. Йонний зв’язок
- •2.3.4. Водневий зв’язок
- •2.3.5. Металічний зв’язок
- •2.3.6. Взаємодія між молекулами
- •2.3.7. Комплексний зв’язок
- •3.1. Енергетика хімічних процесів
- •3.1.3. Ентропія, енергія Гіббса та напрямленість процесів
- •3.2.2. Фактори, що впливають на швидкість реакції
- •3.2.3. Каталіз
- •3.3.2. Хімічна рівновага
- •3.3.3. Принцип Ле Шательє
- •4.1. Розчини. Дисперсні системи
- •4.1.2. Розчини. Розчинність
- •4.1.3. Чисельне вираження складу розчинів
- •4.2.2. Дисоціація води. Водневий показник
- •4.2.3. Буферні розчини
- •4.2.4. Гідроліз солей
- •4.3.2. Ступінь окиснення
- •4.3.3. Теорія окисно-відновних реакцій
- •4.3.4. Найголовніші окисники і відновники
- •4.3.5. Класифікація окисно-відновних реакцій
- •4.3.6. Складання рівнянь окисно-відновних реакцій
- •4.4.2. Електродні потенціали
- •4.4.3. Ряд електрохімічних потенціалів металів
- •4.4.4. Електроліз
- •4.4.5. Корозія та захист металів
- •5.1. Основні класи неорганічних сполук
- •5.1.2. Оксиди
- •5.1.3. Основи
- •5.1.4. Кислоти
- •5.1.5. Амфотерні гідроксиди
- •5.1.7. Солеподібні бінарні сполуки
- •5.1.8. Галоген- і тіоангідриди
- •5.1.9. Металоїди (інтерметалоїди)
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •6.1. Ядерна хімія і радіохімія
- •6.1.2. Ядерні реакції
- •6.1.3. Вплив радіоактивності на біологічні об’єкти
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
5.3.2. Фізичні та хімічні властивості неметалів
5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
Література
/1/ - Григор’єва В.В., Самійленко В.Н., Сич А.М., Голуб О.А. Загальна хімія.
– К.: Вища школа, 2009. – 471 с.
/2/ - Попель П.П., Крикля Л.С. Хімія. Підручник для загальноосвітніх
навчальних закладів. Академічний рівень. Рівень стандарту, 10 кл.
/3/ - Романова Н.В. Загальна та неорганічна хімія. – К.: Ірпінь, ВТФ
«Перун», 2002. – 480 с. (Частина 1. Розділ 8. § 7.1-7.9).
/4/ - Ярошенко О.Г. Хімія. Підручн. для 10 кл. загальноосвіт. навч. закл.
(рівень стандарту, академічний рівень). К.: Грамота, 2010. – К.;
Видавничий центр «Академія», 2010.
/5/ - Глинка Н.Л. Общая химия. – Л.: Химия, 1987. – 704 с. (Глава 1. § 37).
5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
Скористаємось фрагментом періодичної системи хімічних елементів Д. І. Менделєєва (рис. 9).
Неметалічні елементи – це ряд р–елементів VII, VI, V, IV груп, Бор – елемент ІІІ групи та Гідроген s–елемент І групи періодичної системи елементів. Атоми неметалічних елементів мають на зовнвшньому енергетичному рівні чотири електрони і більше (у Гідрогену – один, у Бору – три). Неметалічні елементи утворюють прості речовини – неметали.
Особливості будови атомів неметалічних хімічних елементів розглянемо на прикладі елементів одного періоду й однієї підгрупи.
Приклад 1. Неметалічні елементи одного періоду.
Неметалічні елементи Бор, Карбон, Нітроген, Оксиген, Флуор і Неон належать до другого періоду періодичної системи хімічних елементів і мають такі електронні формули атомів:
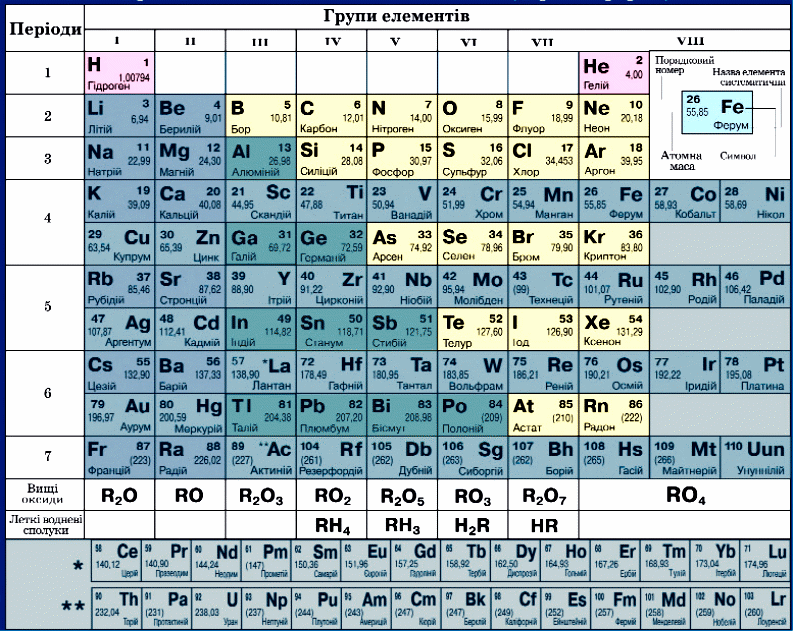
Рис 9. Розміщення неметалічних елементів у періодичній системі хімічних елементів
5В 1s2 2s2 2p1
6C 1s2 2s2 2p2
7N 1s2 2s2 2p3
8О 1s2 2s2 2p4
9F 1s2 2s2 2p5
10Ne 1s2 2s2 2p6
За цими формулами чітко простежується однакова будова першого енергетичного рівня неметалічних елементів другого періоду й поступове збільшення числа електронів на другому (зовнішньому) енергетичному рівні, доки останній елемент Неон не досягне завершеності зовнішнього енергетичного рівня. Починаючи з Нітрогену, в атомах цих хімічних елементів спостерігається поступове зменшення кількості неспарених електронів на зовнішньому енергетичному рівні. Так, атом Нітрогену здатний утворити три спільні електронні пари з іншими атомами, Оксигену – дві, Флуору – одну. В атомі Неону відсутні неспарені електрони, і він не утворює хімічних зв’язків з іншими атомами.
Розглянуті приклади доводять, що атоми неметалічних елементів другого періоду мають по 2 енергетичних рівні, але відрізняються кількістю електронів на зовнішньому енергетичному рівні.
Особливістю атомів неметалічних елементів є те, що кількість електронів на зовнішньому енергетичному рівні збігається з номером групи. Тому без запису електронної формули атома, наприклад, неметалічного елемента VII групи Астату можна з упевненістю сказати, що з 85 електронів його електронної оболонки 7 містяться на зовнішньому енергетичному рівні.
Приклад 2. Неметалічні елементи однієї підгрупи.
Карбон і Силіцій розташовані в IV групі в головній підгрупі періодичної системи хімічних елементів, тобто є елементами однієї групи й підгрупи. Напишемо електронну формулу атома Силіцію: 14Si 1s22s22p6 3s23p2.
Скористаємося електронною й графічною електронною формулами атома Карбону й порівняємо електронні формули атомів цих хімічних елементів. Результати порівняння вказують на те, що електронні оболонки їх атомів відрізняються кількістю енергетичних рівнів, проте на зовнішньому енергетичному рівні в них однакова кількість електронів і вона чисельно дорівнює номеру групи.
Електронні формули атомів Карбону і Силіцію свідчать, що неметалічні елементи IV групи головної підгрупи мають однакову будову зовнішнього енергетичного рівня і кількість електронів на ньому дорівнює половині електронів зовнішнього завершеного восьмиелектронного енергетичного рівня.
Знання будови атомів і місця в періодичній системі неметалічних елементів дають змогу давати їх загальну характеристику із зазначенням групи, підгрупи, періоду, ряду, будови атома, формул летких водневих сполук, оксидів із найвищим ступенем окиснення.
Приклад 3. Характеристика неметалічного елемента за будовою атома й розміщенням у періодичній системі.
Хімічний елемент з протонним числом 52 – Телур Те – розташований у періодичній системі хімічних елементів у п’ятому періоді, сьомому ряді, VI групі, головній підгрупі.
Відносна атомна маса 128. Ядро атома має заряд +52 і складається з 52 протонів і 76 нейтронів (128 – 52 = 76). Електронна оболонка атома налічує 52 електрони, які розташовані на п’ятьох енергетичних рівнях. На зовнішньому енергетичному рівні є 6 електронів, тому максимальна валентність Телуру 6, максимальний ступінь окиснення +6.
Формула вищого оксиду – ТеО3. Оскільки Телур – аналог (так називають елементи однієї підгрупи) Оксигену і Сульфуру, то це дає змогу записати електронну конфігурацію зовнішнього енергетичного рівня як …5s2 5p4 .
Якщо зобразити графічну електронну формулу зовнішнього енергетичного рівня то можна побачити, що для його завершення не вистачає 2 електронів, тому з Гідрогеном Телур утворює сполуку Н2Те.
