
- •Лекція вступ
- •32 Г (1 моль) — х л
- •1.2. Хімічний елемент
- •1.3. Основні закони хімії
- •2.1. Періодичний закон і періодична система хімічних елементів д. І. Менделеєва
- •2.1.2. Періодична система елементів
- •2.1.3. Розвиток періодичного закону
- •2.2.2. Характеристика орбіталей
- •2.2.3. Електронні формули
- •2.2.4. Властивості та енергетичні характеристики атомів
- •2.3.2. Ковалентний зв’язок
- •2.3.3. Йонний зв’язок
- •2.3.4. Водневий зв’язок
- •2.3.5. Металічний зв’язок
- •2.3.6. Взаємодія між молекулами
- •2.3.7. Комплексний зв’язок
- •3.1. Енергетика хімічних процесів
- •3.1.3. Ентропія, енергія Гіббса та напрямленість процесів
- •3.2.2. Фактори, що впливають на швидкість реакції
- •3.2.3. Каталіз
- •3.3.2. Хімічна рівновага
- •3.3.3. Принцип Ле Шательє
- •4.1. Розчини. Дисперсні системи
- •4.1.2. Розчини. Розчинність
- •4.1.3. Чисельне вираження складу розчинів
- •4.2.2. Дисоціація води. Водневий показник
- •4.2.3. Буферні розчини
- •4.2.4. Гідроліз солей
- •4.3.2. Ступінь окиснення
- •4.3.3. Теорія окисно-відновних реакцій
- •4.3.4. Найголовніші окисники і відновники
- •4.3.5. Класифікація окисно-відновних реакцій
- •4.3.6. Складання рівнянь окисно-відновних реакцій
- •4.4.2. Електродні потенціали
- •4.4.3. Ряд електрохімічних потенціалів металів
- •4.4.4. Електроліз
- •4.4.5. Корозія та захист металів
- •5.1. Основні класи неорганічних сполук
- •5.1.2. Оксиди
- •5.1.3. Основи
- •5.1.4. Кислоти
- •5.1.5. Амфотерні гідроксиди
- •5.1.7. Солеподібні бінарні сполуки
- •5.1.8. Галоген- і тіоангідриди
- •5.1.9. Металоїди (інтерметалоїди)
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •6.1. Ядерна хімія і радіохімія
- •6.1.2. Ядерні реакції
- •6.1.3. Вплив радіоактивності на біологічні об’єкти
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
5.2.2. Фізичні та хімічні властивості металів
5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
Література
/1/ - Григор’єва В.В., Самійленко В.Н., Сич А.М., Голуб О.А. Загальна хімія.
– К.: Вища школа, 2009. – 471 с.
/2/ - Попель П.П., Крикля Л.С. Хімія. Підручник для загальноосвітніх
навчальних закладів. Академічний рівень. Рівень стандарту, 10 кл.
/3/ - Романова Н.В. Загальна та неорганічна хімія. – К.: Ірпінь, ВТФ
«Перун», 2002. – 480 с. (Частина 1. Розділ 8. § 7.1-7.9).
/5/ - Ярошенко О.Г. Хімія. Підручн. для 10 кл. загальноосвіт. навч. закл.
(рівень стандарту, академічний рівень). К.: Грамота, 2010. – К.;
Видавничий центр «Академія», 2010.
/6/ - Глинка Н.Л. Общая химия. – Л.: Химия, 1987. – 704 с. (Глава 1. § 37).
5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
Металічних елементів існує значно більше, ніж неметалічних. До них належать усі d- і f-елементи, а також s-елементи (крім Гідрогену і Гелію) та кілька р-елементів. У довгому варіанті періодичної системи металічні елементи займають ліву і центральну частини:
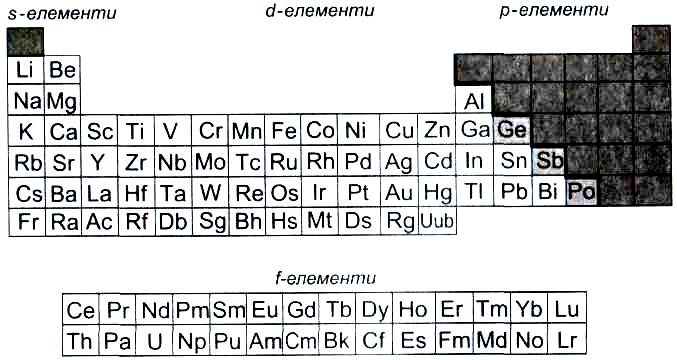
У природі металічні елементи трапляються досить часто. Найбільше металічних елементів містить літосфера. Найпоширенішим серед них є Алюміній. Елементи, які утворюють активні метали, містяться переважно в хлоридних, карбонатних, сульфатних і силікатних мінералах, інші – в оксидних і сульфідних мінералах; дуже рідко трапляються самородні мідь, срібло, золото, платина (рис. 6).

Рис. 6. Природні речовини, утворені металічними елементами
У гідросфері також багато металічних елементів, але у значно менших кількостях. У воді морів і океанів переважає Натрій, а у прісній воді – Кальцій.
Металічні елементи містяться і в живих організмах. Натрій і Калій входять до складу усіх клітин, Магній є у хлорофілі, а Ферум – у гемоглобіні. Сполуки Кальцію становлять неорганічну основу кісток, зубів, яєчної шкаралупи, черепашок.
В атомі будь-якого металічного елемента на зовнішньому енергетичному рівні перебуває невелика кількість електронів (як правило, від одного до трьох). Такий атом може віддавати ці електрони й перетворюватися на позитивно заряджений йон (катіон):
М – nе- = Мn+
Здатність атомів металічних елементів втрачати електрони зростає зі збільшенням радіусів атомів: у періоді – справа наліво, а в групі – згори донизу. Типові металічні елементи розміщені в лівому нижньому куті періодичної системи. Серед них – Цезій; його атом найлегше втрачає електрон.
Прості катіони металічних елементів входять до складу відповідних оксидів, основ, солей. Значення зарядів таких йонів для елементів головних підгруп І—III груп збігаються з номерами груп: Nа+, Мg2+, Аl3+. Подібної закономірності для елементів побічних підгруп немає. Наприклад, елемент І групи Купрум утворює катіони Сu+ і Сu2+, а елемент VIII групи Ферум – катіони Fе2+ i Fе3+.
Атоми деяких металічних елементів здатні утворювати ковалентні зв'язки з атомами неметалічних елементів. Результатом цього є існування відповідних складних аніонів (наприклад, МnО4¯) або молекул (СгОз).
Металічні елементи утворюють прості речовини — метали. За звичайних умов вони перебувають у твердому стані (крім ртуті) і є кристалічними речовинами.
За зовнішнім виглядом (рис. 7) і властивостями метали дуже схожі. Це зумовлено наявністю в них хімічного зв'язку особливого типу.

Рис.7. Метали
Атоми в кожному металі розміщені дуже щільно. Унаслідок цього зовнішні орбіталі сусідніх атомів перекриваються. Електрони, що перебувають у таких орбіталях, відокремлюються від «своїх» атомів і починають хаотично рухатись у речовині (рис.8).
Рис. 8. Спрощена модель будови металу
Ці електрони називають делокалізованими, або усуспільненими. Атоми, втрачаючи електрони, перетворюються на катіони.
Зв'язок між катіонами в металі, здійснюваний за допомогою делокалізованих електронів, називають металічним зв'язком.
