
- •Лекція вступ
- •32 Г (1 моль) — х л
- •1.2. Хімічний елемент
- •1.3. Основні закони хімії
- •2.1. Періодичний закон і періодична система хімічних елементів д. І. Менделеєва
- •2.1.2. Періодична система елементів
- •2.1.3. Розвиток періодичного закону
- •2.2.2. Характеристика орбіталей
- •2.2.3. Електронні формули
- •2.2.4. Властивості та енергетичні характеристики атомів
- •2.3.2. Ковалентний зв’язок
- •2.3.3. Йонний зв’язок
- •2.3.4. Водневий зв’язок
- •2.3.5. Металічний зв’язок
- •2.3.6. Взаємодія між молекулами
- •2.3.7. Комплексний зв’язок
- •3.1. Енергетика хімічних процесів
- •3.1.3. Ентропія, енергія Гіббса та напрямленість процесів
- •3.2.2. Фактори, що впливають на швидкість реакції
- •3.2.3. Каталіз
- •3.3.2. Хімічна рівновага
- •3.3.3. Принцип Ле Шательє
- •4.1. Розчини. Дисперсні системи
- •4.1.2. Розчини. Розчинність
- •4.1.3. Чисельне вираження складу розчинів
- •4.2.2. Дисоціація води. Водневий показник
- •4.2.3. Буферні розчини
- •4.2.4. Гідроліз солей
- •4.3.2. Ступінь окиснення
- •4.3.3. Теорія окисно-відновних реакцій
- •4.3.4. Найголовніші окисники і відновники
- •4.3.5. Класифікація окисно-відновних реакцій
- •4.3.6. Складання рівнянь окисно-відновних реакцій
- •4.4.2. Електродні потенціали
- •4.4.3. Ряд електрохімічних потенціалів металів
- •4.4.4. Електроліз
- •4.4.5. Корозія та захист металів
- •5.1. Основні класи неорганічних сполук
- •5.1.2. Оксиди
- •5.1.3. Основи
- •5.1.4. Кислоти
- •5.1.5. Амфотерні гідроксиди
- •5.1.7. Солеподібні бінарні сполуки
- •5.1.8. Галоген- і тіоангідриди
- •5.1.9. Металоїди (інтерметалоїди)
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •6.1. Ядерна хімія і радіохімія
- •6.1.2. Ядерні реакції
- •6.1.3. Вплив радіоактивності на біологічні об’єкти
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
4.3.6. Складання рівнянь окисно-відновних реакцій
При складанні рівнянь ОВР застосовуються два методи — метод електронного балансу і метод йонно-електронний (метод напівреакцій).
За допомогою методу електронного балансу розрахунок кількостей прийнятих і відданих електронів здійснюється відповідно до значень ступенів окиснення атомів до і після реакції. Послідовність дій при цьому методі така:
1. Скласти схему реакції із зазначенням вихідних речовин і продуктів реакції.
2. Визначити ступінь окиснення атомів у речовинах правої і лівої частин схеми; зазначити атоми, ступінь окиснення яких змінюється.
3. Скласти рівняння процесів окиснення і відновлення; знайти баланс кількості електронів, відданих при окисненні і прийнятих при відновленні, шляхом уведення множників, що визначають з найменшого кратного для коефіцієнтів у процесах окиснення і відновлення.
4. Розставити отримані окисно-відновні коефіцієнти в схемі реакції.
5. Розставити відсутні коефіцієнти перед формулами всіх речовин у лівій і правій частинах рівняння і перевірити матеріальний баланс рівняння.
П р и к л а д. Складання рівняння окисно-відновної реакції магнію з розведеною нітратною кислотою.
1. Записуємо схему реакції:
Мg + НNO3 → Мg(NO3)2 + N2O + Н2O.
2. Знаходимо окисник і відновник:
0 +5 -2 +1
Мg + НNO3 → Мg(NO3)2 + N2O + Н2O.
Мg — відновник, НNO3 — окисник.
3. Складаємо рівняння електронного балансу:
 Відновник
Мgº – 2еˉ = Мg+2
4
– окиснення
Відновник
Мgº – 2еˉ = Мg+2
4
– окиснення
8
Окисник 2N+5 + 8еˉ = 2N+1 1 – відновлення
Для напівреакції окиснення коефіцієнтом є чотири, а для напівреакції відновлення — одиниця.
4Мg + 2N+5 → 4Мg+2 + 2N+1.
4. Розставляємо отримані коефіцієнти в схемі реакції:
4Мg + НNO3 → 4Мg(NO3)2 + N2O + Н2O.
5. Складаємо рівняння реакції:
4Мg + 10НNO3 → 4Мg(NO3)2 + N2O + 5Н2O.
Метод йонно-електронний (метод напівреакцій). Цей метод грунтується на складанні йонних рівнянь для процесу окиснення і відновлення з наступним підсумовуванням їх у загальне рівняння. Послідовність дій при цьому методі така:
1. Визначити ступінь окиснення атомів у схемі реакції.
2. Скласти йонну схему реакції.
3. Записати йонні рівняння напівреакцій окиснення і відновлення, зрівняти в лівій і правій частинах рівнянь кількість атомів кожного елемента, додаючи для балансу відповідні речовини і продукти дисоціації молекул води.
4. Підсумувати рівняння обох напівреакцій з урахуванням електронного балансу.
5. Записати рівняння реакції, використовуючи коефіцієнти електронного балансу.
П р и к л а д. Рівняння окисно-відновної реакції між натрій сульфітом Nа2SO3 і калій перманганатом КМnO4 у кислому середовищі Н2SO4 складаємо в такий спосіб:
1. Визначаємо ступінь окиснення атомів у схемі реакції:
+4 +7 +6 +2
Nа2SO3 + КМnO4 + Н2SO4 → Na2SO4 + МnSO4 + К2SO4 + Н2O.
2. Складаємо йонну схему реакції:
SO32ˉ + МnO4ˉ + Н+ → SO42ˉ + Мn2+.
3. Записуємо рівняння напівреакцій окиснення й відновлення і вирівнюємо число атомів кожного елемента, додаючи для балансу атомів відповідні речовини.
SO32ˉ – 2еˉ + Н2О = SO42ˉ + 2Н+ 5 – окиснення
10
МnО4ˉ + 5еˉ + 8Н+ = Мn2+ + 4Н2O 2 – відновлення
Рівняння напівреакції окиснення має такий йонно-електронний вигляд:
5SO32ˉ – 10еˉ + 5Н2O = 5SO42ˉ + 10Н+
Рівняння напівреакції відновлення має такий йонно-електронний вигляд:
2МnО4ˉ+ 10еˉ + 16Н+ = 2Мn2+ + 8Н2O.
4. Підсумовуємо рівняння обох напівреакцій:
5SO32ˉ – 10еˉ + 5Н2О = 5SO42ˉ + 10Н+
2МnО4ˉ + 10еˉ + 16Н+ = 2Мn2+ + 8Н2O
_______________________________________________________________________
5SO32ˉ + 2МnО4ˉ + 6Н+ = 5SO42ˉ + 2Мn2+ + 3Н2O
5. Записуємо рівняння реакції:
5Nа2SO3 + 2КМnO4 + 3Н2SO4 → 5Na2SO4 + 2МnSO4 + К2SO4 + 3Н2O.
Складання рівнянь окисно-відновних реакцій за допомогою методу напівреакцій приводить до того самого результату, що і метод електронного балансу. Перевага методу напівреакцій порівняно з методом електронного балансу в тому, що в ньому застосовуються не гіпотетичні, а реально існуючі йони. У розчині немає йонів Мn+7, Сг+6, S+6, а є йони МnO4ˉ, СгО42ˉ, Сr2O72ˉ, SO42ˉ. При цьому методі виявляється роль середовища як активного учасника всього процесу. При використанні методу напів реакцій не треба знати всі продукти реакції, вони з’являються в рівнянні реакції при виведенні його. Однак метод електронного балансу менш трудомісткий, і він часто використовується для визначення коефіцієнтів хімічного рівняння, коли всі учасники реакції визначені.
Окисно-відновні реакції — найрозповсюдженіші в природі і техніці. Вони є основою життєдіяльності: фотосинтезу, дихання, обміну речовин. їх можна спостерігати при згорянні палива, при електролізі, у процесах корозії металів. Окисно-відновні реакції є основою металургійних процесів. З їхньою допомогою одержують багато яких хімічних речовин. Завдяки цим реакціям відбувається перетворення хімічної енергії на електричну в гальванічних елементах і акумуляторах.
Запитання і завдання для контролю і самоконтролю знань
1. Які реакції називаються окисно-відновними?
2. Розкрийте умови і характер перебігу окисно-відновного процесу.
3. Як залежить перебіг окисно-відновного процесу від реакції середовища? Наведіть приклади.
4. Перелічіть типи окисно-відновних реакцій.
5. Які речовини в окисно-відновних реакціях називаються відновниками, а які – окисниками? Назвіть найголовніші відновники й окисники.
6. Розкрийте роль окисно-відновних реакції в природі і техніці.
7. Визначте ступінь окиснення Сr в таких сполуках: К2СrО4, Сr2О3, Fе(СrО2)2, К2Сr2О7, Сr2(SО4)3.
8.
Вкажіть, які з приведених процесів
являють собою окиснення, а які –
відновлення: S → SO![]() ;
S → S
;
S → S![]() ;
Sn → Sn
;
Sn → Sn![]() ;
К → К+;
Вr2
→
2Вr
;
К → К+;
Вr2
→
2Вr![]() ;
2Н+
→
Н2;
Н2
→ 2Нˉ; Сlˉ→ СlО
;
2Н+
→
Н2;
Н2
→ 2Нˉ; Сlˉ→ СlО![]() ;
V2+
→ VO3ˉ;
IО
→
I2
;
МnО
;
V2+
→ VO3ˉ;
IО
→
I2
;
МnО![]() → МnО
.
→ МnО
.
Лекція 4.4. ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ
План
4.4.1. Гальванічний елемент
4.4.2. Електродні потенціали
4.4.3. Ряд електрохімічних потенціалів металів
4.4.4. Електроліз
4.4.5. Корозія та захист металів
Література
/1/ - Романова Н. В. Загальна та неорганічна хімія. – К.: Ірпінь, ВТФ
«Перун», 2002. – 480 с. (Розділ 10. § 10.2-10.4).
/2/ - Глинка Н. Л. Общая химия. – Л.: Химия, 1987. – 704 с.
(Глава ІХ. § 98-103).
4.4.1. Гальванічний елемент
Характерною властивістю металів є їх здатність лише віддавати електрони. тобто вільні метали можуть виступати тільки в ролі відновників.
Здатність металів до утворення вільних позитивно заряджених йонів яскраво виявляється в реакціях витіснення металів з їхніх солей іншими, активнішими металами або під час взаємодії з кислотами-неокисниками. Наприклад, під час взаємодії цинку з хлоридною або розбавленою сульфатною кислотою відбувається окисно-відновна реакція витіснення Гідрогену цинком.
Здатність різних металів віддавати електрони оцінюють за реакціями витіснення цих металів з їхніх солей іншими металами. Так, якщо цинкову пластинку занурити в розчин купрум сульфату, то відбудеться окисно-відновна реакція
Zn + Сu2+ = Сu↓ + Zn2+.
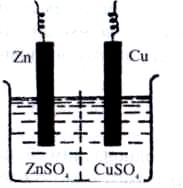
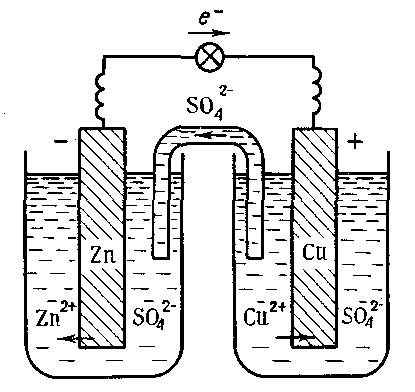
Рис. 5. Схема мідно-цинкового гальванічного елемента
Ця реакція відбувається, наприклад, у гальванічному елементі, в якому цинкова пластинка (один електрод) занурена у розчин цинк сульфату, а мідна (другий електрод) — у розчин купрум(ІІ) сульфату. Сполучивши цинковий та мідний електроди з гальванометром і з’єднавши розчини U-подібною трубкою, заповненою розчином електроліту КNO3, дістають гальванічний елемент (елемент Якобі-Даніеля, рис. 5).
Після встановлення у гальванічному колі контакту стрілка гальванометра відхиляється у напрямку до мідного електрода. Це свідчить про те, що під час роботи гальванічного елемента електрони рухаються від цинкового електрода до мідного.
Гальванічний елемент — це прилад, що служить для перетворення хімічної енергії окисно-відновної реакції на електричну. У гальванічному елементі електрони переходять від відновника до окисника не безпосередньо, а по провіднику електричного струму — по зовнішньому колу. Цей напрямлений потік електронів і є електричним струмом.
На цинковому електроді елемента Якобі-Даніеля відбувається розчинення цинку з перетворенням його атомів на йони, тобто процес окиснення:
Znº – 2еˉ = Zn2+,
а вивільнені електрони по провіднику переходять на мідний електрод, де відбувається розряджання катіонів Купруму (процес відновлення), що супроводжується виділенням металічної міді:
Сu2+ + 2еˉ = Сuº↓.
Сумарне рівняння реакції, внаслідок якої у колі виникає електричний струм, матиме вигляд:
Znº + Сu2+ = Zn2+ + Сuº↓,
або в молекулярній формі:
Zn + CuSO4 = Cu + ZnSO4.
Схематично гальванічний елемент Якобі-Даніеля зображують так:
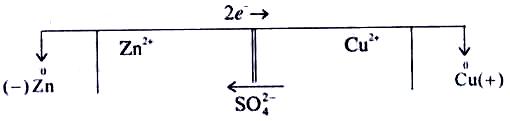
,
або (–) Zn ZnSO4 CuSO4 Cu (+).
Із схеми видно, що в розчині катіони Zn2+ і Сu2+ переміщуються від цинкового електрода до мідного, а аніони SO42ˉ — у зворотному напрямку. Електрод, на якому відбувається процес окиснення, називається анодом, а електрод, на якому відбувається процес відновлення, — катодом. У мідно-цинковому елементі анодом є цинковий електрод, а катодом — мідний.
Електричний струм, що проходить по зовнішньому колу гальванічного елемента, здатний виконувати певну корисну роботу. Величина роботи, яку можна виконати внаслідок перетворення хімічної енергії окисно-відновної реакції, що відбувається в гальванічному елементі, залежить від величини струму, який виникає в цьому елементі.
Електрорушійною силою гальванічного елемента Е° називається максимальне значення напруги гальванічного елемента, що відповідає перебігу реакції в прямому і зворотному напрямках. Електрорушійна сила гальванічного елемента дорівнює різниці потенціалів між його електродами.
Величину Е° можна обчислити за різницею стандартних електродних (окисно-відновних) потенціалів φ°. Так, для реакції, що відбувається в елементі Якобі—Даніеля,
Е° = φ°Cu – φ°Zn.
Для обчислення Е від величини потенціалу катода слід відняти величину потенціалу анода. В гальванічному елементі, як уже зазначалось, катодом є позитивно заряджений електрод, анодом — негативно заряджений (під час електролізу — навпаки).
Якщо стандартна е. р. с. гальванічного елемента Е° має додатну величину (ΔGº < 0), то це означає, що дана реакція йде в прямому напрямку, а якщо від’ємну — у зворотному.
Поляризація – це зміна величини електродного потенціалу катода чи анода через зміну стану поверхні електрода – утворення нерозчинних солей, оксидних і газових плівок, які виникають на поверхні електрода при роботі гальванічного елемента.
Н а п р и к л а д, для гальванічного елемента:
Zn|H2SO4|Cu на катоді відбувається процес: 2H+ + 2еˉ → H2↑.
Хімічна поляризація в цьому випадку обумовлена утворенням газової плівки водню, що ізолює поверхню катода від розчину електроліту, в наслідок чого зменшується е. р. с.
Концентраційна поляризація електродів виникає за рахунок зміни концентрації йонів у приповерхневому шарі електрода, що впливає на величину потенціалу електрода.
Н а п р и к л а д, при роботі мідно-цинкового гальванічного елемента:
Zn ZnSO4 CuSO4 Cu зростає концентрація йонів Zn2+ біля анода і зменшується концентрація йонів Сu2+ біля катода, це призводить до зближення потенціалів катода і анода, тобто до зменшення е. р. с.
Усунення або зниження поляризації називається деполяризацією. Концентраційна поляризація зменшується за рахунок перемішуванням електроліту, а хімічна – введенням деполяризаторів.
