
- •Лекція вступ
- •32 Г (1 моль) — х л
- •1.2. Хімічний елемент
- •1.3. Основні закони хімії
- •2.1. Періодичний закон і періодична система хімічних елементів д. І. Менделеєва
- •2.1.2. Періодична система елементів
- •2.1.3. Розвиток періодичного закону
- •2.2.2. Характеристика орбіталей
- •2.2.3. Електронні формули
- •2.2.4. Властивості та енергетичні характеристики атомів
- •2.3.2. Ковалентний зв’язок
- •2.3.3. Йонний зв’язок
- •2.3.4. Водневий зв’язок
- •2.3.5. Металічний зв’язок
- •2.3.6. Взаємодія між молекулами
- •2.3.7. Комплексний зв’язок
- •3.1. Енергетика хімічних процесів
- •3.1.3. Ентропія, енергія Гіббса та напрямленість процесів
- •3.2.2. Фактори, що впливають на швидкість реакції
- •3.2.3. Каталіз
- •3.3.2. Хімічна рівновага
- •3.3.3. Принцип Ле Шательє
- •4.1. Розчини. Дисперсні системи
- •4.1.2. Розчини. Розчинність
- •4.1.3. Чисельне вираження складу розчинів
- •4.2.2. Дисоціація води. Водневий показник
- •4.2.3. Буферні розчини
- •4.2.4. Гідроліз солей
- •4.3.2. Ступінь окиснення
- •4.3.3. Теорія окисно-відновних реакцій
- •4.3.4. Найголовніші окисники і відновники
- •4.3.5. Класифікація окисно-відновних реакцій
- •4.3.6. Складання рівнянь окисно-відновних реакцій
- •4.4.2. Електродні потенціали
- •4.4.3. Ряд електрохімічних потенціалів металів
- •4.4.4. Електроліз
- •4.4.5. Корозія та захист металів
- •5.1. Основні класи неорганічних сполук
- •5.1.2. Оксиди
- •5.1.3. Основи
- •5.1.4. Кислоти
- •5.1.5. Амфотерні гідроксиди
- •5.1.7. Солеподібні бінарні сполуки
- •5.1.8. Галоген- і тіоангідриди
- •5.1.9. Металоїди (інтерметалоїди)
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •6.1. Ядерна хімія і радіохімія
- •6.1.2. Ядерні реакції
- •6.1.3. Вплив радіоактивності на біологічні об’єкти
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
3.3.2. Хімічна рівновага
Оборотні реакції не доходять до кінця і завершуються встановленням хімічної рівноваги. Наприклад, у реакції синтезу амоніаку рівновага настає тоді, коли за одиницю часу утворюється стільки ж молекул амоніаку, скільки їх розпадається на азот і водень. Отже,
хімічну рівновагу можна визначити як такий стан системи реагуючих речовин, при якому швидкості прямої і зворотної реакцій дорівнюють одна одній.
У стані рівноваги пряма і зворотна реакції не припиняються. Тому така рівновага називається рухомою, або динамічною, рівновагою. А оскільки дія обох реакцій взаємно знишується, то в реагуючій суміші видимих змін не відбувається: концентрації всіх реагуючих речовин – як вихідних, так і тих, що утворюються, – залишаються чітко сталими.
Кількісною характеристикою хімічної рівноваги є її константа. Розглянемо це на прикладі взаємодії оксиду сульфуру(ІV) з киснем:
2SО2 + О2 ↔ 2SО3.
Швидкість прямої реакції, згідно з законом дії мас, дорівнює:
v1 = К1 [SО2]2 [О2],
швидкість зворотної реакції
v2 = К2 [SО3]2.
В момент встановлення хімічної рівноваги v1 = v2, тобто
К1 [SО2]2 [О2] = К2 [SО3]2,
![]() =
=
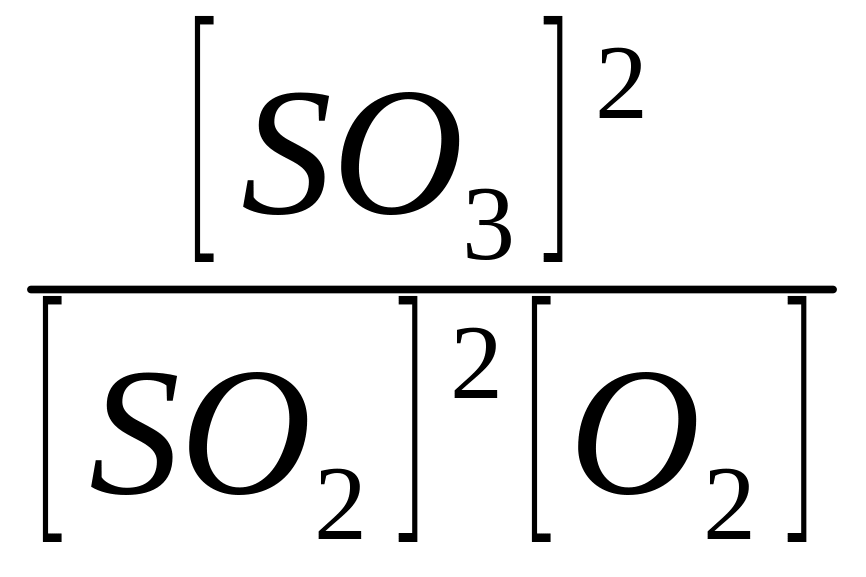 .
.
Відношення К1/К2 є також сталою величиною, тому останнє рівняння можна записати так:
К = .
Отже, в момент встановлення хімічної рівноваги відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин є сталою величиною. Ця величина називається константою хімічної рівноваги.
Рівноважні концентрації – це концентрації, що встановлюються в стані хімічної рівноваги.
Константа хімічної рівноваги показує, що за умови рівноваги концентрації всіх речовин пов'язані між собою: в разі зміни концентрації будь-якої з реагуючих речовин змінюються концентрації всіх інших речовин. У результаті встановлюються новий стан рівноваги і нові концентрації, але співвідношення між ними залишаються незмінними, вони відповідають константі рівноваги.
Для гетерогенних реакцій у вираз константи рівноваги, аналогічно виразу закону дії мас, входять концентрації тільки тих речовин, які перебувають у газовій або рідкій фазі. Тому для реакції
СО2 + С ↔ 2СО
вираз константи хімічної рівноваги запишеться так:
К = [СО]2 /[СО2].
Константа хімічної рівноваги визначає глибину перебігу процесу в момент досягнення стану рівноваги. Чим більша величина К, тим повніше взаємодіють речовини. Повнота перебігу процесу залежить від концентрації реагентів. Знаючи величину К, можна обчислити теоретично можливий вихід продуктів реакції. Величина константи хімічної рівноваги залежить від природи реагуючих речовин, температури і не залежить від тиску (в разі не дуже високого його значення), концентрації реагуючих речовин і продуктів реакції та від наявності або відсутності домішок.
3.3.3. Принцип Ле Шательє
Стан хімічної рівноваги залишається незмінним доти, доки не зазнають зміни зовнішні умови (температура, тиск, концентрація). Коли ж змінити ці умови, то рівновага системи порушиться. Це пояснюється тим, що в разі зміни зовнішніх умов швидкості прямої та зворотної реакцій стають різними; швидкість однієї з двох реакцій переважає над іншою, в результаті чого хімічна рівновага порушується.
Вплив зміни зовнішніх умов на стан хімічної рівноваги визначається за правилом, яке дістало назву принципу Ле Шательє (1884 р.), або принципу рухомої (динамічної) рівноваги: якщо на систему, що перебуває у стані рівноваги, подіяти ззовні, то в системі відбуватимуться зміни, що послаблюють або знищують цю дію. Система перейде з одного стану рівноваги в інший, який відповідатиме новим умовам. Це пов'язано з тим, що зовнішня дія різною мірою змінює швидкість двох протилежно напрямлених процесів.
Розглянемо вплив різних чинників на стан хімічної рівноваги.
Вплив концентрації на стан рівноваги. Згідно з принципом Ле Шательє, введення в систему, що перебуває в стані рівноваги, додаткової кількості будь-якої з реагуючих речовин викликає зміщення рівноваги у тому напрямку, в якому її концентрація зменшується. Ось чому добавляння в систему однієї з вихідних речовин спричинює зміщення рівноваги вправо, а добавляння продуктів реакції – вліво.
Якщо напрямок зміщення рівноваги в системі залежить від того, який із реагентів беруть з надлишком, то ступінь зміщення рівноваги в разі введення певної кількості реагента визначається стехіометричними коефіцієнтами речовин, що беруть участь у реакції. Наприклад, введення додаткової кількості водню в систему
Н2 + І2 ↔ 2НІ,
що перебуває у стані рівноваги за певних температури й тиску, спричинить зростання швидкості прямої реакції, а швидкість зворотної реакції не зміниться, внаслідок чого рівновага порушиться. Зростання швидкості прямої реакції зумовить зменшення концентрацій водню і пари йоду, що, в свою чергу, приведе до сповільнення прямої реакції. Водночас концентрація НІ збільшуватиметься, що спричинить прискорення зворотної реакції. Через деякий час знову встановиться стан хімічної рівноваги – швидкості прямої і зворотної реакцій зрівняються, при цьому концентрація НІ стане вищою, а концентрація І2 – нижчою, ніж до добавляння Н2.
Отже, в разі збільшення концентрації однієї з реагуючих речовин у системі, що перебувала в стані рівноваги, рівновага зміщується в бік витрати цієї речовини, а в разі зменшення її концентрації – в бік утворення цієї речовини.
Вплив тиску на стан рівноваги. Для газових систем на стан хімічної рівноваги впливає тиск, оскільки із збільшенням тиску зростає концентрація газових компонентів у даній системі. Реакції, що супроводжуються зменшенням об'єму, легше йдуть за підвищеного тиску. Отже, згідно з принципом Ле Шательє, підвищення тиску зумовлює зміщення хімічної рівноваги в напрямку процесу, який супроводжується зменшенням об'єму, а зниження тиску – викликає зміщення рівноваги у протилежний бік. Отже, напрямок зміщення рівноваги визначається знаком ∆V. У разі обчислення ∆V можна знехтувати об'ємом негазоподібних реагентів.
Для реакції утворення амоніаку, що записується рівнянням
N2 + 3Н2 ↔ 2NН3,
в стані рівноваги швидкості прямої v1, і зворотної v2 реакцій становитимуть
v1 = К1 [N2][Н2]3;
v2 = К2 [NН3]2.
Підвищення тиску вдвічі (за сталої температури) зумовить зменшення об'ємів вдвічі, що приведе до збільшення концентрацій реагуючих речовин в два рази. У перший момент після підвищення тиску концентрації газів у системі матимуть значення: 2[Н2]; 2[N2]; 2[NН3], а швидкості прямої і зворотної реакцій дорівнюватимуть
v1' = К1 ∙2[N2](2[Н2])3 = 16К1[N2][Н2]3 = 16v1;
v2' = К2 ∙(2[NН3])2 = 4К2[NН3]2 = 4v2.
Отже, підвищення тиску вдвічі призведе до зростання швидкості прямої реакції в 16 разів, а зворотної тільки в 4 рази, тобто пряма реакція переважатиме над зворотною. Хімічна рівновага порушиться. Встановиться вона знову лише після того, як зрівняються швидкості прямої та зворотної реакцій.
Із сказаного вище можна зробити висновок, що в разі підвищення тиску рівновага зміщується в бік зменшення числа молекул газів, тобто в бік зниження тиску, а в разі зниження тиску – в бік збільшення числа молекул газів, тобто в бік підвищення тиску.
Вплив температури на стан рівноваги. Згідно з принципом Ле Шательє, під час нагрівання системи, що перебуває в стані рівноваги, остання зміщується в бік того з двох протилежно напрямлених процесів, який супроводжується поглинанням теплоти. Природно, що зниження температури зумовлює протилежний результат: рівновага зміщується в бік того процесу, який супроводжується виділенням теплоти. Отже, нагрівання сприяє перебігу ендотермічного, а охолодження – екзотермічного процесу.
Напрямок зміщення рівноваги внаслідок зміни температури визначається знаком теплового ефекту, ступінь зміщення рівноваги – абсолютною величиною теплового ефекту. Чим більше ∆Н, тим значніший вплив температури, і, навпаки, якщо величина ∆Н близька до нуля, то зміна температури практично не впливає на стан рівноваги. Наприклад, рівновага реакції розкладу кальцій карбонату
СаСО3 ↔ СаО + СО2, ∆Н0298 = 178 кДж/моль
у разі підвищення температури зміщується вправо, а рівновага реакції розкладу оксиду нітрогену(ІІ)
2NО ↔ N2 + О2, ∆Н0298 = –181 кДж/моль
зміщується вліво.
Значення принципу Ле Шательє в хімії дуже велике, оскільки він дає змогу передбачити напрямок реакції за різних умов, і, отже, керувати перебігом реакцій.
Вивчення рівноважних процесів має також і філософське значення. Це наочна ілюстрація діалектичного закону єдності і боротьби протилежностей – одночасно виявляються два боки одного й того самого явища (пряма і зворотна реакції).
Перехід кількісних змін у якісні ілюструється в разі зміни зовнішніх умов, що приводять до виникнення якісно нового стану рівноваги системи.
Запитання і завдання для контролю і самоконтролю знань
1. Що собою являють оборотні й необоротні реакції?
2. Які чинники впливають на зміщення стану рівноваги?
3. Сформулюйте принцип Ле Шательє.
4. На які агрегатні стани речовин має вплив тиск?
5. Що собою являють рівноважні концентрації?
6. Як зміститься стан рівноваги реакції розкладу кальцій карбонату та реакції розкладу нітроген(ІІ) оксиду в разі підвищення температури?
Лекція ІV. РОЗЧИНИ. ОКИСНО-ВІДНОВНІ ПРОЦЕСИ
