- •Лекція вступ
- •32 Г (1 моль) — х л
- •1.2. Хімічний елемент
- •1.3. Основні закони хімії
- •2.1. Періодичний закон і періодична система хімічних елементів д. І. Менделеєва
- •2.1.2. Періодична система елементів
- •2.1.3. Розвиток періодичного закону
- •2.2.2. Характеристика орбіталей
- •2.2.3. Електронні формули
- •2.2.4. Властивості та енергетичні характеристики атомів
- •2.3.2. Ковалентний зв’язок
- •2.3.3. Йонний зв’язок
- •2.3.4. Водневий зв’язок
- •2.3.5. Металічний зв’язок
- •2.3.6. Взаємодія між молекулами
- •2.3.7. Комплексний зв’язок
- •3.1. Енергетика хімічних процесів
- •3.1.3. Ентропія, енергія Гіббса та напрямленість процесів
- •3.2.2. Фактори, що впливають на швидкість реакції
- •3.2.3. Каталіз
- •3.3.2. Хімічна рівновага
- •3.3.3. Принцип Ле Шательє
- •4.1. Розчини. Дисперсні системи
- •4.1.2. Розчини. Розчинність
- •4.1.3. Чисельне вираження складу розчинів
- •4.2.2. Дисоціація води. Водневий показник
- •4.2.3. Буферні розчини
- •4.2.4. Гідроліз солей
- •4.3.2. Ступінь окиснення
- •4.3.3. Теорія окисно-відновних реакцій
- •4.3.4. Найголовніші окисники і відновники
- •4.3.5. Класифікація окисно-відновних реакцій
- •4.3.6. Складання рівнянь окисно-відновних реакцій
- •4.4.2. Електродні потенціали
- •4.4.3. Ряд електрохімічних потенціалів металів
- •4.4.4. Електроліз
- •4.4.5. Корозія та захист металів
- •5.1. Основні класи неорганічних сполук
- •5.1.2. Оксиди
- •5.1.3. Основи
- •5.1.4. Кислоти
- •5.1.5. Амфотерні гідроксиди
- •5.1.7. Солеподібні бінарні сполуки
- •5.1.8. Галоген- і тіоангідриди
- •5.1.9. Металоїди (інтерметалоїди)
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •6.1. Ядерна хімія і радіохімія
- •6.1.2. Ядерні реакції
- •6.1.3. Вплив радіоактивності на біологічні об’єкти
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
2.3.7. Комплексний зв’язок
Утворення комплексних сполук пояснюють, виходячи з електростатичної теорії і теорії ковалентних зв'язків. Згідно з першою теорією, зв'язок між центральним атомом (йоном) і лігандами зумовлений електростатичним притяганням частинок і за своєю природою аналогічний йонному.
Для пояснення комплексоутворення друга теорія виходить з уявлення про електронні пари, що сполучають ліганди з атомом (йоном)-комплексоутворювачем так само, як і в звичайних атомних сполуках.
Між йонами внутрішньої і зовнішньої сфер існує йонний зв'язок. Хімічний зв'язок між центральним атомом і лігандами — ковалентний, утворений за обмінним і донорно-акцепторним механізмами.
Наприклад, зв'язок між зовнішньою і внутрішньою сферами в комплексній сполуці [Аg(NН3)2]Сl йонний. Дві молекули аміаку координуються йоном Аg+ за рахунок двох σ-зв'язків, утворених за донорно-акцепторним механізмом (молекули NH3 — донори, йон Аg+ — акцептор електрона). Під час утворення σ-зв'язків відбувається sp-гібридизація атомних орбіталей. Координаційне число визначається числом σ-зв'язків, утворених центральним атомом з лігандами за рахунок гібридизованих орбіталей.
Для визначення структури та природи зв'язку координаційних сполук велике значення має вивчення їхніх інфрачервоних (ІЧ) спектрів та магнітних властивостей. Вивчаючи ІЧ-спектри, можна встановити порядок приєднання складних лігандів (яким саме атомом вони приєднуються); за магнітною сприйнятливістю можна зробити висновок про розподіл електронів, а отже, і про характер зв'язку.
Запитання і завдання для контролю і самоконтролю знань
1. Чому утворення хімічного зв'язку супроводжується зменшенням енергії системи?
2. Які типи хімічного зв'язку ви знаєте? Чому ковалентний тип зв'язку вважається найуніверсальнішим?
3. Назвіть особливості кожного типу хімічного зв'язку.
Лекція ІІІ. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ ХІМІЧНИХ
ПРОЦЕСІВ
3.1. Енергетика хімічних процесів
План
3.1.1. Внутрішня енергія та ентальпія
3.1.2. Закон Гесса і термохімічні розрахунки
3.1.3. Ентропія, енергія Гіббса та напрямленість процесів
Література
/1/ - Романова Н.В. Загальна та неорганічна хімія. – К.: Ірпінь, ВТФ
«Перун», 2002. – 480 с. (Розділ 5. § 5.1-5.2).
/2/ - Глинка Н. Л. Общая химия. – Л.: Химия, 1987. – 704 с.
(Глава VІ. § 66-68).
3.1.1. Внутрішня енергія та ентальпія
Хімічна термодинаміка — це наука, що вивчає перехід енергії з однієї форми в іншу; енергетичні ефекти, що супроводжують хімічні та фізичні процеси; можливість і напрямок перебігу того чи іншого процесу. Поряд із вченням про будову речовини термодинаміка становить теоретичну основу сучасної неорганічної хімії.
У хімічній термодинаміці користуються так званими термодинамічними функціями (характеристиками), які дають змогу охарактеризувати стан системи і зміни, що відбуваються в ній. Серед останніх важливе значення для хіміків мають внутрішня енергія U, ентальпія Н, ентропія S, енергія Гіббса G тощо.
Хімічні процеси відбуваються з виділенням або поглинанням теплоти. Реакції, що відбуваються з виділенням теплоти, називають екзотермічними, а реакції, під час перебігу яких теплота поглинається, — ендотермічними. Так, реакції горіння, нейтралізації кислот лугами супроводжуються виділен ням значної кількості теплоти. Виділення теплоти під час взаємодії речовин свідчить про те, що вони мають певний запас енергії у прихованому вигляді. Енергія, яка прихована в речовинах і вивільняється під час хімічних і деяких фізичних процесів, називається внутрішньою енергією речовини.
Для будь-якого процесу справедливий закон збереження енергії:
Q = ∆U + A
Це означає, що підведена до системи теплота Q в загальному випадку витрачається на зміну її внутрішньої енергії ∆U і на виконання роботи А. Під час термохімічних розрахунків прийнято вважати теплоту, що виділяється системою, додатною (у термодинаміці додатною вважається теплота, поглинута системою).
Під внутрішньою енергією системи U слід розуміти загальний її запас, тобто енергію поступального й обертального руху молекул, енергію внутрішньомолекулярних коливань атомів і атомних груп, енергію руху електронів в атомах, внутрішньоядерну енергію, тобто усі види енергії, крім кінетичної і потенціальної енергії системи в цілому. Під величиною А розуміють роботу, що протидіє всім силам, які діють на систему (зовнішній тиск, електричне і магнітне поля тощо).
Суму внутрішньої енергії і добутку об'єму речовини на зовнішній тиск називають ентальпією і позначають літерою H:
Н = U + РV.
Наукове і практичне значення має зміна ентальпії ∆H в ході процесу:
∆H = H2 – H1.
Якщо в ході процесу виконується тільки робота розширення і система перебуває за сталого тиску, то
А = Р∆V.
Звідси можна записати
∆H = ∆U + Р∆V, ∆U = ∆H – Р∆V.
Порівнюючи наведене вище рівняння з рівнянням внутрішньої енергії, бачимо, що за зазначених умов ∆H = Qp (Qp — теплота, яку поглинула система за сталого тиску).
Отже, як внутрішня енергія, так і ентальпія є важливими термодинамічними функціями. Математичний зв'язок між ними (∆H = ∆U + Р∆V) відображує зміст основного принципу термодинаміки: кількість теплоти ∆H, наданої будь-якій системі, використовується на приріст її внутрішньої енергії ∆U та на виконання механічної роботи.
Під час хімічних перетворень вивільнюється тільки частина енергії, яку мають речовини. Кількість виділеної або поглинутої теплоти називається тепловим ефектом реакції. Теплові ефекти хімічних процесів вивчає термохімія.
Внутрішня енергія, що виділяється лише під час перебігу хімічних реакцій, називається хімічною, під час вивільнення вона перетворюється на інші форми. Так, хімічна енергія сірки та кисню під час утворення оксиду сульфуру(ІV) виділяється у вигляді теплоти і світла, тобто хімічна енергія перетворюється на теплову і світлову. Перетворення хімічної енергії на електричну має місце у гальванічних елементах. Під час вибуху хімічна енергія перетворюється на механічну, теплову, світлову. Отже, хімічна енергія може перетворюватись на теплову, світлову, електричну, механічну і, навпаки, всі види енергії можна перетворити на хімічну: розкладання сполук під час нагрівання, під дією електричного струму (електроліз), освітлення (фотоліз АgВr). Величезне значення має перетворення світлової енергії на хімічну для життєдіяльності рослин (фотосинтез).
Енергетичні зміни, що супроводжують перебіг хімічних реакцій, мають иелике практичне значення. Термохімія оцінює стійкість сполук за тепловими ефектами їх утворення, а також ступінь енергетичної доцільності хімічних реакцій за певних умов.
Щоб забезпечити можливість порівняння теплових ефектів різних реакцій, термохімічні розрахунки слід робити відносно одного моля сполуки за температури 25 °С (298,15 К) і тиску 101 кПа (1 атм). Теплові ефекти, визначені за таких умов, називають стандартними.
Теплові ефекти можна зазначати поряд з рівняннями хімічних реакцій. Рівняння, біля яких зазначено тепловий ефект, називають термохімічними. Величину теплового ефекту записують справа від рівняння із знаком «мінус», якщо реакція екзотермічна, і зі знаком «плюс» — якщо ендотермічна.
Кількість теплоти, що виділяється або поглинається під час утворення одного моля хімічної сполуки з простих речовин, називається теплотою (ентальпією) утворення даної сполуки. Так, теплота утворення води дорівнює – 285,8 кДж/моль; це означає, що в процесі утворення 18 г рідкої води з 2 г водню і 16 г кисню виділяється 285,8 кДж енергії у вигляді теплоти.
А. Л. Лавуазьє і П. С. Лаплас довели, що теплота розкладання даної сполуки чисельно дорівнює теплоті її утворення, але має протилежний знак — це перший закон термохімії. З цього закону випливає, що чим більше теплоти виділяється під час утворення тієї чи іншої сполуки, тим більше теплоти слід затратити на її розкладання.
Слід розрізняти поняття «стандартні умови», що включає стандартну температуру (25 °С) і тиск (101 кПа), і «стандартний стан речовини» — за тиску 101 кПа і будь-якої сталої температури.
Визначені для речовин, що перебувають у стандартному стані, стандартні значення ентальпії та інших термодинамічних величин позначають відповідним символом з індексом зверху H0, а індексом знизу символа зазначають температуру, за якої вони визначені. Наприклад, зміна ентальпії H0298 визначена за температури 298 К, зміна ентальпії H01000 — за температури 1000 К.
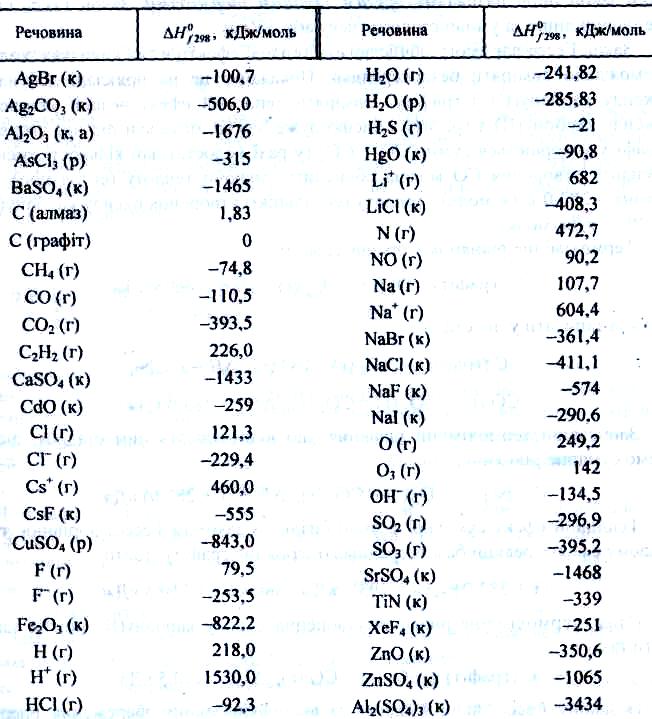
Стандартна ентальпія утворення речовини H0f — це зміна ентальпії в процесі утворення даної речовини, що перебуває в стандартному стані з термодинамічно стабільних форм простих речовин, що також перебувають у стандартних станах. Стандартні теплоти утворення відомі для багатьох речовин, вони зведені в таблиці (табл. 1).
Теплоти утворення простих речовин, стійких за стандартних умов (графіт, ромбічна сірка, кристалічний йод тощо), приймають такими, що дорівнюють нулю. В термохімічних рівняннях зазначають стан речовини: (к) — кристалічний, (р) — рідкий, (г) — газоподібний. Термохімічне рівняння реакції утворення води в рідкому стані можна записати так:
Н2 (г) + 1/2О2 (г) = Н2О (р), ∆H = –285,8 кДж.
Теплота утворення водяної пари становить –241,8 кДж/моль; відповідне термохімічне рівняння має вигляд:
Н2 (г) + 1/2О2 (г) = Н2О (г), ∆H = –241,8 кДж.
Таблиця 1. Стандартні ентальпії утворення деяких речовин і йонів
Різниця між теплотами утворення води в рідкому (–285,8 кДж/моль) і пароподібному стані (–241,8 кДж/моль) є теплотою випаровування 18 г (1 моль) води за температури 25 °С.
Теплота утворення оксиду нітрогену(П) дорівнює +90,25 кДж/моль, тому відповідне термохімічне рівняння матиме вигляд:
1/2N2 (г) + 1/2О2 (г) = NO (г), ∆H = 90,25 кДж.
Це означає, що під час утворення 1 моль газоподібного оксиду нітрогену(ІІ) з 0,5 моль газоподібного азоту і 0,5 моль газоподібного кисню поглинається 90,25 кДж теплоти.
Важливою характеристикою речовин, що застосовуються як паливо, є їхня питома теплота згоряння, яку теж прийнято визначати відносно 1 моль речовини. З термохімічного рівняння
С2Н2 (г) + 21/2О2 (г) = Н2О (р) + 2СО2 (г), ∆H = –1300 кДж
видно, що теплота згоряння одного моля ацетилену дорівнює 1300 кДж.
Величина теплового ефекту залежить від природи вихідних речовин і продуктів реакції, від їх агрегатного стану, а також від температури і тиску.
Оскільки більшість хімічних реакцій проводять за сталого тиску, основну увагу ми приділятимемо ізобарним процесам.
Для визначення теплових ефектів застосовують прилади калориметри.
В основі термохімічних розрахунків лежить закон, відкритий російським ученим Г. І. Гессом у 1840 р. Цей закон формулюється так: тепловий ефект реакції залежить тільки від початкового та кінцевого станів вихідних речовин та продуктів реакції і не залежить від проміжних стадій процесу. Цей закон іноді називають другим законом термохімії. Закон Гесса справедливий лише за умови сталого тиску або об'єму.
Закон Гесса дає змогу обчислювати теплові ефекти в тих випадках, коли їх неможливо виміряти безпосередньо. Покажемо це на прикладі добування карбон(ІІ) оксиду з графіту. Виміряти тепловий ефект реакції утворення карбон(ІІ) оксиду з графіту і кисню дуже важко, оскільки під час згоряння графіту утворюється суміш СО + СО2 (у разі недостатньої кількості кисню). Теплоту утворення СО можна обчислити, знаючи теплоту (ентальпію) згоряння (–283,0 кДж/моль) і теплоту (ентальпію) утворення карбон(ІV) оксиду (–393,5 кДж/моль).
Термохімічне рівняння згоряння графіту
С (графіт) + О2 (г) = СО2 (г), ∆H = –393,5 кДж
можна записати у дві стадії:
С (графіт) + 1/2О2 (г) = СО (г), ∆H = х кДж;
СО (г) + 1/2O2 (г) = СО2 (г), ∆H = –283,0 кДж.
Записавши термохімічні рівняння, що відповідають цим стадіям, дістанемо сумарне рівняння:
С (графіт) + О2 (г) = СО2 (г), ∆H = (х + 283,0) кДж.
Тепловий ефект сумарної реакції (згідно з законом Гесса) дорівнює тепловому ефекту реакції безпосереднього згоряння графіту, тобто
(х + 283,0) кДж = 393,5 кДж, звідки х = 110,5 кДж.
Отже, термохімічне рівняння утворення карбон(ІІ) оксиду можна записати так:
С (графіт) + 1/2О2 (г) = СО (г), ∆H = –110,5 кДж.
Із закону Гесса, який є одним із висновків закону збереження енергії, випливає два важливих наслідки: 1) стандартний тепловий ефект реакції дорівнює сумі стандартних теплот утворення ∆Hf продуктів реакції з відніманням суми стандартних теплот утворення вихідних речовин; 2) стандартний тепловий ефект реакції дорівнює сумі стандартних теплот згоряння ∆HЗ вихідних речовин з відніманням суми стандартних теплот згоряння продуктів реакції. Перший наслідок має загальне значення, другий важливий для органічних сполук.
Так, для реакції взаємодії газоподібного SО3 і кристалічного Аl2О3
Аl2О3 (к) + 3SО3(г) = Аl2(SО4)3 (к)
тепловий ефект реакції визначається залежністю
∆H = ∆H0f Аl2(SО4)3 – (∆H0f Аl2О3 + 3∆H0f SО3).
Згідно з даними табл. 1, тепловий ефект цієї реакції становить
∆H = –3434 – (–1675 –3 ∙ 395,2) = –753,3 кДж.
За законом Гесса розраховано стандартні теплоти утворення багатьох сполук. Крім цього, за законом Гесса обчислені теплові ефекти хімічних реакцій без проведення спеціальних досліджень. Закон Гесса відіграв велику роль у розвитку не тільки термохімії, а й більш широкої галузі науки — хімічної термодинаміки.