
- •Лекція вступ
- •32 Г (1 моль) — х л
- •1.2. Хімічний елемент
- •1.3. Основні закони хімії
- •2.1. Періодичний закон і періодична система хімічних елементів д. І. Менделеєва
- •2.1.2. Періодична система елементів
- •2.1.3. Розвиток періодичного закону
- •2.2.2. Характеристика орбіталей
- •2.2.3. Електронні формули
- •2.2.4. Властивості та енергетичні характеристики атомів
- •2.3.2. Ковалентний зв’язок
- •2.3.3. Йонний зв’язок
- •2.3.4. Водневий зв’язок
- •2.3.5. Металічний зв’язок
- •2.3.6. Взаємодія між молекулами
- •2.3.7. Комплексний зв’язок
- •3.1. Енергетика хімічних процесів
- •3.1.3. Ентропія, енергія Гіббса та напрямленість процесів
- •3.2.2. Фактори, що впливають на швидкість реакції
- •3.2.3. Каталіз
- •3.3.2. Хімічна рівновага
- •3.3.3. Принцип Ле Шательє
- •4.1. Розчини. Дисперсні системи
- •4.1.2. Розчини. Розчинність
- •4.1.3. Чисельне вираження складу розчинів
- •4.2.2. Дисоціація води. Водневий показник
- •4.2.3. Буферні розчини
- •4.2.4. Гідроліз солей
- •4.3.2. Ступінь окиснення
- •4.3.3. Теорія окисно-відновних реакцій
- •4.3.4. Найголовніші окисники і відновники
- •4.3.5. Класифікація окисно-відновних реакцій
- •4.3.6. Складання рівнянь окисно-відновних реакцій
- •4.4.2. Електродні потенціали
- •4.4.3. Ряд електрохімічних потенціалів металів
- •4.4.4. Електроліз
- •4.4.5. Корозія та захист металів
- •5.1. Основні класи неорганічних сполук
- •5.1.2. Оксиди
- •5.1.3. Основи
- •5.1.4. Кислоти
- •5.1.5. Амфотерні гідроксиди
- •5.1.7. Солеподібні бінарні сполуки
- •5.1.8. Галоген- і тіоангідриди
- •5.1.9. Металоїди (інтерметалоїди)
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.2.1. Місце металічних елементів у періодичній системі. Загальна характеристика металів
- •5.2.2. Фізичні та хімічні властивості металів
- •5.2.3. Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.3.1. Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
- •5.3.2. Фізичні та хімічні властивості неметалів
- •5.3.3. Характеристика й екологічна значимість окремих представників неметалічних елементів і їх сполук
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •5.4.1. Класифікація органічних сполук
- •5.4.2. Характеристика найбільш екологічно значущих органічних сполук
- •5.4.3. Органічні полімерні матеріали
- •6.1. Ядерна хімія і радіохімія
- •6.1.2. Ядерні реакції
- •6.1.3. Вплив радіоактивності на біологічні об’єкти
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
- •6.2.1. Причини утворення і екологічні наслідки озонових дір, парникового ефекту, смогів, кислотних дощів
- •6.2.2. Чинники, що впливають на хімічний склад природних вод
- •6.2.3. Хімічне забруднення грунтів
2.3.4. Водневий зв’язок
Водневий зв'язок — це специфічний зв'язок за участю атома Гідрогену.
Водневий зв'язок — це зв'язок між позитивно поляризованим атомом Гідрогену і негативно поляризованим іншим атомом.
Оскільки атоми можуть належати до однієї або до різних молекул, то цей зв'язок може бути міжмолекулярним або внутрішньомолекулярним. Міжмолекулярний водневий зв'язок — це зв'язок між позитивно поляризованим атомом Гідрогену однієї молекули і негативно поляризованим атомом іншої молекули. Внутрішньомолекулярний водневий зв'язок — це зв'язок між позитивно поляризованим атомом Гідрогену і негативно поляризованим атомом, що входять до складу однієї молекули.
Водневий зв'язок звичайно позначають крапками. Цим указується, що він набагато слабкіше ковалентного зв'язку (приблизно в 15-20 разів). Енергія водневого зв'язку становить 8-40 кДж/моль. За допомогою міжмолекулярного водневого зв'язку відбувається асоціація молекул. Утворення димерів води можна представити схемою:
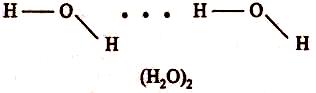
Водневі зв'язки легко руйнуються при нагріванні. При температурі нижче 0 °С усі молекули води асоційовані; при 0 °С руйнується 15% водневих зв'язків; при +20 °С руйнується 50% водневих зв'язків. Молекули водяної пари (+100 °С) не утворюють водневих зв'язків.
Водневий зв'язок утворюється за допомогою донорно-акцепторної взаємодії. Йому властиві спрямованість у просторі і насичуваність. Цей зв'язок відіграє велику роль у хімії органічних сполук і в здійсненні біохімічних процесів.
2.3.5. Металічний зв’язок
Атоми металевих елементів на зовнішньому енергетичному рівні містять невелику кількість електронів. Ці електрони мають малу енергію взаємодії з ядром, через це валентні електрони слабко втримуються в атомі. Металеві елементи утворюють прості речовини — метали. За звичайних умов метали — це кристалічні речовини (крім ртуті). Валентні електрони вільно переміщаються від одного атома до іншого в межах усього кристала. Сукупність валентних електронів, переміщуваних у межах кристала, називають «електронним газом». Такі електрони називають делокалізованими, оскільки координати кожного електрона згодом постійно міняються в широких межах.
Хімічний зв'язок, що утворюється за допомогою делокалізованих (усуспільнених) електронів, називається металічним зв'язком.
Металічний зв'язок характеризується тим, що атоми металів легко втрачають валентні електрони і перетворюються на позитивні йони. Вільні валентні електрони пересуваються в металевому кристалі між йонами металів і зв'язують їх. Невелика кількість електронів зв'язує велику кількість йонів. Металічний зв'язок не локалізований і не спрямований (рис. 4).
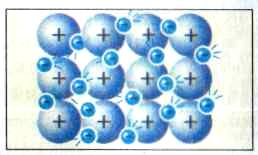
Рис. 4. Спрощена модель будови металу
Цей зв'язок забезпечує високу теплопровідність і електропровідність металів.
2.3.6. Взаємодія між молекулами
Вивчаючи властивості різних речовин, поряд з внутрішньомолекулярною взаємодією, зумовленою дією валентних (хімічних) сил, слід враховувати і міжмолекулярну взаємодію. В разі розширення газів, конденсації, адсорбції, розчинення і багатьох інших процесів виявляється дія саме цих сил. На честь ученого, який запропонував рівняння стану газу, що враховує міжмолекулярну взаємодію, міжмолекулярні сили називаються силами Ван дер Ваальса.
Міжмолекулярна взаємодія відрізняється від хімічної тим, що вона виявляється на значно більших відстанях і характеризується відсутністю насичуваності, малою енергією, не специфічна.
Сили міжмолекулярної взаємодії мають електричну природу. Між полярними молекулами виникає електростатична взаємодія, яка носить назву орієнтаційної. Молекули орієнтуються одна відносно одної різнойменно зарядженими частинами, внаслідок чого виникає взаємне притягання їх. Орієнтаційні сили, що виникають між молекулами, тим більші, чим більший дипольний момент молекул µ. З підвищенням температури орієнтаційні сили послаблюються, що пов'язано з порушенням взаємної орієнтації молекул внаслідок їх теплового руху.
Якщо молекула, що має сталий дипольний момент, наближається до неполярної молекули, вона зумовлює зміщення в ній електронної густини і появу наведеного, або індукованого, диполя.
Індуковані диполі можуть виникати і між неполярними молекулами внаслідок того, що кожний атом створює навколо себе електричне поле, яке поляризує сусідню молекулу. Диполь, що утворився, в свою чергу, поляризує сусідні молекули, що й спричинює їх притягання. Індукційна взаємодія характерна також і для полярних молекул, але в цьому разі вона значно слабкіша, ніж орієнтаційна.
Індуковані диполі взаємодіють тим сильніше, чим легше деформується молекула. Енергія взаємодії таких молекул підвищується із збільшенням µ і швидко знижується із зростанням r (відстань між центрами диполів), від температури енергія не залежить, оскільки наведення диполів відбувається з;і будь-якого просторового розміщення молекул.
Енергія міжмолекулярної взаємодії складається не лише з енергії орієнтаційної й енергії індукційної взаємодії (взаємодія індукованих диполів). Для таких речовин, як неон, аргон, обидві зазначені складові дорівнюють нулю, однак ці інертні гази зріджуються, що свідчить про наявність ще однієї складової міжмолекулярних сил, яка пов'язана з рухом електронів у молекулах. Рухом електронів в атомах і молекулах зумовлено виникнення миттєвої поляризації: на дуже короткий проміжок часу виникають і відразу ж зникають дипольні моменти. Дія миттєвих диполів виявляється в силах притягання. Така взаємодія називається дисперсійною. Дисперсійні сили діють між частинками будь-яких конденсованих речовин.
Енергія міжмолекулярної взаємодії невелика, вона становить 8—16 кДж/моль.
