
Р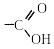 озділ
2
озділ
2
Тема 3. Карбонові кислоти Карбоновими кислотами називаються сполуки, які містять карбоксильну групу . Монокарбонові кислоти
Ізомерія та номенклатура
У назвах карбонових кислот дуже широко використовують тривіальну номенклатуру. Наприклад, НСООН – мурашина кислота, СН3–СООН – ацетатна кислота, СН3–СН2–СН2–СООН − масляна і т. д. Положення замісників відносно карбоксильної групи в тривіальних назвах позначають грецькими буквами , , , та ін., наприклад:
 СН3–СН2–СН–СООН
СН3–СН2–СН–СООН
СН3
-метилмасляна кислота
За замісниковою номенклатурою ІЮПАК назви карбонових кислот утворюють з назв вихідних вуглеводнів з тим самим числом атомів Карбону, враховуючи і атом Карбону карбоксильної групи, до яких додають суфікс –ова та слово кислота. Нумерацію головного карбонового ланцюга починають з атома карбону карбоксильної групи:
Н–СООН СН3СН2–СООН
метанова кислота пропанова кислота
Таблиця 1. Назви деяких монокарбонових кислот
-
Формула кислоти
Тривіальна назва
Міжнародна назва
НСООН
Мурашина
Метанова
СН3–СООН
Ацетатна
Етанова
СН3СН2СООН
Пропіонова
Пропанова
СН3СН2СН2СООН
Масляна
Бутанова
СН3(СН2)3СООН
Валеріанова
Пентанова
СН3(СН2)4СООН
Капронова
Гексанова
СН3(СН2)14СООН
Пальмітинова
Гексадеканова
СН3(СН2)16СООН
Стеаринова
Октадеканова
Залишок карбонової кислоти, що утворюється після відняття атома Гідрогену від карбоксильної групи, називають ацилокси-групою (кислотний залишок) RСОО–, а залишок, що утворюється після відняття гідроксильної групи, називають ацильною групою:
![]()
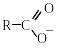
Назви ацилокси-груп звичайно утворюють з тривіальних латинських назв кислот і суфікса -ат, наприклад:
НСОО– СН3СОО– СН3–СН2–СОО–
форміат ацетат пропіонат
Назви ацильних груп утворюють з тривіальних латинських назв кислот і суфікса -ил (-іл). За замісниковою номенклатурою ІЮПАК назви ацильних груп утворюють від назви кислоти, замінюючи суфікс -ова та слово кислота на суфікс -оїл:
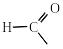
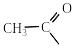
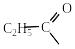
форміл ацетил пропіоніл
Ізомерія насичених монокарбонових кислот зумовлена різною структурою карбонового радикала, сполученого з карбоксильною групою. Перші три представники гомологічного ряду не мають ізомерів. Зі збільшенням числа карбонових атомів у молекулі карбонової кислоти кількість структурних ізомерів різко зростає.
Способи добування
Існує багато способів добування карбонових кислот, з яких найважливішими є:
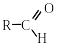
1.Окиснення первинних спиртів і альдегідів
Первинні спирти окиснюються до карбонових кислот через стадію утворення альдегіду. Як окисники використовують калій дихромат, калій перманганат та ін.:
 R–CH2–OH
[O]
+ H2O
[O]
R–CH2–OH
[O]
+ H2O
[O]
первинний спирт альдегід кислота
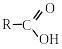
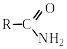
2. Гідроліз нітрилів
При нагріванні нітрилів з водними розчинами кислот і лугів вони піддаються гідролізу з утворенням карбонових кислот. Як проміжні продукти реакції утворюються аміди кислот:
 R–C≡N
+ HCN H+,
OH–
+ H2O
H+,
OH–
+ NH3.
R–C≡N
+ HCN H+,
OH–
+ H2O
H+,
OH–
+ NH3.
нітрил амід карбонової кислоти кислота
3. Взаємодія магнієорганічних сполук з СО2
При дії магнійорганічних сполук (реактивів Гріньяра) на СО2 утворюються солі карбонових кислот, з яких у кислому середовищі виділяють відповідні кислоти:
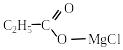
C2H5–MgCl + CO2 → → C2H5COOH + MgCl2.
хлормагнію пропіонат
4. Окиснення алканів
Цей метод використовується в промисловості для добування багатьох карбонових кислот. При окисненні алканів киснем повітря у присутності каталізатора (солі Со, V) утворюється суміш карбонових кислот, яку потім розділяють. Реакція супроводжується розривом карбон-карбонових зв’язків.
Фізичні властивості
Нижчі карбонові кислоти до С3 за звичайних умов – легко рухливі рідини з гострим запахом. Кислоти з С4–С9 – маслянисті рідини з неприємним запахом, що нагадує запах поту. Карбонові кислоти з числом атомів Карбону С10 і вище є твердими речовинами. Мурашина, ацетатна та пропіонова кислоти змішуються з водою в будь-яких співвідношеннях. Зі збільшенням молекулярної маси кислоти розчинність у воді сильно зменшується. Вищі карбонові кислоти нерозчинні у воді. Температури кипіння кислот значно вищі температур кипіння спиртів з тим самим числом атомів карбону. Це свідчить про те, що кислоти більш асоційовані, ніж спирти. На відміну від спиртів, для яких характерні тільки лінійні асоціати, карбонові кислоти, внаслідок утворення міжмолекулярних водневих зв’язків, утворюють як лінійні, так і циклічні асоціати у вигляді димерів:
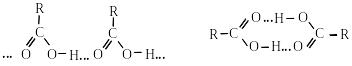
Таблиця 2. Фізичні константи деяких насичених монокарбонових кислот
-
Формула
Назва
Т. пл., °С
Т. кип., °С
НСООН
Мурашина
8,4
100,7
СН3СООН
Ацетатна
16,7
118,1
СН3СН2СООН
Пропіонова
−22,4
141,1
СН3(СН2)2СООН
Масляна
– 7,9
163,5
СН3(СН2)3СООН
Валеріанова
–34,5
187,0
СН3(СН2)4СООН
Капронова
– 1,5
205,3
СН3(СН2)І4СООН
Пальмітинова
64,0
271,5
СН3(СН2)16СООН
Стеаринова
70,0
291 (110 мм рт.ст.)
Хімічні властивості
Реакційна здатність карбонових кислот визначається в основному наявністю в їх структурі карбоксильної групи. Карбоксильна група являє собою спряжену систему, в якій неподілена пара електронів атома кисню гідроксильної групи вступає у спряження з -електронами карбонільної групи (р, -спряження). В результаті зміщення електронної густини зв’язок О–Н є сильно поляризованим, що приводить до появи у карбоксильної групи ОН-кислотного центру. Крім того, в молекулі карбонової кислоти відбувається зміщення електронної густини з карбонового радикалу, що приводить до появи С–Н-кислотного центру при -карбоновому атомі:

Виходячи з наведеної будови карбонових кислот, основні їх реакції можна умовно розділити на чотири групи:
1. За участю зв’язку О–Н (кислотні властивості);
2. Реакції заміщення гідроксильної групи;
3. Заміщення атомів водню при -карбоновому атомі;
4. Окиснення та відновлення.
1. Кислотні властивості
Кислотні властивості карбонових кислот зумовлені їх здатністю відщеплювати атом водню карбоксильної групи у вигляді протона.
У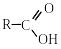 водних розчинах карбонові кислоти
дисоціюють за схемою:
водних розчинах карбонові кислоти
дисоціюють за схемою:
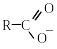
+ Н2О ↔ + Н3О+.
кислота карбоксилат-іон йон гідроксонію
У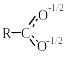 процесі дисоціації утворюється
карбоксилат-іон, у якому обидва атоми
кисню рівноцінні, а негативний заряд
рівномірно делокалізований між ними.
процесі дисоціації утворюється
карбоксилат-іон, у якому обидва атоми
кисню рівноцінні, а негативний заряд
рівномірно делокалізований між ними.
У результаті делокалізації негативного заряду карбоксилат-іон має високу стійкість. Сила кислоти визначається стійкістю аніона, що утворюється, тому карбонові кислоти перевершують за кислотними властивостями спирти та феноли, де можливість делокалізації заряду в аніоні менша.
На силу карбонових кислот впливає структура карбонового радикала, сполученого з карбоксильною групою, та природа замісників в ньому.
1. Утворення солей
Карбонові кислоти при взаємодії з активними металами, основними оксидами, гідроксидами та карбонатами лужних металів утворюють солі:
2CH3−COOH + Zn Zn(CH3COO)2 + H2;
2CH3−COOH + MgO ® Mg(CH3COO)2 + H2O;
CH3−COOH + NaOH ® Na(CH3COO) + H2O;
2CH3−COOH + NaHCO3 ® Zn(CH3COO)2 + CO2 + H2O.
У назвах солей карбонових кислот частіше застосовують тривіальні латинські назви. Солі мурашиної кислоти мають загальну назву – форміати, ацетатної – ацетати, пропіонової – пропіонати, масляної – бутирати, ізомасляної – ізобутирати. За замісниковою номенклатурою назва аніона утворюється шляхом заміни суфікса -ова та слова кислота на суфікс -оат, наприклад:
СН3–СН2–СН2–СООNa
натрій бутаноат
2. Реакції заміщення гідроксильної групи
2.1. Взаємодія зі спиртами (реакція етерифікації)
Карбонові кислоти при нагріванні у присутності кислотного каталізатора реагують зі спиртами, утворюючи складні ефіри – естери. Ця реакція дістала назву реакції етерифікації:

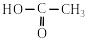
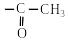 C2H5–O–H
+ Н2SO4
C2H5–O
+ H2O.
C2H5–O–H
+ Н2SO4
C2H5–O
+ H2O.
етилацетат
Реакція етерифікації є оборотною. Естер, що утворюється, у кислому середовищі піддається гідролізу до вихідних кислоти та спирту. Для зміщення рівноваги в бік утворення естеру або використовують надлишок одного з реагентів (звичайно спирту), або видаляють з реакційного середовища воду.
2.2. Взаємодія з галогенуючими реагентами (РСl3, РСl5, РВr3, SОСl2)
П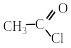 ри
дії на карбонові кислоти хлоридів
фосфору (III) та фосфору (V), броміду фосфору
(III) або тіонілхлориду SОСl2
утворюються галогенангідриди карбонових
кислот
ри
дії на карбонові кислоти хлоридів
фосфору (III) та фосфору (V), броміду фосфору
(III) або тіонілхлориду SОСl2
утворюються галогенангідриди карбонових
кислот
СН3СООН + PCl5 → + POCl3 + HCl.
Галогенангідриди карбонових кислот – реакційноздатні речовини, які широко застосовуються в органічному синтезі.
2.3. Взаємодія з амоніаком і амінами
При обробці амоніаком, первинними або вторинними амінами утворюються амонієві солі, які при піролізі відщеплюють воду та перетворюються на аміди:
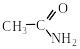
СН3СООН + NH3 → NH4СН3СОО + PCl5 200 C + H2O.
Через жорсткі умови проходження реакції цей метод утворення амідів рідко використовують з препаративною метою.
2.4. Утворення ангідридів кислот
У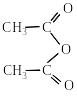 присутності водовіднімаючих засобів,
з яких частіше застосовують Р2О5,
карбонові кислоти при нагріванні
піддаються міжмолекулярній дегідратації
з утворенням ангідридів:
присутності водовіднімаючих засобів,
з яких частіше застосовують Р2О5,
карбонові кислоти при нагріванні
піддаються міжмолекулярній дегідратації
з утворенням ангідридів:
 2СН3СООН
P2O5
+
H2O.
2СН3СООН
P2O5
+
H2O.
ацетатний ангідрид
3. Заміщення водню при -карбоновому атомі
Внаслідок електроноакцепторних властивостей карбоксильної групи атоми водню при -карбоновому атомі набувають рухливості. Так, при обробці карбонових кислот хлором або бромом у присутності каталізатора РСІ3 або РВr3 атоми водню при -карбоновому атомі заміщуються на галоген:
 CH3–CH–COOH
+ Br2
→ CH3–CHCl–COOH
+ HBr.
CH3–CH–COOH
+ Br2
→ CH3–CHCl–COOH
+ HBr.
H
Ця реакція відома як реакція Гелля – Фольгарда – Зелинського. При наявності в -положенні двох атомів водню заміщенню може піддаватися один або два атоми водню.
4. Окиснення та відновлення
Монокарбонові кислоти, за виключенням мурашиної, досить стійкі до дії окисників. Мурашина кислота легко окиснюється KMnO4 та іншими окисниками з утворенням карбонатної кислоти, яка розкладається на СО2 та Н2О:
 HCOOH
[O]
CO2
+ H2O.
HCOOH
[O]
CO2
+ H2O.
При відновленні монокарбонові кислоти утворюють залежно від умов альдегіди або первинні спирти.
Окремі представники
Мурашина кислота (метанова кислота) НСООН. Безбарвна рідина з різким запахом (tплав = 8,4 °С, tкип = 100,8 °С), розчинна у воді, етанолі, ефірі. У вільному стані міститься у виділеннях залоз мурахів, у кропиві.
У зв’язку з особливістю будови (наявністю альдегідної групи) мурашина кислота дає реакцію «срібного дзеркала»:

При нагріванні з концентрованою сульфатною кислотою мурашина кислота розкладається з утворенням карбон (II) оксиду та води:
H−COOH H2SO4 CO + H2O.
Реакції з оксидом срібла та концентрованою сульфатною кислотою є якісними на мурашину кислоту.
Мурашина кислота широко використовується в органічному синтезі, як протрава при фарбуванні текстилю, у бджільництві проти вароатозу, для добування пестицидів та ін. У медицині мурашина кислота застосовується у вигляді 1 % спиртового розчину (мурашиний спирт) як розтирка при невралгіях, міозитах та ін.
Ацетатна кислота (етанова кислота) СН3–СООН. Безбарвна рідина з різким запахом, змішується з водою, етанолом, ефіром. Безводна («льодяна») ацетатна кислота має tплав =16 °С, tкип =118 °С.
Ця кислота знайшла широке застосування як реагент і розчинник в органічному синтезі, 3—6 % розчини застосовують як смакову приправу та консервант. У великих кількостях ацетатна кислота використовується у виробництві штучних волокон на основі целюлози, а також у синтезі лікарських препаратів.
н-Масляна кислота (бутанова кислота) СН3СН2СН2СООН. Безбарвна в’язка рідина з неприємним запахом (tкип = 163,5 °С), розчинна у воді та спирті. У вільному вигляді міститься у тваринних жирах, згірклому маслі, у поті. Добувають окисленням н-бутанолу або н-масляного альдегіду. Застосовують у синтезі запашних речовин, лікарських засобів, емульгаторів та ін. У вигляді складного ефіру з гліцерином входить до складу коров’ячого масла.
Ненасичені монокарбонові кислоти
До ненасичених карбонових кислот відносять карбонові кислоти, які містять у вуглеводневому радикалі кратний зв’язок.
У номенклатурі ненасичених кислот широко застосовуються тривіальні назви. За замісниковою номенклатурою ІЮПАК назви ненасичених кислот утворюють аналогічно насиченим, використовуючи суфікс -ен (-єн) для позначення подвійного зв’язку та суфікс -ин (-ін) для позначення потрійного, з указанням положення кратного зв’язку у вуглецевому ланцюзі. Назви деяких ненасичених монокарбонових кислот наведено у табл. 3.
Таблиця 3. Назви деяких ненасичених монокарбонових кислот
-
Формула
Назва
СН2=СН–СООН
Акрилова
СН2=С–СН2– СООН
СН3
Метакрилова
СН2=СН–СН2–СООН
Вінілацетатна
СН3–СН=СН–СООН
Кротонова
СН3–(СН2)7–СН=СН–(СН2)7−СООН
Олеїнова
СН3–(СН2)4–СН=СН– СН2–СН=СН–(СН2)4–СООН
Лінолева
СН3–СН2–СН=СН–СН2–СН=СН–СН2–СН=СН–(СН2)7–СООН
Ліноленова
У залежності від положення кратного зв’язку відносно карбоксильної групи, розрізняють а, –, , – та інші ненасичені кислоти, наприклад:
СН2=СН–СООН
,-ненасичена кислота
Для ненасичених монокарбонових кислот характерна структурна ізомерія, зумовлена різною структурою карбонового радикала і положенням кратного зв’язку, а також геометрична ізомерія, яка пов’язана з різним розміщенням замісників відносно площини подвійного зв’язку.
Для добування ненасичених кислот можна використовувати методи синтезу насичених кислот. Як вихідні речовини застосовуються ненасичені сполуки, наприклад окиснення ненасичених первинних спиртів і альдегідів за м’яких умов, гідроліз нітрилів та ін.
Фізичні властивості
За звичайних умов такі кислоти є безбарвними рідинами або кристалічними речовинами. Нижчі кислоти добре розчинні у воді, мають різкий подразнюючий запах. Зі збільшенням молекулярної маси кислоти розчинність у воді зменшується. Вищі ненасичені кислоти не розчинні у воді, але добре розчиняються в органічних розчинниках.
Хімічні властивості
Реакційна здатність ненасичених монокарбонових кислот зумовлена наявністю у їх структурі карбоксильної групи і кратного зв’язку.
За рахунок карбоксильної групи ненасичені кислоти вступають у реакції, характерні для насичених кислот, зокрема, вони утворюють солі, галогенангідриди, ангідриди, естери, аміди. По кратному зв’язку у вуглеводневому радикалі ненасичені кислоти виявляють властивості алкенів (алкінів). Так, для них характерні реакції приєднання, окиснення та полімеризації. Приєднання галогеноводнів до ,-ненасичених кислот проходить проти правила Марковникова. Це пояснюється електроноакцепторним впливом карбоксильної групи:
СН2=СН–СООН + Н–Br → BrCH2–CH2–COOH
трибромпропанова к-та
,-Ненасичені кислоти, особливо з потрійним зв’язком, є більш сильними кислотами у порівнянні з відповідними насиченими. Це пояснюється підвищенням стійкості аніона за рахунок делокалізації заряду по спряженій системі.
Окремі представники
Акрилова кислота СН2=СН–СООН. Безбарвна рідина з різким запахом, добре розчиняється у воді. Акрилова кислота легко полімеризується з утворенням поліакрилової кислоти. Важливе практичне значення мають полімери на основі естерів акрилової кислоти − поліакрилати:
nCH2=CH−COOR −(CH2 − CH )n −
COOR
У медицині поліакрилати знаходять застосування у виготовленні зубних протезів.
Метакрилова кислота СН2=С(СН3)–СООН. Безбарвна рідина (т. кип. 160,5 °С), легко полімеризується. Важливе значення має метиловий ефір метакрилової кислоти, полімеризацією якого добувають поліметилметакрилат – органічне скло (плексиглас):
CH3
nCH2=C(CH3)−COOR −(CH2 − C)n−
COOR
Олеїнова кислота
СН3–(СН2)7–СН=СН–(СН2)7–СООН. Безбарвна масляниста рідина без смаку та запаху. У вигляді естерів гліцерину входить до складу рослинних олій. Особливо багато міститься в оливковій, мигдальній та соняшниковій оліях.
Ароматичні карбонові кислоти
Ароматичними карбоновими (аренкарбоновими) кислотами називають органічні кислоти, в яких карбоксильна група безпосередньо сполучена з ароматичним ядром.
Найпростішим представником аренкарбонових кислот бензольного ряду є бензойна кислота.
У відповідності до номенклатурних правил
ІЮПАК інші гомологи цього ряду розглядають
як похідні бензойної кислоти, наприклад:
відповідності до номенклатурних правил
ІЮПАК інші гомологи цього ряду розглядають
як похідні бензойної кислоти, наприклад:
бензойна к-та 3-метилбензойна к-та
Карбонові кислоти, в яких карбоксильна група розміщена в боковому карбоновому ланцюзі ароматичного вуглеводню, розглядають як похідні кислот аліфатичного ряду:
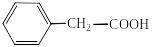
фенілацетатна к-та
Способи добування
Ароматичні карбонові кислоти можна одержати тими ж самими способами, що й аліфатичні.
Окиснення алкіларенів
Цей метод є одним з найчастіше застосовуваних для добування аренкарбонових кислот. Окисленню піддають головним чином метиларени. Як окисники звичайно використовують KМnО4, СrО3 або кисень у присутності солей кобальту та мангану:
C6H5–CH3 [O] C6H5COOH
толуол бензойна кислота
Гідроліз тригалогенепохідних ароматичних вуглеводнів
При нагріванні з водним розчином лугу ароматичних тригалогенопохідних, що містять атоми галогену при одному атомі Карбону, останні піддаються гідролізу, утворюючи аренкарбонові кислоти:
+ NaOH → + 3NaCl + H2O.
трихлорметилбензен
Гідроліз нітрилів
У водних розчинах кислот і лугів нітрили гідролізуються з утворенням карбонових кислот
C6H5–C≡N + H2O + H2SO4 → C6H5COOH + (NH4)2SO4.
Фізичні властивості
Ароматичні монокарбонові кислоти – безбарвні кристалічні речовини, деякі з них мають слабкий приємний запах. Нижчі гомологи малорозчинні у воді та переганяються з водяною парою. Аренкарбонові кислоти добре розчиняються в етанолі та ефірі.
Хімічні властивості
Реакційна здатність аренмонокарбонових кислот зумовлена наявністю в їх структурі карбоксильної групи та бензенового ядра.
По карбоксильній групі для них характерні реакції, властиві насиченим монокарбоновим кислотам а саме, утворення солей, галогенангідридів, ангідридів, етерів:

За кислотністю ароматичні монокарбонові кислоти перевищують насичені (крім мурашиної) та ненасичені монокарбонові кислоти аліфатичного ряду, що пов’язане з підвищенням стійкості аніона за рахунок делокалізації заряду по спряженій системі бензенового кільця.
В міру віддалення ароматичного ядра від карбоксильної групи кислотність зменшується.
При нагріванні аренкарбонових кислот у присутності мідного порошку або солей міді при 200 °С відбувається їх декарбоксилування:

t, Cu + CO2.
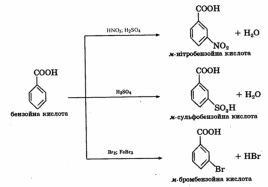
За рахунок бензенового кільця аренмонокарбонові кислоти вступають у реакції електрофільного заміщення (нітрування, сульфування, галогенування), властиві ароматичним вуглеводням. Карбоксильна група дезактивує бензольне кільце у відношенні до електрофільних реагентів, тому реакції електрофільного заміщення проходять значно важче, ніж для незаміщеного бензену. Будучи орієнтантом II роду, карбоксильна група спрямовує заміщення в мета-положення:
.
