
Розділ 2.
Тема 4. Похідні карбонових кислот
Галогенангідриди карбонових кислот
Г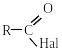 алогенангідридами
кислот називаються похідні кислот, у
яких гідроксил карбоксильної
групи заміщений на галоген .
Ці сполуки
називають також галоїдними
ацилами.
алогенангідридами
кислот називаються похідні кислот, у
яких гідроксил карбоксильної
групи заміщений на галоген .
Ці сполуки
називають також галоїдними
ацилами.
Номенклатура
Назви галогенангідридів будуються по типу галоїдних алкілів, але виходять у цьому випадку з назви ацильної групи. Наприклад:
 Н
–С=О
CН3−C=О
Н
–С=О
CН3−C=О
F Сl
фтористий форміл (формілфторид) хлористий ацетил (ацетилхлорид)
Способи одержання
Практично використовують наступні способи.
1. Дія на кислоти галоїдних сполук фосфору або тіоніл хлориду soCl2:
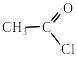
СН3СООН + PCl3 → + H3PO3.
СН3СООН + SOCl2 → CH3–COCl + SO2↑ + HCl↑.
ацетилхлорид
Останній спосіб зручний тим, що в якості побічних продуктів утворюються газоподібні речовини, тому продукт реакції легко одержати в чистому виді.
Фторангідриди готують із хлорангідридів реакцією обміну c KHF2:
R–COCl + KHF2 → R–COF + KC1 + HF.
Иодангідриди нестійки.
Властивості
Найбільш важливими є хлорангідриди. Хлорангідриди нижчих кислот – рідини з різким запахом, вищих кислот − тверді речовини, не розчинні у воді, але вступають із нею в реакцію гідролізу. Багато рідких хлорангідридів димлять на повітрі, тобто при взаємодії з вологою повітря утворюються крапельки кислоти:
R–СОС1 + Н2О → R–СООН + HC1.
Вони є дуже реакційно здатними речовинами. Реакційним центром є карбонільний атом Карбону, що несе значний позитивний заряд, що виникає під дією двох електронегативних атомів − Оксигену й Хлору. Тому карбонільний атом Карбону легко реагує з нуклеофільныими реагентами. На першій стадії відбувається приєднання нуклеофільного реагенту (води, спирту, аміну) по подвійному зв'язку С= О. Потім від проміжного продукту відщеплюється ННаl.
У результаті цих реакцій у молекулу органічної сполуки вводиться ацилъная група. Ці реакції звуться реакціями ацилування. До них належать:
1. Ацилювання води (гідроліз) – утворення кислот:
СН3−СОС1 + Н2О → СН3−СООН + НС1.
2. Ацилювання спирту (алкоголіз) – утворення естерів:
СН3−СОС1 + НО–С2Н5 → СН3−СОО−С2Н5 + НС1.
етилацетат
3. Ацилювання аміаку (амоноліз) – утворення амідів кислот:
C6H5−СОС1 + NH3 → C6H5−СОNH2 + НС1.
бензоїлхлорид бензамід
4. Ацилювання ароматичних вуглеводнів (синтез кетонів за методом Фриделя − Крафтса) розглядалося раніше.
Окремі представники
Хлористий ацетил СН3–СОС1 − рідина, нa повітрі димить, з водою реагує бурхливо. Широко використовується як ацилюючий засіб.
Хлористий бензоїл C6H5−СОС1, рідина, має неприємний подразнюючий запах. Використовується для різних синтезів як бензоїлюючий засіб.
Фосген СОС12, повний хлорангідрид вугільної кислоти, має запах свіжого сіна. У промисловості його одержують із СО й хлору в присутності активованого вугілля при 200 С:
СО + С12 → СОС12.
Фосген був використаний у першу світову війну в якості бойової отруйної речовини задушливої дії, більш токсичний, ніж хлор приблизно в 10 раз. Незважаючи крайню небезпеку роботи з фосгеном, його досить часто використовують у різних лабораторних синтезах і в промисловості.
