
- •Тема 2.1.
- •Класифікація, отримання та очищення
- •Дисперсних систем
- •Основні признаки дисперсних систем
- •Загальні властивості дисперсних систем
- •Класифікація дисперсних систем
- •Класифікація по дисперсності
- •Класифікація за агрегатним станом фаз
- •Класифікація по міжфазній взаємодії
- •Методи одержання колоїдних систем
- •Методи диспергування
- •4 . Ознайомлення з методами очищення колоїдних систем
- •Застосування ультрафільтрації і зворотного осмосу в деяких галузях харчової промисловості
- •Т2.1. «класифікація, отримання та очищення дисперсних систем»
- •Тема 2.2.
- •1.Теорія броунівського руху
- •2. Дифузійно-седиментаційна рівновага
- •3. Oптичні властивості колоїдних систем
- •4.Оптичні методи досліджень колоїдних систем
- •Тема: 2.3. Поверхневі явища і адсорбція план
- •Адсорбція , її види
- •2. Адсорбція на межі розчин – газ
- •3. Адсорбція на межі тверде тіло-газ
- •4. Капілярна конденсація
- •5. Молекулярна адсорбція з розчинів
- •Особливості адсорбції розчинених речовин із розчинів:
- •6. Іонообмінна адсорбція
- •7. Адсорбція з багатокомпонентних розчинів
- •8. Принцип хроматографічного аналізу
- •Значення сорбційних явищ
- •Шкідливість деяких поверхнево-активних речовин (пар)
- •Самостійна робота
- •«Поверхневі явища і адсорбція»
- •Тема 2.4. Електрокінетичні властивості, стабілізація і коагуляція золей план
- •Електрокінетичні явища
- •Будова міцели гідрозоля
- •Агрегативна стійкість золей
- •Коагуляція
- •5. Коагуляційні методи очищення промислових вод на підприємствах харчової промисловості
- •Роль процесів коагуляції при формуванні грунтів
- •Склад шампунів
- •Електричні властивості колоїдних систем
- •1.Запишіть рівняння реакції, що приводить до утворення золю.
- •2. Встановити склад ядра колоїдної частинки.
- •3. Встановити, яка з речовин знаходиться в надлишку.
- •8. Продовжити схему будови міцели, записавши шар противоіонів.
- •9. Зафіксувати знак заряду записаної вами системи - колоїдної частинки:
- •Самостійна робота
- •Т 2.4. «електрокінетичні властивості, стабілізація і коагуляція золів»
- •Тема 2.5. Структуроутворення в дисперсних системах план
- •Вільнодисперсні та зв’язанодисперсні системи
- •2. Гелеутворення. Тиксотропія. Синерезис гелів
- •3. В’язкість дисперсних систем
- •4. Рівняння н’ютона та шведова-бінгама
- •5. Криві течії
- •Тема 2.6 мікрогетерогенні і грубодисперсні системи
- •1. Загальні відомості
- •2. Суспензії, їх стабілізація
- •Характеристика суспензій
- •Одержання суспензій
- •Властивості суспензій
- •Застосування суспензій
- •3. Емульсії та їх одержання
- •Визначення емульсій та поширення в природі
- •4. Піни, їх будова і стійкість
- •Будова пін та їх визначення
- •Одержання пін
- •Характеристика піноутворювачів та їх значення
- •Застосування пін
- •Можливі джерела утворення, тип і форма деяких пін у харчовій промисловості і продуктах харчування
- •Аерозолі та їх властивості
- •Розміри частинок димів і туманів
- •Захист навколишнього середовища від диму, пилу тощо
- •Порошки
- •Визначення порошків та їх розміри
- •Методи одержання порошків
- •Особливості порошків
- •Аерозолі та їх використання
- •Правда і вигадка про аерозолі
- •По темі 2.6. «Мікрогетерогенні та грубодисперсні системи»
- •Тема 2.7. Розчинення високомолекулярних сполук план
- •1. Будова молекул високомолекулярних сполук
- •Конформації макромолекул високомолекулярних сполук
- •Природні і синтетичні високомолекулярні з’єднання
- •3. Набухання полімерів
- •Набухання в технології харчових виробництв
- •Загальна характеристика розчинів полімерів
- •4. Драглі, їх утворення
- •Характеристика нових синтетичних полімерів
- •Функції білків в організмі
- •Характеристика меду
- •Склад губної помади
- •Самостійна робота
- •Термінологічний словник
- •Література
Методи одержання колоїдних систем
Методи та умови одержання колоїдних систем диктуються особливостями колоїдного стану, будовою і властивостями колоїдних міцел. Теоретично будь-яку речовину можна приготувати в колоїдному стані.
За розміром частин золі займають проміжне положення між істинними розчинами і грубодисперсними системами – порошками, суспензіями, емульсіями. Тому всі методи одержання колоїдних систем можна розробити на дві основні групи:
1) диспергування – подрібнення крупних частинок грубодиспердних систем до колоїдної дисперсності;
2) конденсація – поєднання атомів, іонів або молекул в більш крупні частинки (агрегати) колоїдних розмірів.
 І
І стинні
Колоїдні
Грубодисперсні
стинні
Колоїдні
Грубодисперсні
розчини системи системи
Методи конденсації Методи диспергування
Середовище, у якому відбувається дроблення або конденсація, стає дисперсійним середовищем дисперсної системи.
До загальних умов одержання колоїдних систем незалежно від заснованих методів відносяться наступні:
1) нерозчинність речовини дисперсної фази в дисперсійному середовищі;
2) досягнення колоїдної дисперсності частинками дисперсної фази;
3) наявність в системі, в якій утворюються частинки дисперсної фази, третього компонента – стабілізатора, який надає колоїдній системі агрегативної стійкості.
Стабілізаторами можуть служити речовини, спеціально вводимі в дисперсійне середовище (електроліти, поверхнево-активні речовини), або продукти взаємодії дисперсної фази з дисперсійним середовищем. Навколо колоїдних частинок молекули стабілізатора створюють адсорбційний захисний шар, що не дає частинкам можливості збільшувати розміри (агрегирування).
Колоїдний стан характеризується наступними основними признаками:
1) певними розмірами частинок дисперсної фази (від 10-7 до 10-5см),
2) гетерогенністю,
3) багатокомпонентністю.
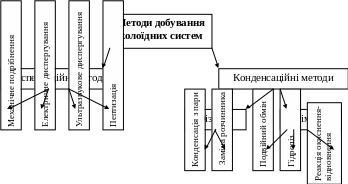
Методи диспергування
Найбільш широко застосовують механічне диспергування, при якому крупні частинки суспензій, емульсій або порошків роздавлюють дроблять або розтирають.
При механічному подрібненні відбувається подолання сил міжмолекулярної взаємодії і накопичення вільної поверхневої енергії за рахунок зовнішньої механічної роботи. Для подрібнення використовують дробарки, жорнова і млини різної конструкції, де тверді тіла подрібнюються, розтираються, розтискуються або розщеплюються, а рідкі збовтуються, енергійно перемішуються або видаляються в дисперсійне середовище під великим тиском.
Диспергування твердих тіл в рідкому середовищі завжди більш ефективніше, ніж “сухе” дроблення, бо рідини, які змочують тверде тіло, сприяють зниженню його міцності при механічній обробці. Введення в рідину поверхнево-активних речовин або електролітів ще в більшій степені сприяють диспергуванню (ефект Ребіндера).
Необхідно мати на увазі, що методами механічного диспергування навіть в присутності стабілізатора можна одержати дисперсні системи тільки з частинками, розмір яких наближається до колоїдних. Іншими словами, «істинно-колоїдний» ступінь дисперсності важко досягти шляхом диспергування.
До методів механічного диспергування відноситься також дроблення під дією ультразвуку. Таким шляхом можна одержати органозолі легкоплавких металів, гідрозолі сірки, графіту, різних полімерів.
Диспергування за допомогою ультразвукових коливань, тобто коливань з частотою вище 20 000 за секунду, які не уловлюються людським вухом, є ефективним лише для речовин з невеликою міцністю. До таких речовин необхідно віднести смоли, сірку, графит, фарби, метали (свинець, ртуть тощо), крохмаль, каучук, желатин.
Метод електричного диспергування оснований на утворенні вольтової дуги між електродами з металу, що напилюється на електрод, розміщені в охолодженій воді.
Два електроди з металу, золь якого намагаються отримати, занурюють в рідину (рис.1), потім наближують їх і пропускають струм силою 5-10А та напругою на електродах близько 100В. Під рідиною у сфері дуги відбувається відрив частинок від електродів, які поступають в середовище і утворюють золь.

Рис.1. Електричне диспергування
В зв’язку з тим, що в зоні вольтової дуги розвивається висока температура, необхідно мати на увазі, що це може стати причиною окиснення металів і зайняття середовища у випадку органічних рідин. Тому таким способом отримують гідрозолі (дисперсійне середовище – вода) металів: срібла, золота, платини.
Цей метод відносять до диспергування умовно, бо при температурі вольтової дуги метали, а потім пари конденсуються в холодній рідині.
До методів диспергування відносять також метод пептизації. Він полягає в тому, що до свіжоприготовленого розсипчастого осаду диспергированої речовини прибавляють розчин електроліту (стабілізатора), під дією якого частинки осаду відділяються одна від одної і переходять в золь.
Під виразом “свіжоприготовлений” осад розуміють пухкий осад, між частинками якого є прошарки дисперсійного середовища незалежно від часу його існування. В принципі, процес дроблення в цьому методі не здійснюється, бо частинки осаду вже мають колоїдну дисперсність, а прибавлений електроліт - стабілізатор - тільки придає системі агрегативну стійкість.
Таким методом, наприклад, можна одержати червоно-коричневий гідрозоль гідроксиду заліза. Для цього спочатку виділяють осад гідроксиду заліза, добре його промивають, потім переносять в колбу з дистильованою водою і добавляють трохи розчину хлориду заліза (ІІІ). Через деякий час осад переходить в стан золя.
Методи конденсації
До цієї групи методів відносять одержання золей конденсацією парів, заміною розчинника і за допомогою різних хімічних реакцій.
Конденсація – це процес, в основі якого лежить виникнення нової фази шляхом з’єднання молекул, атомів або іонів в гомогенному середовищі.
При пропусканні пари речовини у рідину в результаті конденсації утворюється стійкий ліозоль. У газовому середовищі конденсацією пари різних речовин одержують аерозолі. Найбільш наочним прикладом одержання золей конденсацією парів є утворення туману (диму). При пониженні температури тиск пари може стати більше його рівноважного тиску над рідиною (або над твердим тілом). Внаслідок цього в газовій фазі утворюються великі агрегати молекул у вигляді краплинок рідини (туман) або твердих частинок (дим). Так наприклад, одержують маскирувальний дим при охолодженні парів Р2О5.
Метод заміни розчинника полягає в тому, що розчин речовини додають невеликими порціями до рідини, яка змішується з розчинником, у якому речовина мало розчинна, і практично виділяється у вигляді високодисперсної фази, тобто утворюється ліозоль. Саме утворенням золей пояснюється помутніння одеколона і духів при введенні в них води.
Хімічна конденсація. Колоїдні системи можна одержати в результаті хімічних реакцій майже всіх типів: реакцій обміну, окисно-відновних, гідроліза тощо. Обов”язковою умовою одержання колоїдних систем в цьому випадку є утворення малорозчинної речовини, низька концентрація реагуючих речовин і для реакції між розчиненими речовинами – надлишком одного з реагентів, який необхідний як стабілізатор колоїдної системи.
Один істинний розчин поволі вливають в інший при енергійному перемішуванні. У таких умовах утворюються дрібні кристали, які встигають покритися подвійним електричним шаром за рахунок іонів електроліту, який є в надлишку.
Типовий приклад одержання колоїдної системи – утворення білого аерозолю хлориду амонію в результаті реакції між газоподібним хлоридом гідрогену і аміаком:
HCl + NH3 = NH4Cl
При окисненні сірководню сірчаної кислоти утворюється блідо-голубий гідро золь сірки:
2Н2S + H2SO3 = 3S + 3H2O
Золь хлориду срібла можна отримати за допомогою реакції обміну, змішуючи дуже розбавлені розчини хлориду натрія і нітрату срібла.
NaCl + AgNO3 = AgCl + NaNO3
При цьому одна з вихідних речовин повинна бути в надлишку, щоб служити стабілізатором одержаного гідрозоля. Якщо речовини будуть взяті в еквівалентних кількостях, то золь не утвориться і хлорид срібла випаде у вигляді осаду. Осад хлориду срібла утворюється і при змішуванні концентрованих розчинів. Розчини повинні мати низьку концентрацію.
