
- •Тема 2.1.
- •Класифікація, отримання та очищення
- •Дисперсних систем
- •Основні признаки дисперсних систем
- •Загальні властивості дисперсних систем
- •Класифікація дисперсних систем
- •Класифікація по дисперсності
- •Класифікація за агрегатним станом фаз
- •Класифікація по міжфазній взаємодії
- •Методи одержання колоїдних систем
- •Методи диспергування
- •4 . Ознайомлення з методами очищення колоїдних систем
- •Застосування ультрафільтрації і зворотного осмосу в деяких галузях харчової промисловості
- •Т2.1. «класифікація, отримання та очищення дисперсних систем»
- •Тема 2.2.
- •1.Теорія броунівського руху
- •2. Дифузійно-седиментаційна рівновага
- •3. Oптичні властивості колоїдних систем
- •4.Оптичні методи досліджень колоїдних систем
- •Тема: 2.3. Поверхневі явища і адсорбція план
- •Адсорбція , її види
- •2. Адсорбція на межі розчин – газ
- •3. Адсорбція на межі тверде тіло-газ
- •4. Капілярна конденсація
- •5. Молекулярна адсорбція з розчинів
- •Особливості адсорбції розчинених речовин із розчинів:
- •6. Іонообмінна адсорбція
- •7. Адсорбція з багатокомпонентних розчинів
- •8. Принцип хроматографічного аналізу
- •Значення сорбційних явищ
- •Шкідливість деяких поверхнево-активних речовин (пар)
- •Самостійна робота
- •«Поверхневі явища і адсорбція»
- •Тема 2.4. Електрокінетичні властивості, стабілізація і коагуляція золей план
- •Електрокінетичні явища
- •Будова міцели гідрозоля
- •Агрегативна стійкість золей
- •Коагуляція
- •5. Коагуляційні методи очищення промислових вод на підприємствах харчової промисловості
- •Роль процесів коагуляції при формуванні грунтів
- •Склад шампунів
- •Електричні властивості колоїдних систем
- •1.Запишіть рівняння реакції, що приводить до утворення золю.
- •2. Встановити склад ядра колоїдної частинки.
- •3. Встановити, яка з речовин знаходиться в надлишку.
- •8. Продовжити схему будови міцели, записавши шар противоіонів.
- •9. Зафіксувати знак заряду записаної вами системи - колоїдної частинки:
- •Самостійна робота
- •Т 2.4. «електрокінетичні властивості, стабілізація і коагуляція золів»
- •Тема 2.5. Структуроутворення в дисперсних системах план
- •Вільнодисперсні та зв’язанодисперсні системи
- •2. Гелеутворення. Тиксотропія. Синерезис гелів
- •3. В’язкість дисперсних систем
- •4. Рівняння н’ютона та шведова-бінгама
- •5. Криві течії
- •Тема 2.6 мікрогетерогенні і грубодисперсні системи
- •1. Загальні відомості
- •2. Суспензії, їх стабілізація
- •Характеристика суспензій
- •Одержання суспензій
- •Властивості суспензій
- •Застосування суспензій
- •3. Емульсії та їх одержання
- •Визначення емульсій та поширення в природі
- •4. Піни, їх будова і стійкість
- •Будова пін та їх визначення
- •Одержання пін
- •Характеристика піноутворювачів та їх значення
- •Застосування пін
- •Можливі джерела утворення, тип і форма деяких пін у харчовій промисловості і продуктах харчування
- •Аерозолі та їх властивості
- •Розміри частинок димів і туманів
- •Захист навколишнього середовища від диму, пилу тощо
- •Порошки
- •Визначення порошків та їх розміри
- •Методи одержання порошків
- •Особливості порошків
- •Аерозолі та їх використання
- •Правда і вигадка про аерозолі
- •По темі 2.6. «Мікрогетерогенні та грубодисперсні системи»
- •Тема 2.7. Розчинення високомолекулярних сполук план
- •1. Будова молекул високомолекулярних сполук
- •Конформації макромолекул високомолекулярних сполук
- •Природні і синтетичні високомолекулярні з’єднання
- •3. Набухання полімерів
- •Набухання в технології харчових виробництв
- •Загальна характеристика розчинів полімерів
- •4. Драглі, їх утворення
- •Характеристика нових синтетичних полімерів
- •Функції білків в організмі
- •Характеристика меду
- •Склад губної помади
- •Самостійна робота
- •Термінологічний словник
- •Література
Класифікація дисперсних систем
Об’єкти колоїдної хімії дуже різноманітні. Тому їх не можна класифікувати одним способом за однією якоюсь ознакою.
Дисперсні системи класифікують за наступними ознаками: за
розмірами частинок, агрегатним станом дисперсної фази та дисперсійного середовища, характером взаємодії між дисперсною фазою та середовищем тощо.
Сучасні фізико-хімічні методи дослідження дисперсних систем –
електронна мікроскопія, рентгенівський аналіз, ультрамікроскопія – дають можливість в достатній мірі вірогідно встановити розмір та форму дисперсних частинок.
Класифікація по дисперсності
В залежності від розміру частинок дисперсні системи розділяються на ультрамікрогетерогенні або колоїдні, розмір частинок яких лежить в межах 10-7-10-5см, мікрогетерогенні з розміром частинок 10-5-10 -3см і грубодисперсні з частинками, розмір яких перевищує 10-3см. Це ділення умовне і межі між ними (особливо для двох останніх систем) приблизний.
В залежності від розміра частинок змінюється питома поверхня і властивості систем. Дисперсні системи з частинками розміром більше, ніж 10-3см-10-5см, мають невелику питому поверхню. Такі частинки видно в звичайний мікроскоп. Якщо такі частинки розподілити в рідині, або газі, вони поступово осідають або спливають тобто вони відносно не стійкі.
-
Дисперсні системи


Молекулярно- дисперсні 10-9м і менше
|
|
Колоїдно- дисперсні 10-7 – 10-9м |
|
Грубодисперсні та мікрогетеро- генні 10-4 – 10-7м |
При переході до колоїдних систем спостерігаються різкі зміни властивостей. Колоїдні частинки вже не можна побачити в звичайному оптичному мікроскопі бо вони менші довжини хвилі видимого світла, але вони добре спостерігаються в ультрамікроскопі. Для цих гетерогенних систем з досить великою питомою поверхнею характерний розподіл частинок по всьому об’єму. Колоїдні розчини відносно стійкі, але з часом руйнуються. При створенні колоїдних систем витрачається зовнішня енергія.
Дисперсні системи з частинками колоїдних розмірів прийнято називати золями. До колоїдних відносяться і системи, розмір частинок яких хоча б в одному з трьох вимірів лежить в межах 10-7 – 10-5см.
Якщо частинки досягають розмірів порядку 10-8см, то поверхня розподілу фаз зникає. Це область гомогенних молекулярно-дисперсних систем – істинних розчинів. Ці розчини стійкі, не руйнуються, не розсіюють світло і утворюються самодовільно.
З

 а
дисперсністю
системи ділять на три типи:
а
дисперсністю
системи ділять на три типи:
-
грубодисперсні (грубі суспензії, емульсії, порошки)
колоїднодисперсні
(золі)
молекулярні або іонні розчини
розмір часток (радіус), м
10-4 – 10-7
10-7 – 10-9
Основний об'єкт вивчення колоїдної хімії. Тут вивчаються не іони й молекули, а агрегати, що складаються зі звичайних молекул - міцели (макромолекули) від 100 до 1 нм.
кишкова паличка 3 10-6м
вірус грипу 10-7м
золь золота 10-8 м
менше10-9
Це істинні розчини - найбільш вивчені. Системи рівноважні, термодинамічно стійкі.
Зі зміною розмірів часток змінюються кінетичні, оптичні, каталітичні й інші властивості:
-
не прозорі, відбивають світло;
не проходять через фільтр;
гетерогенні;
видні в оптичний мікроскоп;
осідають або спливають.
прозорі, що опалесцирують - розсіюють світло;
фільтруються;
гетерогенні;
видні в електронний мікроскоп;
осідають поступово.
прозорі;
фільтруються;
гомогенні;
не видні в сучасні мікроскопи.
Це розподіл умовний і межі між ними приблизні.
Золі в залежності від розмірів часток можуть мати різне забарвлення, а в істинних розчинів воно однакове. Наприклад, золі золота можуть бути синіми, рубіново-червоними.

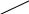
 Sпит. Молекулярно-дисперсні
системи (гомогенні)
Sпит. Молекулярно-дисперсні
системи (гомогенні)


 Колоїдні
системи – золі
(ультрамікрогетерогенні)
Колоїдні
системи – золі
(ультрамікрогетерогенні)
 Повер-
Повер-
хня роз
ділу

 фаз
Частинки Мікрогетерогенні системи
фаз
Частинки Мікрогетерогенні системи
зникає равномірно

 Істинні
розподіля- Грубодисперсні
системи
Істинні
розподіля- Грубодисперсні
системи
розчини- ються Частинки
по всьому осідають
 об”єму
або спли- Макротіла
об”єму
або спли- Макротіла
 вають
вають
10-7 10-5 10-3 10-1 см
Знання розмірів чи форми частинок недостатньо для повної характеристики системи, оскільки при цьому не враховуються властивості дисперсної фази та дисперсійного середовища. Тому найбільш поширена класифікація колоїдних систем за агрегатним станом та дисперсійним середовищем.
