
- •Тема 2.1.
- •Класифікація, отримання та очищення
- •Дисперсних систем
- •Основні признаки дисперсних систем
- •Загальні властивості дисперсних систем
- •Класифікація дисперсних систем
- •Класифікація по дисперсності
- •Класифікація за агрегатним станом фаз
- •Класифікація по міжфазній взаємодії
- •Методи одержання колоїдних систем
- •Методи диспергування
- •4 . Ознайомлення з методами очищення колоїдних систем
- •Застосування ультрафільтрації і зворотного осмосу в деяких галузях харчової промисловості
- •Т2.1. «класифікація, отримання та очищення дисперсних систем»
- •Тема 2.2.
- •1.Теорія броунівського руху
- •2. Дифузійно-седиментаційна рівновага
- •3. Oптичні властивості колоїдних систем
- •4.Оптичні методи досліджень колоїдних систем
- •Тема: 2.3. Поверхневі явища і адсорбція план
- •Адсорбція , її види
- •2. Адсорбція на межі розчин – газ
- •3. Адсорбція на межі тверде тіло-газ
- •4. Капілярна конденсація
- •5. Молекулярна адсорбція з розчинів
- •Особливості адсорбції розчинених речовин із розчинів:
- •6. Іонообмінна адсорбція
- •7. Адсорбція з багатокомпонентних розчинів
- •8. Принцип хроматографічного аналізу
- •Значення сорбційних явищ
- •Шкідливість деяких поверхнево-активних речовин (пар)
- •Самостійна робота
- •«Поверхневі явища і адсорбція»
- •Тема 2.4. Електрокінетичні властивості, стабілізація і коагуляція золей план
- •Електрокінетичні явища
- •Будова міцели гідрозоля
- •Агрегативна стійкість золей
- •Коагуляція
- •5. Коагуляційні методи очищення промислових вод на підприємствах харчової промисловості
- •Роль процесів коагуляції при формуванні грунтів
- •Склад шампунів
- •Електричні властивості колоїдних систем
- •1.Запишіть рівняння реакції, що приводить до утворення золю.
- •2. Встановити склад ядра колоїдної частинки.
- •3. Встановити, яка з речовин знаходиться в надлишку.
- •8. Продовжити схему будови міцели, записавши шар противоіонів.
- •9. Зафіксувати знак заряду записаної вами системи - колоїдної частинки:
- •Самостійна робота
- •Т 2.4. «електрокінетичні властивості, стабілізація і коагуляція золів»
- •Тема 2.5. Структуроутворення в дисперсних системах план
- •Вільнодисперсні та зв’язанодисперсні системи
- •2. Гелеутворення. Тиксотропія. Синерезис гелів
- •3. В’язкість дисперсних систем
- •4. Рівняння н’ютона та шведова-бінгама
- •5. Криві течії
- •Тема 2.6 мікрогетерогенні і грубодисперсні системи
- •1. Загальні відомості
- •2. Суспензії, їх стабілізація
- •Характеристика суспензій
- •Одержання суспензій
- •Властивості суспензій
- •Застосування суспензій
- •3. Емульсії та їх одержання
- •Визначення емульсій та поширення в природі
- •4. Піни, їх будова і стійкість
- •Будова пін та їх визначення
- •Одержання пін
- •Характеристика піноутворювачів та їх значення
- •Застосування пін
- •Можливі джерела утворення, тип і форма деяких пін у харчовій промисловості і продуктах харчування
- •Аерозолі та їх властивості
- •Розміри частинок димів і туманів
- •Захист навколишнього середовища від диму, пилу тощо
- •Порошки
- •Визначення порошків та їх розміри
- •Методи одержання порошків
- •Особливості порошків
- •Аерозолі та їх використання
- •Правда і вигадка про аерозолі
- •По темі 2.6. «Мікрогетерогенні та грубодисперсні системи»
- •Тема 2.7. Розчинення високомолекулярних сполук план
- •1. Будова молекул високомолекулярних сполук
- •Конформації макромолекул високомолекулярних сполук
- •Природні і синтетичні високомолекулярні з’єднання
- •3. Набухання полімерів
- •Набухання в технології харчових виробництв
- •Загальна характеристика розчинів полімерів
- •4. Драглі, їх утворення
- •Характеристика нових синтетичних полімерів
- •Функції білків в організмі
- •Характеристика меду
- •Склад губної помади
- •Самостійна робота
- •Термінологічний словник
- •Література
3. Адсорбція на межі тверде тіло-газ
У 1773 році швецький хімік Шеєле описав досліди з поглинанням газів вугіллям. Перші систематичні дослідження поглинання газів проведені швейцарським хіміком Соссюром у 1814 році. У ХХ сторіччі явище адсорбції одержало теоретичне обґрунтування в роботах Гіббса, Ленгмюра, Поляні та інших вчених. Фундаментальні роботи М.Д.Зелінського та М.О.Шилова з адсорбції газів на активованому вугіллі, викликані розробкою протигазів в часи першої світової війни, були поштовхом до подальшого вивчення адсорбції на твердих адсорбентах.
Враховуючи, що адсорбція відбувається на поверхні адсорбенту, то чим більшою буде поверхня, тим вище його здатність до адсорбції. Особливе значення мають нерівності поверхні, оскільки інтенсивно адсорбція відбувається на активних центрах (кутах, ребрах кристалів, мікровиступах поверхні, там, де містяться атоми, що мають ненасичені вільні валентності).
Кількість адсорбтиву, що адсорбується певним адсорбентом, залежить від природи адсорбенту і газу, від тиску та температури. При сталій температурі адсорбція газу є функцією тиску газу. Ця функціональна залежність називається ізотермою адсорбції.
Адсорбція газів на твердому адсорбенті - найпростіший варіант адсорбції. Розглядаючи процес адсорбції газу на межі поділу з твердою фазою, Ленгмюр (американський фізикохімік, лауреат Нобелівської премії 1932р.) розвинув теорію мономолекулярної адсорбції, основні положення якої наступні.
Адсорбція викликається валентними силами, або силами залишкової хімічної валентності.
Адсорбція відбувається на активних центрах, якими можуть бути виступи, неоднорідності поверхні, ребра і кути кристалів, тобто місця не насиченості силового поля, дефекти поверхні тощо. Ленгмюра називав їх «елементарними ділянками».
На поверхні адсорбенту утворюється тільки мономолекулярний шар молекул адсорбату, тобто існує адсорбційне насичення (межа адсорбції).
Адсорбція локалізована, і молекули адсорбату не переміщуються по поверхні, а кожний центр взаємодіє тільки з однією молекулою адсорбату.
Адсорбовані молекули не взаємодіють між собою.
Рівновага має динамічний характер (↔)
Виходячи з цих умов, Ленгмюра вивів рівняння ізотерми адсорбції:
вр
Г = Г∞•―――,
1 +вр
де в – константа, що характеризує поверхневу активність речовини;
Г∞ - гранична адсорбція (максимальна);
р – тиск пари адсорбату.
Для низьких значень тиску рівняння Ленгмюра набуває вигляду:
Г = Г∞• вр
Це свідчить, що при низьких значеннях тиску спостерігається прямо пропорційний зв’язок між адсорбцією та тиском газу, що адсорбується.
При високих значеннях тиску рівняння Ленгмюра буде мати інший вигляд, а саме:
Г = Г∞
Адсорбція газу на твердому адсорбенті йде самочинно одночасно з адсорбцією протікає протилежний процес-десорбція - перехід адсорбованих молекул в газову фазу. При рівності швидкості цих двох процесів наступає динамічна рівновага.
Динамічна рівновага в процесі адсорбції настає тоді, коли число молекул, що адсорбуються на поверхні твердого тіла, дорівнює числу молекул, що десорбуються з тієї ж поверхні за однакові проміжки часу. При рівновазі концентрація газу в оточуючому середовищі (його тиск) і концентрація газу на поверхні адсорбента постійні. Із збільшенням тиску газу до повної межі збільшується і адсорбція.
На адсорбційну рівновагу великий вплив має температура. З підвищенням температури адсорбція зменшується в результаті збільшення теплового руху молекул.
Пониження температури, навпаки, приводить до збільшення адсорбції. Тому адсорбційну рівновагу завжди розглядають при постійній температурі.
Графічна залежність величини адсорбції від рівноважного тиску (концентрації) при постійній температурі називається ізотермою адсорбції. Ізотерма (рис.13) складається з трьох ділянок. При малих тисках ізотерма прямолінійна, тобто адсорбція збільшується пропорційно рівноважному тиску. При досить великих тисках ізотерма має вигляд горизонтальної прямої, тобто із збільшенням тиску адсорбція не змінюється. Це межа адсорбції, що відповідає повному насиченню поверхні адсорбенту молекулами адсорбтиву. Середина ізотерми відповідає ще неповному насиченню поверхні.
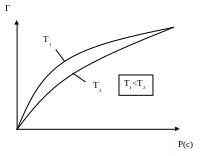
Рис.13. Ізотерма адсорбції.
Ізотерма для більш високих температур Т2 лежить нижче ізотерми для температури Т1, але за характером вони однакові.
Межа адсорбції не залежить від температури, але при більш високій температурі вона наступає при більшому рівноважному тиску.
По формі ізотерма нагадує параболу і тому для її аналітичного виразу Фрейндліхом (німецький фізикохімік) було запропоновано емпіричне рівняння:
Х/т=Кp1|n,
де X - кількість адсорбованого газу;
т - маса адсорбенту;
р - рівноважний тиск газу;
К і 1/п - сталі величини.
Рівняння Фрейндліха можна застосувати для досить невеликого інтервалу середніх значень тиску, в якому ізотерма адсорбції має вигляд кривої. Воно не застосовується для описання адсорбції при дуже малих і великих тисках, коли ізотерма адсорбції прямолінійна.
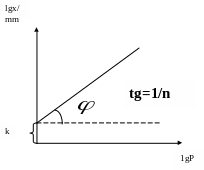 Логарифмуючи
рівняння Фрейндліха, одержимо рівняння
прямої lgх/m=1/п 1gр+1gк. По графіку цього
рівняння, побудованого в координатах
1g(х/m) –1gр, легко знайти постійні 1/n
і k. В.
Логарифмуючи
рівняння Фрейндліха, одержимо рівняння
прямої lgх/m=1/п 1gр+1gк. По графіку цього
рівняння, побудованого в координатах
1g(х/m) –1gр, легко знайти постійні 1/n
і k. В.
Рис. 14 Графік рівняння Фрейндліха
