
Основы органической химии
Классификация органических реакций. Углеводороды. Алканы. Алкины.
Алкены. Ароматические углеводороды. Оксисоединения. Липиды. Углеводы.
Органические соединения азота
Таблица 1
Классификация органических реакций по механизму
Исходное вещество |
Продукты разрыва связи С – Х |
Вид разрыва связи |
|
углеводородный радикал |
Гомолиз |
С – Х |
Карбанион |
Гетеролиз |
С – Х |
Карбактион |
Таблица 2
Классификация органических реакций по типу
Название Реакции |
Условное Обозначение |
Пример |
Присоединение |
А |
СН2 = СН2 + НBr → CH2 – CH3 | Br |
Отщепление |
Е |
CH2 – CH3 → CH2 = CH2 + HBr | Br |
Замещение |
S |
HO – + CH3Br → CH3 – OH + Br – |
Таблица 3
Важнейшие органические реакции
Название |
Реагент |
Окисление |
+ О2 |
Гидрирование |
+ Н2 |
Дегидрирование |
– Н2 |
Продолжение таблицы 3 |
|
Название |
Реагент |
Гидратация |
+ Н2О |
Дегидратация |
– Н2О |
Гидролиз |
+ Н2О |
Этерификация |
– Н2О |
Карбоксилирование |
+ СО2 |
Декарбоксилирование |
– СО2 |
Нитрование |
+ НNО3 |
Таблица 4
Виды изомерии
Вид изомерии |
Примеры формул |
||
молекулярная |
Структурная |
||
Структурная |
С4Н10 |
CH3 – CH2 – CH2 – CH3 Бутан
|
|
СН | CH3 – CH – CH3 изобутан (2-метилпропан)
|
|||
|
С4Н8 |
Н3С Н
С || С
Н3С Н
2-бутен ЦИС-форма
|
Н3С Н
С || С
Н СН3
2-бутен транс-форма
|
|
|
|
|
Продолжение таблицы 4 |
|||
Вид изомерии |
Примеры формул |
||
молекулярная |
Структурная |
||
|
С3Н6О2 |
O
C – OH | H – C*– OH | CH3
молочная кислота Д – изомер
|
O
C – OH | HО– C*– H | CH3
молочная кислота L – изомер
|
Таблица 5
Функциональные группы и классы органических соединений
Группа |
Название группы |
Класс соединений |
– С ОН |
Карбоксил |
карбоновые кислоты |
– С О – С |
алкоксикарбонил |
сложные эфиры |
О – С NН2 |
карбоксамидная |
Амиды |
– C ≡ N |
Циан |
Нитрилы |
О – С Н |
Карбонил |
Альдегиды |
O || – C – |
Карбонил |
Кетоны |
– OH |
Гидроксил |
Спирты |
– SH |
Тиольная |
Тиолы |
– NH2 |
Амино |
Амины |
– F (Cl, Br, I) |
фтор (галоген) |
Галогенпроизводные |
Углеводороды
Таблица 6
Классификация углеводородов
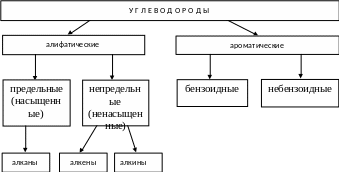
Алканы

Общая
формула ![]()
Таблица 7
Реакции алканов
Тип реакции |
Разновидности |
Образующиеся продукты |
1. Замещение атомов водорода |
а) галогенами (–F, –Cl, –Br, –I) |
Галогенводороды |
б) нитрогруппой (–NO2) |
Нитросоединения |
|
в) сульфогруппой (–SO3H) |
Сульфопроизводные |
|
2. Окисление |
а) ≈ 3000С |
CO2, H2O и Q |
б) ≈ 2000С, катализаторы (KM4O4, К2CrO4, K2Cr2O7) |
спирты, альдегиды, кетоны, карбоновые кислоты |
|
|
|
|
Продолжение таблицы 7 |
||
Тип реакции |
Разновидности |
Образующиеся продукты |
3. Крекинг |
а) термический (450-7000С) |
смесь алканов и алкенов |
б) каталитический |
смесь разветвленных алканов |
|
Алкены
Общая
формула ![]()
Таблица 8
Реакции алкенов
Тип реакции |
Разновидности |
Образующиеся продукты |
1. Присоединение |
а) водорода |
Алканы |
б) галогена |
вицинальные дигалогенопроизводные |
|
в) галогеноводорода |
моногалогенопроизводные* |
|
г) воды |
спирты* |
|
д) серной кислоты |
сульфоновые кислоты* |
|
2. Окисление |
а) в нейтральной среде (О + НОН) реакция Вагнера |
двухатомные спирты-диолы |
б) в кислой среде |
смесь кетонов и карбоновых кислот |
|
3. Полимеризация |
а) димеризация |
Димер |
б) тримеризация |
Триммер |
|
в) полимеризация |
Полимер |
* – реакции присоединения к несимметричным алкенам идут по правилу Марковникова.
Таблица 9
Правило Марковникова
Сущность |
Схема |
||
несимметричный алкен |
реагент |
продукт |
|
|
CH3 – CH = CH2 + +H-Nu– → CH3 – CH – CH3 ׀ Nu |
||
Алкины
Общая
формула ![]()
Таблица 10
Реакции алкинов
Тип реакции |
Разновидности |
Образующиеся Продукты |
1. Присоединение |
а) водорода |
Алкены |
б) галогена |
дигалогенопроизводные |
|
в) галогеноводорода |
моногалогенопроизводные* |
|
г) воды |
альдегиды и кетоны |
|
д) спирта |
алкилвиниловые эфиры |
|
2. Окисление |
а) на воздухе или в кислороде |
СО2, Н2О и Q |
б) в кислой среде |
карбоновые кислоты |
|
3. Замещение |
водорода у тройной связи на металл |
металлоорганические производные алкинов |
|
|
|
Продолжение таблицы 10 |
||
Тип реакции |
Разновидности |
Образующиеся Продукты |
4. Полимеризация |
а) димеризация |
Димер |
б) тримеризация |
Триммер |
|
в) полимеризация |
Полимер |
|
* – в случае несимметричного алкина реакция идет по правилу Марковникова.

 С
– Х
С
– Х
 Геометрическая
Геометрическая
 Оптическая
Оптическая О
О О
О
 При
разрыве двойной связи в молекулах
несимметричных алкенов водород
присоединяется к более гидрированному
атому углерода (с наибольшим числом
атомов водорода)
При
разрыве двойной связи в молекулах
несимметричных алкенов водород
присоединяется к более гидрированному
атому углерода (с наибольшим числом
атомов водорода)