
Билет 36.
Кремний – второй элемент по распространению на земле. Он составляет 27 % части земной коры, встречается в виде связанном и в виде силикатов.
Физические свойства.Кристаллическая решётка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твёрдость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен для инфракрасного излучения начиная с длины волны 1,1 мкм. Собственная концентрация носителей заряда — 5,81·1015 м−3 (для температуры 300 K).
Химические свойства
Подобно атомам углерода, для атомов кремния является характерным состояние sp3-гибридизации орбиталей. В связи с гибридизацией чистый кристаллический кремний образует алмазоподобную решётку, в которой кремний четырёхвалентен. В соединениях кремний обычно также проявляет себя как четырёхвалентный элемент со степенью окисления +4 или −4. Встречаются двухвалентные соединения кремния, например, оксид кремния (II) — SiO.
При нормальных условиях кремний химически малоактивен и активно реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. Такая «неактивность» кремния связана с пассивацией поверхности наноразмерным слоем диоксида кремния, немедленно образующегося в присутствии кислорода, воздуха или воды (водяных паров).
При нагревании до температуры свыше 400—500 °C кремний реагирует с кислородом с образованием диоксида SiO2, процесс сопровождается увеличением толщины слоя диоксида на поверхности, скорость процесса окисления лимитируется диффузией атомарного кислорода сквозь плёнку диоксида.
При нагревании до температуры свыше 400—500 °C кремний реагирует с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4 и, возможно, галогенидов более сложного состава.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
![]()
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12.
При температурах свыше 1000 °C можно получить соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiC (карборунд), который характеризуется высокой твёрдостью и низкой химической активностью. Карборунд широко используется как абразивный материал. При этом, что интересно, расплав кремния (1415 °C) может длительное время контактировать с углеродом в виде крупных кусков плотноспечённого мелкозернистого графита изостатического прессования, практически не растворяя и никак не взаимодействуя с последним.
Нижележащие элементы 4-й группы (Ge, Sn, Pb) неограниченно растворимы в кремнии, как и большинство других металлов. При нагревании кремния с металлами могут образовываться силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
Особо следует отметить, что с железом кремний образует эвтектическую смесь, что позволяет спекать (сплавлять) эти материалы для образования ферросилициевой керамики при температурах заметно меньших, чем температуры плавления железа и кремния.
При восстановлении SiO2 кремнием при температурах свыше 1200 °C образуется оксид кремния (II) — SiO. Этот процесс постоянно наблюдается при производстве кристаллов кремния методами Чохральского, направленной кристаллизации, потому что в них используются контейнеры из диоксида кремния, как наименее загрязняющего кремний материала.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены ещё два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Для травления кремния наиболее широко используют смесь плавиковой и азотной кислот. Некоторые специальные травители предусматривают добавку хромового ангидрида и иных веществ. При травлении кислотный травильный раствор быстро разогревается до температуры кипения, при этом скорость травления многократно возрастает.
Si+2HNO3=SiO2+NO+NO2+H2O
SiO2+4HF=SiF4+2H2O
3SiF4+3H2O=2H2SiF6+↓H2SiO3
Для травления кремния могут использоваться водные растворы щёлочей. Травление кремния в щелочных растворах начинается при температуре раствора более 60 °C.
Si+2KOH+H2O=K2SiO3+2H2↑
K2SiO3+2H2O↔H2SiO3+2KOH
Получение «Свободный кремний можно получить прокаливанием с магнием мелкого белого песка, который представляет собой диоксид кремния:
![]()
При этом образуется бурый порошок аморфного кремния»[4].В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в руднотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9 % (основные примеси — углерод, металлы).
Oксид кремния (IV) (диоксид кремния, кремнезём SiO2) — бесцветные кристаллы, tпл 1713—1728 °C, обладают высокой твёрдостью и прочностью.Он встречается как в кристаллическом, так и в аморфном виде. Кристаллический диоксид кремния находится в природе главным образом в виде минерала кварца. Прозрачные, бесцветные кристаллы кварца, имеющие форму шестигранных призм с шестигранными пирамидами на концах, называются горным хрусталем. Горный хрусталь, окрашенный примесями в лиловыйр цвет, называется аметистом.
Химические свойства
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.Химически стоек к действию кислот, но реагирует с газообразным фтороводородом:
![]()
и плавиковой кислотой:
![]()
Эти две реакции широко используют для травления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идет об одном и том же веществе).
Например, может быть получен ортосиликат натрия:
![]()
метасиликат кальция:
![]()
или смешанный силикат кальция и натрия:
![]()
Из силиката Na2CaSi6O14 (Na2O·CaO·6SiO2) изготовляют оконное стекло.
Следует отметить, что большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют жидким стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
Главным структурным элементом как твердого диоксида кремния, так и всех силикатов, выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырёх атомов кислорода О. При этом каждый атом кислорода соединен с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
Кремниевые кислоты — очень слабые, малорастворимые в воде кислоты. Известны соли метакремниевой кислоты Н2SiO3 (SiO2•H2О) — силикаты, ортокремниевой кислоты H4SiO4 (SiO2•2H2O) — ортосиликаты и других кислот с различным числом SiO2•nH2О. Гидраты кремнезема с содержанием более 2Н2О на каждую молекулу SiO2 в индивидуальном состоянии, по-видимому, не существуют, однако известны многие их соли. В воде кремниевые кислоты образуют коллоидные растворы. Соли кремниевых кислот называют силикатами (силикаты широко распространены в природе).
Получение
Метакремниевую кислоту получают действием сильных кислот на соли метакремниевой кислоты:
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl.
При высокой температуре вода выпаривается:
H2SiO3 = SiO2 + H2O
В этой реакции оксид кремния(IV) выделяется в виде силикагеля.
Силикаты (от лат. silex — камень) — соли метакремниевой кислоты H2SiO3, например, Na2SiO3. Также концентрированные растворы силикатов калия или натрия называют жидким или растворимым стеклом. В природе встречается в виде минералов, а также являются основой горных пород, из которых состоит земная кора[1].
Получение
При нагревании SiO2 вытесняет более летучий кислотный оксид из солей:
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Обработка аморфного кремнезёма концентрированным раствором щёлочи:
SiO2 + 2NaOH = Na2SiO 3 + H2O
Физические свойства
Природные силикаты довольно тугоплавки (1000-1300 °С, иногда до 2000 °С и выше). Имеют относительно большую твёрдость: 6-8 баллов по шкале Мооса[1].
Химические свойства
Силикаты взаимодействуют со следующими веществами:
С кислотами, даже с очень слабыми, например с угольной:
Na2SiO3 + H2CO3 = Na2CO3 + H2SiO3↓
С растворимыми солями:
Na2SiO3 + MgCl2 = MgSiO3↓ + 2NaCl
Гидролиз:
Na2SiO3 + H2O ↔ NaHSiO3 + NaOH
Билет 37. Положение металлов в ПСХЭ Если в таблице химических элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп), а справа вверху – элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером, иногда их называют полуметаллами. Из 111 открытых элементов, представленных в Периодической системе элементов Д. И. Менделеева, 76 являются металлами; Si, Ge, As, Se, Te — промежуточными между металлами и неметаллами. К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго). Все элементы, расположенные левее мысленной линии, проведенной от бора до астата (от № 5 до № 85) относятся к металлам, а правее — в основном, к неметаллам. Эта граница недостаточно четко выражена, так как среди элементов, расположенных вблизи границы, находятся и полуметаллы.
Металлическая связь
Об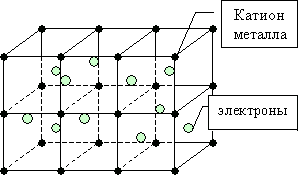 щие
свойства металлов обусловлены типом
химической
щие
свойства металлов обусловлены типом
химической
связи
в металлах, которая называется
металлической связью. Металлическая
связь - химическая связь, обусловленная
наличием большого количества не связанных
с ядрами подвижных электронов. Атомы
металлов отличаются от атомов других
элементов тем, что сравнительно слабо
удерживают свои внешние электроны.
Поэтому в кристаллической решетке
металла эти электроны покидают свои
атомы, превращая их в положительно
заряженные ионы:
![]() Атомы
металлов, если их сравнивать с атомами
других элементов, обладают наибольшей
силой связи. Вследствие этого они
сближены так, что их внешние оболочки
перекрывают друг друга. Это облегчает
отрыв валентных электронов и превращение
в узлах кристаллической решетки
нейтральных атомов в положительно
заряженные ионы. Оторвавшиеся электроны
мчатся с непостижимой скоростью (20 000
км/сек), бомбят ионы, превращая их на миг
в атомы и снова ускользая. Единая система
электронов в металлических веществах
называется электронным газом. Металл
можно представить в виде остова из
положительных ионов, погруженного в
электронный газ, который компенсирует
силы взаимного отталкивания положительных
ионов.
В свою очередь, электронный
газ может свободно двигаться через
решетку, состоящую из ионов металла. В
кристаллах металлов атомы ионизированы
не полностью, и часть валентных электронов
остается связанной. В результате возможно
появление частично ковалентных связей
между соседними атомами. Вклады ионной
и ковалентной составляющей обнаружены
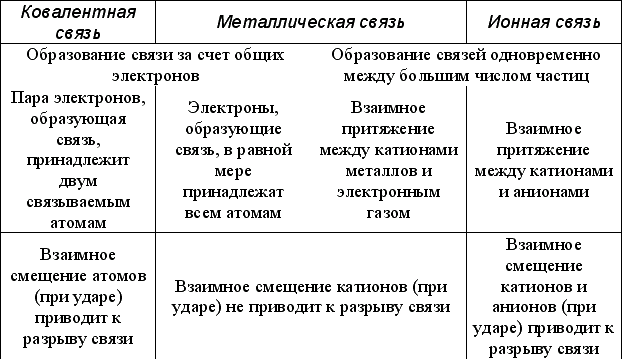
во многих металлах. Металлическая связь
имеет признаки, характерные как для
ковалентной, так и для ионной связи.
Такая связь существует не только в
твердых кристаллах металлов, но и в
расплавах и в аморфном состоянии.
Атомы
металлов, если их сравнивать с атомами
других элементов, обладают наибольшей
силой связи. Вследствие этого они
сближены так, что их внешние оболочки
перекрывают друг друга. Это облегчает
отрыв валентных электронов и превращение
в узлах кристаллической решетки
нейтральных атомов в положительно
заряженные ионы. Оторвавшиеся электроны
мчатся с непостижимой скоростью (20 000
км/сек), бомбят ионы, превращая их на миг
в атомы и снова ускользая. Единая система
электронов в металлических веществах
называется электронным газом. Металл
можно представить в виде остова из
положительных ионов, погруженного в
электронный газ, который компенсирует
силы взаимного отталкивания положительных
ионов.
В свою очередь, электронный
газ может свободно двигаться через
решетку, состоящую из ионов металла. В
кристаллах металлов атомы ионизированы
не полностью, и часть валентных электронов
остается связанной. В результате возможно
появление частично ковалентных связей
между соседними атомами. Вклады ионной
и ковалентной составляющей обнаружены
во многих металлах. Металлическая связь
имеет признаки, характерные как для
ковалентной, так и для ионной связи.
Такая связь существует не только в
твердых кристаллах металлов, но и в
расплавах и в аморфном состоянии.
 Важнейшим
признаком металлов считают высокую
электропроводность, которая уменьшается
с ростом температуры. Электроны в металле
беспорядочно движутся, переходя от
одного атома к другому. А положительно
заряженные ионы лишь слегка колеблются
около своего положения в кристаллической
решетке. Благодаря наличию свободных,
не связанных с определенными атомами
электронов, металлы хорошо проводят
электрический ток и тепло. При нагревании
металла колебания катионов усиливаются.
Электронам труднее продвигаться между
ними, поэтому электрическое сопротивление
металла увеличивается.
Наличие
свободных электронов обусловливают
высокую теплопроводность металлов и
характерный металлический блеск. Их
высокая пластичность и ковкость связаны
с возможностью взаимного смещения
катионов в металлической кристаллической
решетке без разрыва химической связи.
Общие
физические свойства металлов
1)
Пластичность — это способность
металлов изменять форму при ударе,
прокатываться в тонкие листы и вытягиваться
в проволоку. При этом происходит смещение
атомов и ионов кристаллической решетки,
однако связи между ними не разрываются,
так как соответственно перемещаются и
электроны, образующие связь.
Пластичность металлов уменьшается в
ряду Au, Ag, Cu, Sn, Pb, Zn. Fe. Золото,
например, можно прокатывать в листы
толщиной до 0,003 мм, которые используют
для золочения.
2) ^
Блеск, обычно серый цвет и
непрозрачность. Это свойство связано
со взаимодействием свободных электронов
с падающими на металл квантами
света.
3) Электропроводность.
Объясняется направленным движением
свободных электронов от отрицательного
полюса к положительному под влиянием
небольшой разности потенциалов. С
повышением температуры колебания ионов
и атомов металлов усиливаются, что
затрудняет движение электронов и
тем самым приводит к уменьшению
электропроводности. При низких же
температурах колебательное движение
ионов и атомов, наоборот, сильно
уменьшается, и электропроводность
возрастает. Вблизи абсолютного нуля
электрическое сопротивление у
металлов практически отсутствует.
Лучший проводник электричества - серебро,
за ним идут медь, золото, алюминий,
железо. По сравнению с веществами, не
имеющими свободных электронов,
проводимость металлов больше в 1025
раз.
4) Теплопроводность.
Закономерность та же. Обусловлена
высокой подвижностью свободных электронов
и колебательным движением атомов,
благодаря чему происходит быстрое
выравнивание температуры по массе
металла. Наибольшая теплопроводность
- у висмута и ртути. У неметаллов, в
которых тепло распространяется лишь
колебанием ионов и атомов кристаллической
решетки, теплопроводность в тысячу раз
ниже.
5) Твердость.
Самый твердый – хром (режет стекло);
самые мягкие – щелочные металлы –
калий, натрий, рубидий и цезий – режутся
ножом.
6) Плотность.
Она тем меньше, чем меньше атомная масса
металла и чем больше радиус его атома
(самый легкий - литий (r=0,53 г/см3);
самый тяжелый – осмий (r=22,6 г/см3).
Металлы, имеющие r < 5 г/см3 считаются
"легкими металлами".
7)
^ Температуры плавления и
кипения. Температуры плавления
металлов различаются очень сильно:
цезий и галлий можно расплавить теплом
ладоней, а температура плавления
вольфрама +3410° С. При обычных условиях
единственный жидкий металл - ртуть.
Металлы с t°пл. выше 1000°C считаются
тугоплавкими, ниже – низкоплавкими.
Среди металлов наиболее устойчивой,
кубической структуры самые выносливые
те, у кого энергично работают электроны
с d-подуровня . Чемпион по тугоплавкости
- вольфрам не жаростоек. Уже при 700 °С
вольфрам начинает "потеть",
покрывающая изделия прочная пленка его
окисла улетучивается. Поэтому он чемпион
лишь в условиях вакуума или в атмосфере
инертных газов, а во всех более трудных
условиях незаменимы платиноиды.
Прочность,
температура плавления и твердость
зависят от прочности металлической
связи. Она особенно велика у тяжелых
металлов. В парообразном состоянии все
металлы одноатомны, их кристаллическая
решетка разрушается.
Металлические
материалы обычно делятся на две большие
группы: железо и сплавы железа (сталь и
чугун) называют черными металлами, а
остальные металлы и их сплавы — цветными.
Кроме того, все цветные металлы,
применяемые в технике, в свою очередь,
делятся на следующие группы:
Важнейшим
признаком металлов считают высокую
электропроводность, которая уменьшается
с ростом температуры. Электроны в металле
беспорядочно движутся, переходя от
одного атома к другому. А положительно
заряженные ионы лишь слегка колеблются
около своего положения в кристаллической
решетке. Благодаря наличию свободных,
не связанных с определенными атомами
электронов, металлы хорошо проводят
электрический ток и тепло. При нагревании
металла колебания катионов усиливаются.
Электронам труднее продвигаться между
ними, поэтому электрическое сопротивление
металла увеличивается.
Наличие
свободных электронов обусловливают
высокую теплопроводность металлов и
характерный металлический блеск. Их
высокая пластичность и ковкость связаны
с возможностью взаимного смещения
катионов в металлической кристаллической
решетке без разрыва химической связи.
Общие
физические свойства металлов
1)
Пластичность — это способность
металлов изменять форму при ударе,
прокатываться в тонкие листы и вытягиваться
в проволоку. При этом происходит смещение
атомов и ионов кристаллической решетки,
однако связи между ними не разрываются,
так как соответственно перемещаются и
электроны, образующие связь.
Пластичность металлов уменьшается в
ряду Au, Ag, Cu, Sn, Pb, Zn. Fe. Золото,
например, можно прокатывать в листы
толщиной до 0,003 мм, которые используют
для золочения.
2) ^
Блеск, обычно серый цвет и
непрозрачность. Это свойство связано
со взаимодействием свободных электронов
с падающими на металл квантами
света.
3) Электропроводность.
Объясняется направленным движением
свободных электронов от отрицательного
полюса к положительному под влиянием
небольшой разности потенциалов. С
повышением температуры колебания ионов
и атомов металлов усиливаются, что
затрудняет движение электронов и
тем самым приводит к уменьшению
электропроводности. При низких же
температурах колебательное движение
ионов и атомов, наоборот, сильно
уменьшается, и электропроводность
возрастает. Вблизи абсолютного нуля
электрическое сопротивление у
металлов практически отсутствует.
Лучший проводник электричества - серебро,
за ним идут медь, золото, алюминий,
железо. По сравнению с веществами, не
имеющими свободных электронов,
проводимость металлов больше в 1025
раз.
4) Теплопроводность.
Закономерность та же. Обусловлена
высокой подвижностью свободных электронов
и колебательным движением атомов,
благодаря чему происходит быстрое
выравнивание температуры по массе
металла. Наибольшая теплопроводность
- у висмута и ртути. У неметаллов, в
которых тепло распространяется лишь
колебанием ионов и атомов кристаллической
решетки, теплопроводность в тысячу раз
ниже.
5) Твердость.
Самый твердый – хром (режет стекло);
самые мягкие – щелочные металлы –
калий, натрий, рубидий и цезий – режутся
ножом.
6) Плотность.
Она тем меньше, чем меньше атомная масса
металла и чем больше радиус его атома
(самый легкий - литий (r=0,53 г/см3);
самый тяжелый – осмий (r=22,6 г/см3).
Металлы, имеющие r < 5 г/см3 считаются
"легкими металлами".
7)
^ Температуры плавления и
кипения. Температуры плавления
металлов различаются очень сильно:
цезий и галлий можно расплавить теплом
ладоней, а температура плавления
вольфрама +3410° С. При обычных условиях
единственный жидкий металл - ртуть.
Металлы с t°пл. выше 1000°C считаются
тугоплавкими, ниже – низкоплавкими.
Среди металлов наиболее устойчивой,
кубической структуры самые выносливые
те, у кого энергично работают электроны
с d-подуровня . Чемпион по тугоплавкости
- вольфрам не жаростоек. Уже при 700 °С
вольфрам начинает "потеть",
покрывающая изделия прочная пленка его
окисла улетучивается. Поэтому он чемпион
лишь в условиях вакуума или в атмосфере
инертных газов, а во всех более трудных
условиях незаменимы платиноиды.
Прочность,
температура плавления и твердость
зависят от прочности металлической
связи. Она особенно велика у тяжелых
металлов. В парообразном состоянии все
металлы одноатомны, их кристаллическая
решетка разрушается.
Металлические
материалы обычно делятся на две большие
группы: железо и сплавы железа (сталь и
чугун) называют черными металлами, а
остальные металлы и их сплавы — цветными.
Кроме того, все цветные металлы,
применяемые в технике, в свою очередь,
делятся на следующие группы:
Общие
химические свойства металлов
В
кристаллах металлов и в их расплавах
атомные остовы связывает единое
электронное облако металлической связи.
Как и отдельный атом элемента, образующего
металл, кристалл металла обладает
способностью отдавать электроны.
Склонность металла отдавать электроны
зависит от его строения и, прежде всего,
от размера атомов: чем больше ионные
радиусы, тем легче металл отдает
электроны.
Металлы –
простые вещества, поэтому степень
окисления атомов в них равна 0. Вступая
в реакции, металлы почти всегда изменяют
степень окисления своих атомов. Атомы
металлов, не обладая склонностью
принимать электроны, могут только их
отдавать или обобществлять.
Электроотрицательность этих атомов
невелика, поэтому даже при образовании
ими ковалентных связей атомы металлов
приобретают положительную степень
окисления. Следовательно, все металлы
в той или иной степени проявляют
восстановительные свойства. Они
реагируют:
1) ^ С неметаллами
(но не все и не со всеми):
4Li + O2
= 2Li2O
3Mg
+ N2 = Mg3N2
(при нагревании),
Fe + S = FeS (при
нагревании).
Наиболее активные металлы
легко реагируют с галогенами и кислородом,
а с очень прочными молекулами азота
реагирует только литий и магний. Реагируя
с кислородом, большинство металлов
образует оксиды, а наиболее активные –
пероксиды (Na2O2, BaO2) и
другие более сложные соединения.
2)
^ С оксидами менее активных
металлов:
2Ca + MnO2
= 2CaO + Mn (при нагревании),
2Al +
Fe2O3
= Al2O3
+ 2Fe (с предварительным
нагреванием).
Возможность протекания
этих реакций определяется общим правилом
(ОВР протекают в направлении образования
более слабых окислителя и восстановителя)
и зависит не только от активности металла
(более активный, то есть легче отдающий
свои электроны металл восстанавливает
менее активный), но и от энергии
кристаллической решетки оксида (реакция
протекает в направлении образования
более " прочного" оксида).
3) ^
С растворами кислот:
Mg +
2H3O+
= Mg2+ + H2
+ 2H2O Fe + 2H3O+
= Fe2+ + H2
+ 2H2O
Mg + H2SO4p
= MgSO4p + H2
Fe + 2HClp
= FeCl2p + H2
В
этом случае возможность реакции
определяется по ряду напряжений (реакция
протекает, если металл в ряду напряжений
стоит левее водорода).
4) ^ C
растворами солей:
Fe + Cu2+
= Fe2++ Cu Cu + 2Ag+
= Cu2+ +2Ag
Fe
+ CuSO4p = Cu + FeSO4p
Cu + 2AgNO3p = 2Ag +
Cu(NO3)2p.
Для
определения возможности протекания
реакции здесь также используется ряд
напряжений металлов.
5) ^ Наиболее
активные металлы реагируют с водой:
2Na
+ 2H2O = 2Na![]() + H2 + 2OH -
Ca + 2H2O = Ca2+
+ H2 + 2OH-
2Na
+ 2H2O = 2NaOHp
+ H2 Ca + 2H2O
= Ca(OH)2p + H2
+ H2 + 2OH -
Ca + 2H2O = Ca2+
+ H2 + 2OH-
2Na
+ 2H2O = 2NaOHp
+ H2 Ca + 2H2O
= Ca(OH)2p + H2![]()
Металлы средней активности окисляются водой при нагревании до оксида: Zn0 + H2O = Zn+2O + H02 Неактивные (Au, Ag, Pt) – с водой не реагируют. 6) С водородом (реагируют только щелочные и щелочноземельные металлы): 2Li0 + H2 → 2Li+1H Ca0 + H2 →Ca+2H2 7) Металлы могут образовывать химические соединения между собой. Такие соединения обычно образуют типичные металлы с металлами, обладающими слабыми металлическими свойствами, например определенные соединения натрия со свинцом: Nа5РЬ2, NaРЬ, Na2РЬ, Na4РЬ. Соединения одних металлов с другими носят общее название интерметаллидов, интерметаллических соединений или металлоидов. Рассмотренные свойства металлов, связанные с отдачей электронов в химических реакциях, называют металлическими. В различной степени ими обладают все химические элементы. О металлических свойствах судят, сопоставляя электроотрицательности элементов. Эта величина, выраженная в условных единицах, характеризует способность атома в молекуле притягивать электроны. Относительные значения электроотрицательностей элементов. Чем меньше электроотрицательность, тем сильнее выражены металлические свойства элементов.
Билет 39.
Алюми́ний — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Физические свойства
- Металл серебристо-белого цвета, лёгкий
- плотность — 2,7 г/см³
- температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C
- удельная теплота плавления — 390 кДж/кг
- температура кипения — 2500 °C
- удельная теплота испарения — 10,53 МДж/кг
- временное сопротивление литого алюминия — 10-12 кг/мм², деформируемого — 18-25 кг/мм², сплавов — 38-42 кг/мм²
- Твёрдость по Бринеллю — 24…32 кгс/мм²
высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу
- Модуль Юнга — 70 ГПа
- Алюминий обладает высокой электропроводностью (37·106 См/м) и теплопроводностью (203,5 Вт/(м·К)), 65 % от электропроводности меди, обладает высокой светоотражательной способностью.
- Слабый парамагнетик.
- Температурный коэффициент линейного расширения 24,58·10−6 К−1 (20…200 °C).
- Температурный коэффициент электрического сопротивления 2,7·10−8K−1. Алюминий переходит в сверхпроводящее состояние при температуре 1,2 кельвина.
- Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин)
Химические свойства
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель.
Легко реагирует с простыми веществами:
с кислородом, образуя оксид алюминия:
4Al + 3O2 = 2Al2O3
с галогенами (кроме фтора)[7], образуя хлорид, бромид или иодид алюминия:
2Al + 3Hal2 = 2AlHal3 (Hal = Cl, Br, I)
с другими неметаллами реагирует при нагревании:
со фтором, образуя фторид алюминия:
2Al + 3F2 = 2AlF3
с серой, образуя сульфид алюминия:
2Al + 3S = Al2S3
с азотом, образуя нитрид алюминия:
2Al + N2 = 2AlN
с углеродом, образуя карбид алюминия:
4Al + 3С = Al4С3
Сульфид и карбид алюминия полностью гидролизуются:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
Со сложными веществами:
с водой (после удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи):
2Al + 6H2O = 2Al(OH)3 + 3H2
со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
6NaOH + 2Al = 2Na3AlO3 + 3H2
Легко растворяется в соляной и разбавленной серной кислотах:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
8Al + 15H2SO4(конц) = 4Al2(SO4)3 + 3H2S + 12H2O
Al + 6HNO3(конц) = Al(NO3)3 + 3NO2 + 3H2O
восстанавливает металлы из их оксидов (алюминотермия):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
Амфотерность (двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании ими двух типов солей. Например, для гидроксида и оксида алюминия: а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O Al2О3 + 3H2SO4 = Al2(SO4)3 + 3H2O
б) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O (в расплаве) Al2О3 + 2NaOH(т) = 2NaAlO2 + H2O (в расплаве)
В реакциях (а) Al(OH)3 и Al2О3 проявляют свойства оснóвных гидроксидов и оксидов, то есть они подобно щелочам реагируют с кислотами и кислотными оксидами, образуя соль, в которой алюминий является катионом Al3+.
Напротив, в реакциях (б) Al(OH)3 и Al2О3 выполняют функцию кислотных гидроксидов и оксидов, образуя соль, в которой атом алюминия Al входит в состав аниона (кислотного остатка) AlО2−.
Сам элемент алюминий проявляет в этих соединениях свойства металла и неметалла. Следовательно, алюминий - амфотерный элемент.
Основные области применения алюминия и его сплавов
Алюминий используется в производстве зеркал оптических телескопов, в электротехнике, для производства сплавов (дюралюмин, силумин) в самолёто- и автомобилестроении, для алитирования чугунных и стальных изделий с целью повышения их коррозионной стойкости, для термической сварки, для получения редких металлов в свободном виде, в строительной промышленности, для изготовления контейнеров, фольги и т.п.
ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ
Алюминий имеет наиболее разносторонние применения из всех металлов. Он широко используется в транспортном машиностроении, например для конструирования самолетов, судов и автомобилей. В химической промышленности алюминий используется в качестве восстановителя, в строительной промышленности для изготовления оконных рам и дверей, а в пищевой промышленности для изготовления упаковочных материалов. В быту он используется в качестве материала для кухонной посуды и в виде фольги для хранения пищевых продуктов.
Разнообразные применения и широкое использование алюминия обусловлены целым рядом его физических и химических свойств, которыми он выгодно отличается от других материалов, а именно:
1. Алюминий-легкий, но прочный материал. Отношение прочности к массе у алюминиевых сплавов выше, чем у любых других технических сплавов.
2. Алюминий хорошо поддается механической обработке. Он имеет высокую ковкость и тягучесть; его можно прокатывать, вытягивать в проволоку, прессовать или штамповать, придавая изделиям любую форму.
3. Алюминий устойчив к коррозии. При взаимодействии с воздухом на поверхности алюминия и его сплавов образуется тонкий слой оксида алюминия. Этот бесцветный слой имеет большую прочность и плотно прилегает к поверхности, не отслаиваясь от неё. Он герметично изолирует металл от соприкосновения с кислородом воздуха и препятствует дальнейшему окислению металла.
4. Алюминий прекрасный проводник электрического тока и обладает высокой теплопроводностью. Из-за высокой теплопроводности его используют для изготовления теплообменников в химической, нефтяной и других отраслях промышленности.
5. Поверхность алюминия обладает высокой отражательной способностью. Способность хорошо отражать лучистую энергию позволяет использовать алюминий для изготовления кровельных покрытий, эффективно изолирующих здания в жарких странах от перегревания. Алюминиевая фольга благодаря этим же свойствам используется для создания помех при радиолокации.
6. Алюминий-немагнитный материал, и это позволяет использовать его для изготовления навигационного оборудования.
7. Наличие у алюминия хороших восстановительных свойств позволяет использовать его в качестве восстановителя в химической и сталелитейной промышленности.
8. Отсутствие у алюминия токсичных свойств позволяет использовать его для изготовления оборудования пищевой и пивоваренной промышленности, а также материалов для упаковки пищевых продуктов.
Сплавы. Алюминий легко образует сплавы с другими металлами. Такие сплавы обычно содержат медь, магний, никель и цинк. Медь, никель и цинк повышают прочность металла и его твердость, а магний повышает его коррозионную устойчивость. Для улучшения литьевых свойств алюминиевых сплавов в них иногда добавляют кремний, который повышает текучесть жидкого металла.
Билет 40.
Ка́льций — элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20. Обозначается символом Ca (лат. Calcium). Простое вещество кальций (CAS-номер: 7440-70-2) — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета.
Окси́д ка́льция (окись кальция, негашёная и́звесть или «кипелка», «кираби́т») — белое кристаллическое вещество, формула CaO.
Получение
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
![]()
Также оксид кальция можно получить при взаимодействии простых веществ:
![]()
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
![]()
Гидрокси́д ка́льция (Ca(OH)2, гашеная известь или «пушонка») — химическое вещество, сильное основание. Представляет собой порошок белого цвета, плохо растворимый в воде.
Гашеная известь — так как её получают путём «гашения» (то есть взаимодействия с водой) «негашёной» извести (оксида кальция).
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет щелочную реакцию. Растворимость падает с ростом температуры.
Как и все основания, реагирует с кислотами с образованием соответствующих солей кальция:
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O,
по этой же причине раствор гидроксида кальция мутнеет на воздухе, так как гидроксид кальция, как и другие сильные основания, реагирует с растворённым в воде углекислым газом:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Если продолжить барботацию углекислого газа, выпавший осадок растворится, так как образуется кислая соль — гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2,
причём при нагревании раствора гидрокарбонат снова разрушается и выпадает осадок карбоната кальция:
Ca(HCO3)2(t°) → CaCO3↓ + CO2↑ + H2O
Гидроксид кальция реагирует с угарным газом при температуре около 400 °C:
Ca(OH)2 + CO (t°) → CaCO3 + H2↑
Как сильное основание реагирует с солями, но только если в результате реакции выпадает осадок:
Ca(OH)2 + Na2SO3→CaSO3↓ + 2NaOH
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости».Для улучшения качества воды перед ее применением необходимо устранить жесткость воды, т.е. перевести растворимые соли Ca 2+ и Mg 2+ в нерастворимые.
Устранение временной жесткости:
1. кипячение (t)
2. известкование (+ Са(ОН)2)
3. добавление соды (Na2CO3) или поташа (К2СО3 – содержится в золе)
Устранение постоянной жесткости:
1. добавление соды или поташа.
2.использование катионитов.
Na2R + Ca 2+ = 2Na + + CaR ↓
Физиологическая роль кальция.
Кальций в больших количествах содержится во многих пищевых продуктах и ежедневно поступает в организм с пищей. Значительное количество кальция содержится в молочных продуктах (сливки, молоко, сыр, творог). В меньших концентрациях кальций присутствует в огородной зелени (петрушка, шпинат), овощах (бобы, фасоль), орехах, рыбе. Суточная потребность организма в кальции (800-1500 мг) обычно покрывается за счет поступления пищи. Биоусвояемость кальция составляет 25-40%.
Всасывание кальция происходит в тонком кишечнике, главным образом в двенадцатиперстной кишке. Здесь желчные кислоты образуют с солями кальция комплексные соединения, которые затем проходят через стенку ворсинок.
Кальций является важной составляющей частью организма; его общее содержание около 1,4% (1000 г на 70 кг массы тела). В организме кальций распределен неравномерно: около 99% его количества приходится на костную ткань и лишь 1% содержится в других органах и тканях. Кальций обеспечивает опорную функцию костей. В то же время, костная ткань выполняет функцию «депо» кальция в организме. Выводится кальций из организма через кишечник и почки.
Кальций в составе 3Сa3(PO4)4 · Ca(OH)4 - основе костной ткани, обеспечивает прочность ногтей и зубов. Катионы Са2+, входящие в состав плазмы крови и тканевых жидкостей, участвуют в поддержании гомеостаза (ионное равновесие, осмотическое давление в жидкостях организма), в регуляции сердечных сокращений и свертываемости крови.
Кальций очень активен: доминирующее положение этого элемента в конкуренции с другими металлами и соединениями за активные участки белков, определяется химическими особенностями иона кальция – наличием двух валентностей и сравнительно небольшим атомным радиусом. Поэтому кальций может успешно конкурировать с радионуклидами и тяжелыми металлами на всех этапах метаболизма.
Метаболизм кальция находится под влиянием околощитовидных желез, кальцитонина (гормон щитовидной железы) и кальциферолов (витамин D).
Кальций обладает высокой биологической активностью, выполняет в организме многообразные функции, среди которых:
-регуляция внутриклеточных процессов;
-регуляция проницаемости клеточных мембран;
-регуляция процессов нервной проводимости и мышечных сокращений;
-поддержание стабильной сердечной деятельности;
-формирование костной ткани, минерализация зубов;
-участие в процессах свертывания крови.
-Токсическая доза для человека: нетоксичен.
Билет 41.
Щелочны́е мета́ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы)[1]: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr, и унуненний Uue. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
