
- •Химическая экология и экологическая химия
- •2. Загрязнение окружающей среды
- •3. Химические загрязняющие вещества, их источники и распространение в биосфере
- •Классификация веществ по характеру взаимодействия на живые организмы
- •Экологическое нормирование.
- •Основные понятия: пдк и индекс загрязнения.
- •3. Вида экологического стандарта пдк санитарной оценки разных сред
- •1. Химические элементы биосферы
- •1. Состав, изменение температуры атмосферы
- •2. Химические процессы в атмосфере
- •3. Проблема стратосферного озона
- •4.Воздух, которым мы дышим
- •1. Состав гидросферы
- •2. Свойства природных вод и их качество
- •3. Химические процессы в гидросфере
- •4. Вода в нашей жизни
- •1.Состав литосферы.
- •2. Химические процессы в литосфере
- •3. Почва: особенности состава и происходящих в ней процессов
- •4. Почва, удобрения, пестициды и наше здоровье
- •2. Состав биосферы
- •3. Процессы в биосфере
- •4. Внешняя, внутренняя и духовная среда человека
- •1. Сущность ноосферной концепции
- •2. О гармонизации сознания человека и общества
1. Химические элементы биосферы
Как известно, любое вещество состоит из химических элементов, которые по своему распространению и роли в биосфере в значительной степени отличаются один от другого.
Химический состав Земли, законы распространения и распределения химических элементов, пути их миграции и превращения в условиях Земли изучает наука геохимия. В создание и развитие геохимии как науки большой вклад внесли американский исследователь Ф. У. Кларк (1847—1931) и русские ученые В. И.Вернадский (1863-1945) и А. Е.Ферсман (1883—1945). Раздел геохимии, изучающий химические процессы в земной коре с участием живых организмов, называют биогеохимией. Часть земной оболочки, занятую растительными и животными организмами, называют биосферой. Ее верхняя граница (тропосфера) находится на высоте 12—15 км, а нижняя (литосфера) — на глубине до 5 км. Биосфера включает в себя нижнюю часть атмосферы (тропосферу), всю гидросферу и верхнюю часть литосферы. Около 90 элементов существует в природе, остальные получены искусственно, с помощью ядерных реакций. Распространенность химических элементов в природе различна, их среднее содержание оценивается кларками. В 1889 г. Ф. У. Кларк рассчитал и составил таблицу среднего содержания в земной коре 50 наиболее распространенных элементов. Академик А. Е. Ферсман предложил частоту встречаемости элементов в природе называть «кларком». Позднее, в 1925—1930 гг., академик В. И. Вернадский уточнил значения для многих элементов.
Сравнительно небольшое число элементов составляет земную кору. Около 50% массы земной коры приходится на кислород, более 25% — на кремний. Основную массу земной коры (99,8%) составляют 18 элементов — кислород, кремний, алюминий, железо, кальций, натрий, калий, магний, водород, титан, углерод, хлор, фосфор, сера, азот, марганец, фтор, барий. На долю всех остальных элементов приходится лишь 0,2%. Организм человека содержит около 70 элементов.
Согласно учению В. И. Вернадского активное участие в перераспределении химических элементов в земной коре принимают живые организмы (живое вещество). Минералы, природные химические вещества образуются в биосфере в различных количествах благодаря деятельности живых организмов.
Примером геохимической роли живого вещества является кальциевая функция, характерная для всех организмов, имеющих кальций-фосфатный (карбонатный) скелет. Концентрируя кальций в своих телах, живые организмы энергично извлекают его из окружающей среды. Другой пример геохимической роли живого вещества — образование железных руд в результате деятельности микроорганизмов.
Предположение В. И. Вернадского о сходстве химического состава земной коры и живых организмов получает подтверждение. Исследования химического состава земной коры, почвы, морской воды, растений, животных и человека показали, что в живых организмах, в том числе и у человека, можно обнаружить почти все те же элементы, которые есть в земной коре и морской воде (табл. 1).
Таблица 1.
Содержание химических элементов (масс.%) в земной коре, почвах, морской воде, растениях, животных (по А. П. Виноградову)
Элемент |
Земная кора |
Почвы |
Морская вода |
Растения |
Животные |
О |
49,4 |
49,0 |
85,82 |
70,0 |
62,4 |
Si |
27,6 |
33,0 |
5 · 10-5 |
0,15 |
1· 10-5 |
А1 |
7,45 |
7,12 |
1· 10-6 |
0,02 |
1· 10-5 |
Fe |
5,0 |
3,8 |
5· 10-6 |
0,02 |
0,01 |
С |
0,15 |
2,0 |
0,002 |
18 |
21 |
Са |
3,5 |
1,37 |
0,04 |
0,3 |
1,9 |
К |
2,5 |
1,36 |
0,038 |
0,3 |
0,27 |
Na |
2,6 |
0,63 |
1,06 |
0,02 |
0,1 |
Mg |
2,0 |
0,6 |
0,14 |
0,07 |
0,03 |
Ti |
0,6 |
0,46 |
1· 10-7 |
1· 10-7 |
1· 10-6—1· 10-5 |
N |
0,02 |
0,1 |
1· 10-5 |
0,3 |
3,1 |
Н |
1,0 |
— |
10,72 |
10 |
9,7 |
Р |
0,08 |
0,08 |
5· 10-6 |
0,07 |
0,95 |
S |
0,05 |
0,05 |
0,09 |
0,05 |
0,16 |
Мn |
0,09 |
0,085 |
4· 10-7 |
1· 10-3 |
1· 10-5 |
Zr |
0,04 |
0,62 |
— |
5· 10-4 |
— |
Sr |
0,04 |
0,03 |
1· 10-3 |
1· 10-4 |
1· 10-3 |
Ва |
0,04 |
0,04 |
5· 10-6 |
1· 10-4 |
1· 10-5 |
Се |
0,02 |
0,02 |
1· 10-7 |
— |
1· 10-6 |
Сг |
0,02 |
0,019 |
— |
5· 10-4 |
1· 10-5 |
F |
0,027 |
0,02 |
1· 10-4 |
1· 10-5 |
1· 10-5—1· 10-4 |
V |
0,03 |
0,01 |
5· 10-8 |
1· 10-4 |
1· 10-5 |
Сl |
0,048 |
0,01 |
1,89 |
1· 10-2 |
0,08 |
Rb |
0,03 |
5· 10-3 |
2· 10-5 |
5· 10-4 |
1· 10-5 |
Zn |
5· 10-3 |
5· 10-3 |
5· 10-6 |
3· 10-4 |
1· 10-3 |
Ni |
1· 10-3 |
5· 10-3 |
3· 10-7 |
5· 10-5 |
1· 10-6 |
Сu |
1· 10-2 |
2· 10-3 |
2· 10-6 |
2· 10-4 |
1· 10-4 |
Со |
4· 10-3 |
1· 10-3 |
1· 10-7 |
2· 10-5 |
1· 10-6 – 1 · 10-5 |
Li |
6,5· 10-3 |
3 · 10-3 |
1,5· 10-5 |
1· 10-5 |
1· 10-4 |
Pb |
1,5· 10-4 |
5· 10-4 |
5· 10-7 |
1· 10-5 |
1· 10-6 |
В |
3· 10-4 |
5· 10-4 |
5· 10-4 |
1· 10-4 |
1· 10-5 |
I |
3· 10-5 |
5· 10-4 |
1· 10-6 |
1· 10-5 |
1· 10-5 – 1 · 10-4 |
Mo |
1,5· 10-2 |
3 · 10-4 |
1· 10-7 |
2· 10-5 |
1 · 10-6 – 1 · 10-5 |
As |
5· 10-4 |
4· 10-4 |
1,5· 10-6 |
3 · 10-5 |
1· 10-6—1· 10-5 |
Br |
1,5· 10-4 |
2· 10-4 |
7· 10-3 |
— |
1· 10-4 |
Cd |
5· 10-5 |
5· 10-6 |
– |
1· 10-6 |
1· 10-4 |
Th |
1· 10-3 |
6· 10-4 |
4· 10-8 |
6· 10-4 |
1· 10-7 |
W |
— |
1· 10-4 |
— |
— |
— |
U |
2· 10-4 |
1· 10-4 |
2· 10-7 |
— |
1· 10-8 |
Se |
6· 10-5 |
1· 10-6 |
4· 10-7 |
1· 10-7 |
— |
Bi |
1,7· 10-6 |
2· 10-8 |
2· 10-8 |
— |
2· 10-6 |
Hg |
7· 10-6 |
1· 10-6 |
3· 10-9 |
1· 10-7 |
1· 10-6—1· 10-7 |
Ag |
1· 10-5 |
— |
1· 10-9 |
— |
3· 10-5—5· 10-6 |
Аu |
5· 10-7 |
— |
4· 10-10 |
— |
1· 10-7 |
Ra |
2· 10-10 |
8· 10-11 |
1· 10-14 |
1· 10-14 |
1· 10-12 |
Из данных табл. 1. следует, что большую долю веществ живых организмов составляют элементы, которые имеют довольно высокую распространенность в земной коре. Например, содержание кислорода в земной коре составляет 49%, в организме животных и человека — 62%. Это показывает и рис. 1.

Рис. 1.Содержание химических элементов в земной коре
(см. цифры наружного ряда) и в организме человека (приведены данные
только для макроэлементов)
Однако эта закономерность соблюдается не всегда. Так, в земной коре содержится много кремния (27,6%), а в живых организмах, особенно в животных, его мало: в растениях — 0,15%, в животных — 1·10-5% (табл. 1.). Аналогично алюминий в больших количествах содержится в земной коре (7,45%) и в очень незначительных — в живых организмах. В растениях алюминия содержится 0,02%, в животных — 1 • 10-5%.
Непропорциональное содержание элементов в организме и среде связано с тем, что на усвоение элементов влияет растворимость их природных соединений в воде. Природные соединения кремния (SiO2) и алюминия (А12О3) практически нерастворимы в воде, поэтому они и не усваиваются живыми организмами. Обратная картина наблюдается, например, для углерода, который в незначительных количествах содержится в земной коре, а по содержанию в живых организмах занимает второе (после кислорода) место. Увеличенное содержание элемента в организме по сравнению с окружающей средой называется биологическим концентрированием элемента.
Процесс эволюции от неорганических веществ к биоорганическим, основанный на использовании тех или иных химических элементов для создания биосистем, подчинен законам естественного отбора. В итоге этого отбора основу живых систем образуют только шесть элементов — С, Н, О, N, P, S — получивших название органогенов. На долю этих элементов в организме приходится 97,4%. Характерное для органогенов образование водорастворимых соединений и способствует их концентрированию в живых организмах.
В разное время многие ученые пытались классифицировать химические элементы, находящиеся в живых организмах. В соответствии с классификацией, предложенной В. И. Вернадским, элементы, составляющие живые организмы, подразделяются в зависимости от их среднего содержания (масс.%) на макро- и микроэлементы.
Макроэлементы — это элементы, содержание которых в организме выше 10-2%. К ним относятся О (62), С (21), Н (10), N (3) Са (2), Р (1), К (0,23), S (0,16), С1 (0,1), Na (0,08), Mg (0,027). В скобках указана массовая доля элемента (масс.%).
На рис. 1. приведено содержание макроэлементов в организме человека. Обычно к ним относят 11 элементов (они указаны на рисунке), в свою очередь они подразделяются на две группы, из которых одна объединяет основные макроэлементы. Из основных макроэлементов (их шесть) — С, Н, О, N, P, S — построены биомолекулы клетки: белки, нуклеиновые кислоты, липиды, углеводы. Остальные пять макроэлементов — Са, Mg, Na, К, Сl — составляют вторую группу.
Микроэлементы — это элементы, содержание которых в организме находится в пределах от 10-3% и ниже. К ним относятся I, Сu, As, F, Br, Sr, Ba, Со и др. Иногда выделяют ультрамикроэлементы — это элементы, содержание которых в организме ниже 1-10-5%. К ним относятся Hg, Au, U, Th, Ra и др. В настоящее время их объединяют в одну группу с микроэлементами.
Однако данная классификация не отражает биологической роли и физиологического значения того или иного элемента.
Известный биохимик и биогеохимик В. В. Ковальский (1899— 1984), исходя из значимости элементов для жизнедеятельности, разделил их на три группы.
1. Жизненно необходимые (незаменимые) элементы — постоянно содержатся в организме человека, входят в состав ферментов, гормонов и витаминов; это Н, О, Са, N, К, Р, Na, S, Mg, Cl, С, I, Mn, Cu, Co, Fe, Zn, Mo, V. Дефицит этих элементов приводит к нарушению нормальной жизнедеятельности человека.
2. Постоянные примесные элементы — элементы, которые всегда содержатся в организме животных и человека, — Ga, Sb, Sr, Br, F, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se; но их биологическая роль мало изучена или неизвестна.
3. Примесные элементы — это обнаруженные в организме человека и животных Sc, Tl, In, La, Pr, Sm, W, Re, Tb и др. Данные об их количестве отсутствуют, их биологическая роль не выяснена.
Элементы, необходимые для построения и жизнедеятельности различных клеток и организмов, называют биогенными элементами. Точно перечислить все биогенные элементы в настоящее время еще невозможно из-за сложности определения очень низких концентраций микроэлементов и установления их биологических функций. Для 24 элементов биогенность установлена надежно. Это элементы 1-ой и некоторые элементы 2-ой группы по В. В. Ковальскому. Остальные элементы, кроме биогенных, называют второстепенными элементами.
Подводя итог сказанному выше, отметим, что примерно 50 элементов встречаются в природе в существенных количествах, из них примерно поровну составляют биогенные и второстепенные элементы. Биогенные элементы разделяют на макро- и микроэлементы, к макроэлементам относят 11 элементов, а из 14 микроэлементов роль одних для жизни человека доказана (Сu, Мn, Fe, Zn, Mo, F, I, Se), а роль других вероятна (Cr, Ni, V, Sn, As, Si).
Главный критерий, по которому различают макро- и микроэлементы, — это потребность организма в элементе, выражаемая в мг/кг массы или мг/сутки. Ежедневная потребность человека в макроэлементах составляет примерно 100 мг/сут., а необходимое количество микроэлементов не превышает нескольких мг/сут.
Есть и другие различия между макро- и микроэлементами. Первые (преимущественно С, Н, О, N, S, Р) представлены в организме в основном органическими веществами, вторые входят в состав неорганических или комплексных соединений. Отклонения в содержании макроэлементов не вызывают серьезных нарушений в жизнедеятельности организма, в то время как даже незначительные изменения в количестве микроэлементов приводят к заболеваниям.
Необходимо знать, что невозможно провести четкого разделения биогенных элементов на макро- и микроэлементы и что, по данным разных источников, оно не всегда совпадает для разных групп организмов (человека, животных и растений). В растениях к макроэлементам относят такие, которых содержится довольно много (от нескольких процентов до сотых долей процента сухого вещества). Содержание микроэлементов в растениях составляет тысячные и стотысячные доли процента (В, Мn, Mo, Cu, Zn, Со, V и др.). Например, если натрий не столь существен для растений, как для животных, то бор, напротив, имеет большое значение в жизнедеятельности растений, так как он необходим для азотистого обмена. При недостатке бора в почве клубеньковые бактерии перестают фиксировать азот и питаются за счет растений.
Органы человека по-разному концентрируют в себе различные химические элементы, т. е. распределение химических элементов между разными органами и тканями человека оказывается неравномерным. Данные по распределению (топографии) некоторых макро- и микроэлементов в организме человека представлены на рис. 2.
Десять металлов, жизненно необходимых для живого организма, получили название металлы жизни — это Са, К, Na, Mg, Fe, Zn, Cu, Mn, Mo, Co (расположены в порядке уменьшения их содержания). Некоторые макроэлементы (Mg, Са) и большинство микроэлементов содержатся в организме в виде комплексов с лигандами — аминокислотами, белками, нуклеиновыми кислотами, гормонами, витаминами и т. д. Так, ион Fe2+ в качестве комплексообразователя входит в состав гемоглобина, Со2+ — в витамин В12, Mg2+ — в хлорофилл.

Рис. 2. Концентрирование некоторых химических элементов в органах, тканях и биожидкостях человека
Биологическая роль химических элементов в организме человека разнообразна. Главная функция макроэлементов — это построение тканей, поддержание постоянства осмотического давления, ионного и кислотно-основного состава. Микроэлементы участвуют в обмене веществ, процессах размножения, тканевом дыхании, обезвреживании токсичных веществ, влияют на процессы кроветворения, окисления —восстановления, проницаемость сосудов и тканей.
Необходимо знать, что для организма вреден не только недостаток, но и избыток биогенных элементов, так как при этом нарушается химический гомеостаз. Гомеостаз (от греч. homoios — подобный, одинаковый; stasis — состояние) — относительное динамическое постоянство состава и свойств внутренней среды и устойчивость основных физиологических функций организма. В применении к биоценозам — сохранение постоянства видового состава и числа особей
Например, избыток цинксодержащих компонентов пищи вызывает угнетение активности железосодержащих ферментов (проявляется антагонизм Zn иFe.
На рис. 3. показана кривая зависимости реакции организма от концентрации веществ в пище. Элементы считаются токсичными, если попадание их в организм приводит к тяжелой патологии. К такому ряду токсичных элементов относятся, например, Hg, Cd, Pb и др. Данные элементы в организме человека и животных находятся в качестве примесных.

Рис. 3. Характер изменения реакции организма в зависимости от концентрации веществ в пище
Наряду с заболеваниями, вызванными загрязнением окружающей среды, существуют заболевания, связанные с аномальным содержанием некоторых элементов в почве, водоемах той или иной географической зоны. Такие заболевания называются эндемическими. Например, в Белгородской области обнаружено много железа (особенно в районах добычи и переработки железной руды), избыток кальция вследствие распространения месторождений мела. Растворимыми солями кальция обусловлена довольно высокая жесткость белгородской воды. Этот фактор способствует распространению мочекаменной болезни, тогда как дефицит йода в белгородской воде приводит к заболеванию щитовидной железы.
2. Естественные биогеохимические циклы и их антропогенные изменения
Химические элементы в биосфере циркулируют, т. е. совершают круговорот. В таких циклических процессах происходит обмен химическими элементами между различными компонентами биосферы. Из внешней среды химические элементы поступают в тела живых организмов, в которых претерпевают превращение в сложные соединения, и затем возвращаются в почву, воду, атмосферу либо в виде продуктов жизнедеятельности, либо в виде полностью отмерших организмов.
Круговорот биогенных элементов (углерода, кислорода, азота, серы, фосфора и др.) в биосфере представляет собой переход их из неживых (абиотических) компонентов в живые (биотические) компоненты и обратно за счет множества химических и биохимических превращений. Элементы могут многократно циркулировать между организмами и окружающей средой. Циркуляция биогенных элементов обычно сопровождается их переходом из одних химических веществ в другие. Круговые движения химических элементов называются биогеохимическими циклами («био» относится к живым организмам, а «гео» — к почве, воздуху, воде на земной поверхности). Термин «биогеохимический цикл» ввел В. И. Вернадский. С круговоротом химических элементов тесно связан круговорот веществ, например круговорот воды в природе (гидрологический цикл), который известен вам из курса географии.
Способность обеспечивать круговорот элементов (и веществ) является важным свойством биосферы. С ним связана неисчерпаемость отдельных химических элементов и их соединений. Например, при отсутствии круговорота углерода за короткое время был бы исчерпан этот основной «строительный материал» всего живого, способный образовывать связи углерод—углерод и создавать тем самым огромное число органических соединений. Именно благодаря круговоротам обеспечивается непрерывность процессов в биосфере.
Своей деятельностью человек нарушает естественный баланс круговорота элементов в биосфере. Рассмотрим круговороты важнейших биогенных элементов и воздействие на них антропогенных факторов.
Круговорот углерода (рис. 4). Углерод в атмосфере содержится в основном в виде углекислого газа СО2 (0,03 об.%). Масса углерода, содержащегося в атмосфере в виде СО2, составляет около 600 млрд т, что примерно в 2 раза больше массы углерода в живых организмах. Круговорот углерода в биосфере начинается с поглощения атмосферного СО2 зелеными растениями (и некоторыми микроорганизмами) в процессе фотосинтеза. При этом из углекислого газа и воды образуются углеводы (в первую очередь глюкоза) и кислород, который выделяется в атмосферу (новая концепция фотосинтеза будет рассмотрена в разделе лекции«Биологическая роль воздуха»):

Рис. 4. Схема круговорота углерода:
1 – фотосинтез; 2 — дыхание; 3 — разложение; 4 — растворение; 5 — осаждение.
Большинство растений и животных потребляют кислород при дыхании, выделяя при этом СО2 как конечный продукт обмена. Углерод в виде органического вещества из растений поступает в пищевые цепи животных. В экосистеме углерод перемещается с одного трофического уровня на другой до тех пор, пока не возвратится в атмосферу в результате дыхания или пока организмы, в которых он содержится, не погибнут. Мертвые растения и животные разлагаются микроорганизмами почвы, в результате углерод этих растений и животных окисляется до СО2 и возвращается в атмосферу. Естественными источниками поступления углекислого газа в атмосферу являются также извержения вулканов и лесные пожары.
Углекислый газ атмосферы не только потребляется зелеными растениями при фотосинтезе, но и растворяется в океанах. Океан содержит углекислого газа в 50 раз больше, чем атмосфера. При растворении СО2 в воде образуется непрочная угольная кислота, которая может разлагаться с выделением углекислого газа:
СО2 + Н2О = Н2СО3 (1.3).
Угольная кислота диссоциирует на гидрокарбонат- и карбонат-ионы:
Н2СО3 = НСО3- + Н+ (1.4);
НСО3- = СО32- + Н+ (1.5).
Эти ионы реагируют с кальцием и магнием, попадающими в воду вследствие выветривания пород. При взаимодействии ионов кальция с карбонат-ионами образуется нерастворимый карбонат кальция — известняк:
Са2+ + СО32- = СаСО3 (1.6).
При совместном взаимодействии ионов кальция и магния с карбонат-ионами образуется доломит СаСО3 · MgCO3. Благодаря этим реакциям, сопровождающимся выпадением карбонатов в осадок, происходит дальнейшее растворение СО2 в воде. При этом может происходить частичное превращение нерастворимого карбоната в растворимый гидрокарбонат:
СаСО3 + СО2 + Н2О = Са(НСО3)2 (1.7).
На поверхности водоема раствор согревается, и из него вновь выпадает СаСО3 и выделяется СО2, т. е. происходит обратная реакция.
Таким образом океаны поддерживают концентрацию СО2 в атмосфере на постоянном уровне, играя роль своеобразного буфера. Именно этот механизм до появления интенсивной техногенной деятельности человека обеспечивал относительное постоянство содержания СО2 в атмосфере Земли.
Небольшая часть углерода, по выражению В. И. Вернадского, «ускользает» от круговорота (прежде всего в бескислородной среде) и «уходит в геологию», образуя захоронения в литосфере в качестве торфа, угля, горючих сланцев, нефти, или концентрируется в донных отложениях океана в виде известняка и доломита. Этот углерод в последнее столетие в значительной степени высвобождается человеком, использующим указанные вещества в качестве энергетических, строительных и других ресурсов.
До того времени как человечество начало сжигать ископаемое топливо, скорости поступления углекислого газа в атмосферу и его удаления из цикла были примерно равны. Техногенная деятельность человека нарушила естественный баланс круговорота углерода. Сжигание топлива происходит в промышленных производствах, в тепловых электростанциях (ТЭС), при отоплении жилых домов и предприятий, при горении нефтепродуктов в двигателях внутреннего сгорания и т. д. За последние 150 лет количество сжигаемого топлива увеличивается ежегодно примерно на 4,3%. В результате ежегодно в атмосферу выбрасывается около 6 млрд т СО2. Отрицательным экологическим последствием интенсивного сжигания топлива является увеличение в атмосфере ядовитого угарного газа СО.
Увеличению содержания СО2 в атмосфере способствует также интенсивное сведение лесов, особенно тропических, с целью расширения сельскохозяйственных земель и увеличения производства изделий из древесины. Сельскохозяйственные культуры потребляют в 10—20 раз меньше СО2 на единицу площади поверхности, чем тропические деревья. Наконец, фактором влияния человека на круговорот углерода можно назвать его воздействие на почву в процессе сельскохозяйственного производства (разрушение почвенного покрова, выделения с полей, культивация). Итогом деятельности человека на планете стал неуклонный рост содержания СО2 в атмосфере Земли, начиная с 50-х гг. XX в. Глобальное экологическое последствие этого — парниковый эффект.
Таким образом, складывается биогеохимический цикл (БГХЦ), или круговорот, углерода — одного из наиболее важных биогенных элементов (органогенов), входящих в состав всех живых организмов.
В настоящее время представление В. И. Вернадского о биогеохимических циклах как основе организованности биосферы углублено и расширено до представления о технобиогеохимических циклах (ТБГХЦ) как основе организованности экосферы и антропосферы в целом. Вовлечение того или иного химического элемента в процессы ТБГХЦ зависит от многих факторов: химических свойств элемента (в частности, растворимости образуемых им соединений), его земного кларка (среднего содержания в земной коре); роли элемента в ТБГХ-процессах (биофильности — необходимости участия этого элемента в построении живого организма, технофильности — включения элемента в производственные процессы, геохимической активности), соотношения биологического, техногенного и геологического циклов этого элемента. Баланс элемента в конкретной экосистеме может быть как положительным (прогрессивная аккумуляция), так и отрицательным (прогрессивное рассеяние).
На рис. 5. представлен технобиогеохимический цикл свинца, не являющегося жизненно необходимым элементом, а, напротив, относящегося к группе тяжелых токсичных металлов. Свинец ингибирует ферментативные реакции, вступая в химическое взаимодействие с белками и осаждая их. Присутствие повышенных концентраций свинца в воздухе, воде и продуктах питания представляет угрозу для здоровья человека.
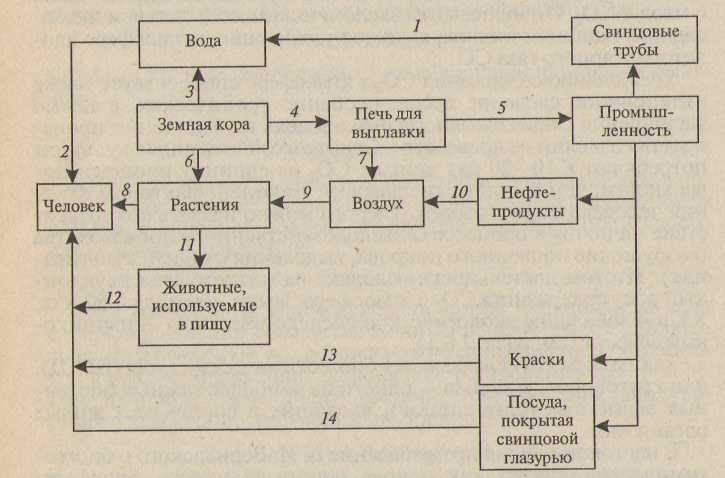
Рис. 5. Технобиогеохимический цикл свинца в окружающей среде
(по А. С. Бобкову, 1997):
1 — загрязнение воды в трубах, изготовленных из свинца; 2 — употребление людьми загрязненной питьевой воды; 3 — проникновение свинца в воду из земной коры; 4 — горнодобывающие процессы; 5 — производство чушкового свинца; 6— поглощение свинца корневой системой растений; 7— загрязнение воздуха в процессе выплавки свинца; 8— употребление в пищу растений, содержащих свинец; 9— осаждение свинца из воздуха; 10 — загрязнение воздуха свинцом в процессе работы автомобильных двигателей; 11 — употребление животными в пищу загрязненной растительности; 12 — животные, употребляемые в пищу человеком; 13 — поглощение детьми свинца, содержащегося в красках; 14 — попадание свинцовой глазури в пищевые продукты
В природных условиях свинец находится в основном в земной коре, он входит в состав более 200 минералов, из них промышленное значение имеют только три: галенит PbS, англезит PbSO4 и церуссит РЬСО3. Из земной коры свинец может попадать в подземные воды, а при выветривании горных пород — в атмосферу и поверхностные воды. Добыча, переработка и выплавка этого металла сопровождаются рассеиванием свинца в биосфере, причем часто в более активной миграционно-способной форме, чем его природные соединения. Показатель технофильности свинца очень высокий и уступает лишь углероду, хлору и золоту. Мировое производство свинца составляет 34 млн т в год и постоянно возрастает, причем выбросы свинца в атмосферу достигают 4,3 млнт в год, и его антропогенное поступление значительно превышает природное. При сжигании нефти и бензина в окружающую среду поступает не менее 50% всего антропогенного свинца, что является важной составляющей в ТБГХЦ элемента.
Районы, в которых концентрация химических элементов (соединений) в силу природных причин оказывается выше или ниже оптимального уровня, называют, по А.П. Виноградову (1895— 1975), биогеохимическими провинциями. Этот известный русский ученый-геохимик ввел данное понятие в науку. Формирование биогеохимических провинций обусловлено особенностями почвообразующих пород, почвообразовательного процесса, а также присутствием рудных аномалий. При загрязнении биосферы происходит образование техногенных аномалий, в которых содержание химических элементов превышает в 10 и более раз так называемое фоновое (или среднестатистическое содержание в незагрязненных ландшафтах). Потоки элементов в их ТБГХЦ играют большую роль в возникновении как зон повышенной концентрации тех или иных веществ, так и зон обеднения, т. е. в образовании различных геохимических провинций. Происходят существенное перераспределение вещества на земной поверхности, дифференциация в пространстве элементов экосферы.
На техногенные геохимические аномалии указывал еще известный геохимик А. И. Перельман, подразделяя их на три типа:
1) глобальные, охватывающие весь земной шар;
2) региональные, охватывающие части материка, страны, области;
3) локальные, радиусом до нескольких десятков километров и связанные с определенным источником загрязнения.
Вопросы и задания
1.
Что можно
сказать о соответствии содержания
химических элементов в организме
человека, в земной коре и морской воде?
2. Что такое
биологическое концентрирование
элементов? Приведите примеры
по табл. 1. и рис. 1. 3. Из перечисленных
ниже элементов, содержащихся в организме
человека, выбрать а) биогенные; б)
примесные;  в)
макроэлементы; г) микроэлементы: С, N,
Са, Hg, Cd, О, Н, Mg, S, Zn, Fe, Na, К, Си, Cl, Mo, P, I. 4.
Назовите отличительные особенности
макро- и микроэлементов. 5. По рис. 2 дайте
характеристику топографии элементов
в организме человека. 6. По рис. 3
охарактеризуйте
зависимость реакции организма от
концентрации веществ в пище.
7. Как
называются заболевания, вызванные
аномальным содержанием некоторых
элементов в воде, почве? Какие аномалии
существуют в вашей области?
8. Что
представляет собой круговорот биогенных
элементов? 9. Что такое биогеохимический
цикл (БГХЦ)?
10. По рис. 5 охарактеризуйте
а) два механизма удаления углекислого
газа из атмосферы; б) природные источники
поступления СО2
в атмосферу; в) антропогенные источники
поступления углекислого газа в атмосферу.
11. Назовите основные факторы воздействия
человека на круговорот углерода и
экологические последствия этого
воздействия.
12. Что такое
ТБГХЦ? Пояснение дайте на примере
свинца.
13. От каких
факторов зависит вовлечение химического
элемента в процессы ТБГХЦ?
14. Что такое
биофильность и технофильность элемента?
15. Что такое
«биогеохимические провинции» и
«техногенные геохимические аномалии»?
в)
макроэлементы; г) микроэлементы: С, N,
Са, Hg, Cd, О, Н, Mg, S, Zn, Fe, Na, К, Си, Cl, Mo, P, I. 4.
Назовите отличительные особенности
макро- и микроэлементов. 5. По рис. 2 дайте
характеристику топографии элементов
в организме человека. 6. По рис. 3
охарактеризуйте
зависимость реакции организма от
концентрации веществ в пище.
7. Как
называются заболевания, вызванные
аномальным содержанием некоторых
элементов в воде, почве? Какие аномалии
существуют в вашей области?
8. Что
представляет собой круговорот биогенных
элементов? 9. Что такое биогеохимический
цикл (БГХЦ)?
10. По рис. 5 охарактеризуйте
а) два механизма удаления углекислого
газа из атмосферы; б) природные источники
поступления СО2
в атмосферу; в) антропогенные источники
поступления углекислого газа в атмосферу.
11. Назовите основные факторы воздействия
человека на круговорот углерода и
экологические последствия этого
воздействия.
12. Что такое
ТБГХЦ? Пояснение дайте на примере
свинца.
13. От каких
факторов зависит вовлечение химического
элемента в процессы ТБГХЦ?
14. Что такое
биофильность и технофильность элемента?
15. Что такое
«биогеохимические провинции» и
«техногенные геохимические аномалии»?
Тема № 4. Химико-экологические проблемы атмосферы.
План
Состав, изменение температуры атмосферы.
Химические процессы в атмосфере.
Проблема стратосферного озона.
Воздух, которым мы дышим.
