
- •Химическая экология и экологическая химия
- •2. Загрязнение окружающей среды
- •3. Химические загрязняющие вещества, их источники и распространение в биосфере
- •Классификация веществ по характеру взаимодействия на живые организмы
- •Экологическое нормирование.
- •Основные понятия: пдк и индекс загрязнения.
- •3. Вида экологического стандарта пдк санитарной оценки разных сред
- •1. Химические элементы биосферы
- •1. Состав, изменение температуры атмосферы
- •2. Химические процессы в атмосфере
- •3. Проблема стратосферного озона
- •4.Воздух, которым мы дышим
- •1. Состав гидросферы
- •2. Свойства природных вод и их качество
- •3. Химические процессы в гидросфере
- •4. Вода в нашей жизни
- •1.Состав литосферы.
- •2. Химические процессы в литосфере
- •3. Почва: особенности состава и происходящих в ней процессов
- •4. Почва, удобрения, пестициды и наше здоровье
- •2. Состав биосферы
- •3. Процессы в биосфере
- •4. Внешняя, внутренняя и духовная среда человека
- •1. Сущность ноосферной концепции
- •2. О гармонизации сознания человека и общества
2. Химические процессы в литосфере
В недрах Земли и на ее поверхности постоянно происходит разрушение горных пород. Разрушающее действие оказывают высокая и низкая температуры (резкое колебание температур), вода, СО2 и О2 атмосферы, кислотные осадки и т.п. Таким образом, большинство химических процессов, происходящих в литосфере, тесно связаны с другими оболочками Земли, их составом. В литосфере, как и в других оболочках планеты, между ее основными компонентами и с участием составляющих других оболочек могут происходить следующие химические реакции:
реакции соединения
![]()
реакции разложения
![]()
реакции замещения (окислительно-восстановительные)
![]()
реакции обмена
![]()
Отметим, что реакции нейтрализации являются частным случаем реакций обмена. В качестве примера реакции нейтрализации можно привести не только взаимодействие между кислотами и основаниями, но и взаимодействие между кислыми и основными солями (минералами):
![]()
Реально многие из этих процессов протекают с участием воды. При гидролизе минералов в составе земной коры происходят существенные изменения. Например, в результате гидролиза горных пород вулканического происхождения в раствор переходят в гидролизованном виде кремнезем SiO2 (минерал кварц) и глинозем А12О3 (минерал корунд), которые, взаимодействуя, образуют разного рода глины (алюмосиликаты). Одна из схем такого взаимодействия:

Многие минералы могут участвовать в окислительно-восстановительных процессах, выполняя при этом функцию либо восстановителя, либо окислителя:

В щелочной среде самородная сера может выполнять как функции окислителя, так и восстановителя:
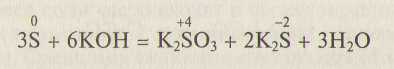
Такого типа окислительно-восстановительные реакции называют реакциями самоокисления—самовосстановления, или диспропорционирования.
3. Почва: особенности состава и происходящих в ней процессов
Почва — самый верхний и плодородный слой литосферы, связующее звено между всеми оболочками планеты и живыми организмами — играет важную роль в процессах обмена веществом (энергией) между компонентами биосферы. Почва — среда обитания большого количества живых организмов. Многие химические процессы, происходящие в почве как части литосферы, напрямую связаны с процессами в биосфере. В почве одновременно могут протекать химические, физические и биологические процессы.
Любую почву можно рассматривать как гетерогенную систему, состоящую из трех фаз: твердой (минеральный «скелет», органические и биологические компоненты), жидкой (почвенный раствор) и газообразной (почвенный воздух).
Минеральную основу почвы в основном составляют кварц (песок), глина и известняк (СаСО3). В зависимости от размера частиц различают почвы: песчаные, суглинистые и глинистые. Содержание органических веществ в разных почвах колеблется от - 2 % (песчаные, глинистые почвы) до 20 % (болотистые почвы). С научной точки зрения органические вещества почвы подразделяют на негуминовые и гумус. Первые включают не полностью разложившиеся остатки растений и животных, жиры и дубильные вещества, полисахара, пектины и др. Они легко разлагаются и поэтому не попадают под понятие «гумус».
В литературе под термином «гумус» (лат. humus — земля, почва) чаще всего понимают темноокрашенное органическое вещество почвы (перегной), образующееся в результате биохимического разложения растительных и животных останков и накапливающееся в верхнем почвенном горизонте. Таким образом, под гумусом понимают совокупность всех органических соединений, находящихся в почве.
Почвы, называемые черноземами, содержат максимальное количество гумуса — в среднем 500 т/га. По оценкам ученых, общие запасы гумуса в почвах мира составляют около 2561 млрд т (в расчете на слой толщиной 1 м). По химическому составу гумус — сложная смесь гуминовых соединений (органических кислот), по элементному составу основными компонентами гумуса являются водород, углерод, кислород, а также азот (2 — 5 %), сера (~ 1 %), фосфор, калий. За счет высокого содержания упомянутых биогенных элементов гумус — главный источник, из которого растения получают питание.
Биологическая составляющая почвенных экосистем представлена зелеными растениями, микроорганизмами и животными. Основная почвообразующая роль принадлежит лесной растительности, второе место занимает травянистая растительность. В формировании плодородия почв важная роль принадлежит почвенным микроорганизмам (бактериям, грибам, водорослям). Их общее число может достигать нескольких миллиардов в 1 г. Микрофлора почвы составляет в сухой массе примерно 2 т вещества животного происхождения на 1 га. Важную роль в почвенном круговороте веществ играют бактерии. Гетеротрофные бактерии разлагают органические остатки до простых минеральных соединений. Они могут быть как аэробными, так и анаэробными. Одни осуществляют процесс аммонификации (разложение органических веществ до аммиака), другие восстанавливают нитрат-ион NO3- до NО2- иона и далее до N2O или N2 (процесс денитрификации). Например, процесс денитрификации с участием глюкозы можно записать в виде следующих уравнений:
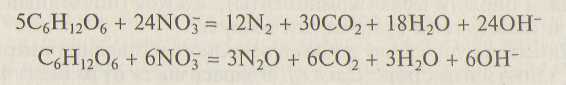
Последний процесс является также одним из основных биологических источников поступления оксида азота (I) в атмосферу.
Автотрофные бактерии осуществляют в почве процессы окисления минеральных соединений — продуктов жизнедеятельности гетеротрофов. Например, аэробные бактерии участвуют в процессах нитрификации и нитрофикации:
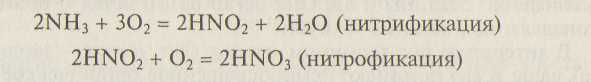
Широко распространенные в почвах так называемые серобактерии окисляют H2S, S и другие соединения серы до H2SO4 (процесс сульфофикации):

При участии железоокисляющих бактерий, наиболее распространенных в заболоченных почвах, происходит окисление солей Fe(II). В конечном итоге результат происходящих процессов (в том числе гидролиза) можно записать в следующем виде:
![]()
Эти же бактерии могут также окислять соли Мn(П).
К физико-химическим процессам, происходящим в почвах, относят процессы эрозии и засоления почв.
Эрозия почв — это явления разрушения и сноса почв и рыхлых пород потоками воды и ветра. Соответственно бывает ветровая и водная эрозия. Эрозия уносит с полей биогенные элементы Р, К, N, Ca, Mg гораздо больше, чем их вносится с удобрениями Продуктивность почв при этом может снижаться на 35 — 70 %. То, что смывается или выдувается при естественной эрозии в течение столетий, антропогенная эрозия уносит в самые короткие сроки. Разрушение почвы эрозией происходит быстро, тогда, как для естественного восстановления верхнего плодородного слоя толщиной 25 см требуется сотни и тысячи лет. Одними из основных причин антропогенной эрозии почвы являются:
уменьшение содержания гумусовых веществ в почве, приводящее к изменению структуры и водопроницаемости пахотных земель;
нарушение баланса по воде, которое является следствием вырубки лесов, поливного земледелия и других воздействий, снижающих структурную устойчивость почв.
Засоление почв — процесс накопления вредных для растений солей (СаСО3, MgCO3, Na2CO3, Na2SO4, NaCl и др.) в верхних слоях почвы. Этот процесс ежегодно превращает в разных странах мира сотни тысяч гектаров поливных земель в бесплодные. Процессу засоления способствуют нарушение правил строительства и эксплуатации ирригационных систем, которые орошают огромные площади земли. Для орошения пригодны воды с концентрацией солей до 1 г/л. Особенно нежелательно присутствие Na2CO3. В реках Na2CO3 обычно содержится в количестве 0,2—0,3 г/л. Однако засоление происходит также из-за того, что минерализованные грунтовые воды (в них содержится больше солей) поднимаются на поверхность, способствуя накоплению солей в почвенном профиле. Фактически при поверхностном орошении через 8—10 лет грунтовые воды поднимаются до критического уровня (1,5 — 2,5 м) и вызывают засоление и заболачивание. Избежать этого можно, если применять современные технологии: использовать закрытые трубопроводы, дождевую воду, проводить концентрирование оросительных вод, т. е. осуществлять целый комплекс технологических мероприятий, обеспечивая тем самым высокую культуру земледелия.
