
- •Химическая экология и экологическая химия
- •2. Загрязнение окружающей среды
- •3. Химические загрязняющие вещества, их источники и распространение в биосфере
- •Классификация веществ по характеру взаимодействия на живые организмы
- •Экологическое нормирование.
- •Основные понятия: пдк и индекс загрязнения.
- •3. Вида экологического стандарта пдк санитарной оценки разных сред
- •1. Химические элементы биосферы
- •1. Состав, изменение температуры атмосферы
- •2. Химические процессы в атмосфере
- •3. Проблема стратосферного озона
- •4.Воздух, которым мы дышим
- •1. Состав гидросферы
- •2. Свойства природных вод и их качество
- •3. Химические процессы в гидросфере
- •4. Вода в нашей жизни
- •1.Состав литосферы.
- •2. Химические процессы в литосфере
- •3. Почва: особенности состава и происходящих в ней процессов
- •4. Почва, удобрения, пестициды и наше здоровье
- •2. Состав биосферы
- •3. Процессы в биосфере
- •4. Внешняя, внутренняя и духовная среда человека
- •1. Сущность ноосферной концепции
- •2. О гармонизации сознания человека и общества
3. Химические процессы в гидросфере
Рассмотрение химических процессов в гидросфере — задача более сложная, чем изучение процессов в атмосфере. Причина в том, что природная вода представляет систему открытого типа, обменивающуюся веществами и энергией с сопредельными средами: атмосферой, литосферой, биологической составляющей. Схематически всю гидросферу или ее определенную подсистему, например водоем, можно рассматривать как своеобразный химический реактор проточного типа (рис.1).
Гидросфера — глобальная открытая система, стабильность которой тем выше, чем больше разнообразие составляющих ее компонентов. Опасность разбалансировки такой системы, нарушение равновесия и стабильности возникают тогда, когда существенно изменяется химический состав или физико-химические параметры на входе и соответственно продукция на выходе.

Рис. 1. Гидросфера как открытая система
Остановимся на трех особенностях химических процессов в гидросфере.
Многообразие форм химических соединений: присутствуют все классы органических и неорганических веществ. Например, металлы, являющиеся непременным компонентом природных водоемов, существуют в гидросфере в виде простых ионов, гидратированных ионов, комплексных и металлоорганических соединений, коллоидных частиц и взвесей.
Влияние гидролиза на химические процессы и участие в них гидратированных молекул и ионов. Например, железо, являющееся важным питательным компонентом водных организмов, существует в гидросфере в форме гидроксокомплексов Fe3+:

Современными методами инфракрасной спектроскопии показано, что в кислой водной среде фактически присутствует не свободный ион Н+ и даже не ион гидроксония Н3О+, а аквакомплекс вида (H+)aq = Н2О—Н+—ОН2. В щелочной среде состав аквакомплекса можно записать в виде (OH_)aq = НО-—Н+—ОН- в нейтральной — (H2O)aq= H2O—H+—ОН. Однако для удобства в большинстве реакций будем использовать традиционное написание Н+, ОН-, Н2О.
В целом процессы гидролиза, происходящие в гидросфере с минералами, играют важную роль, изменяя не только химический состав той или иной водной системы, но и ее рН (реакцию среды). Так, если минерал (соль) образован анионами слабой кислоты (H2S, H2CO3, Н3РО4 и т.д.) и катионами сильного основания (КОН, NaOH и т.д.), то в результате гидролиза реакция среды станет щелочной (рН > 7):

При гидролизе минералов (солей), образованных анионами сильной кислоты (НС1, H2SO4, HNO3 и т.д.) и катионами слабого основания (А1(ОН)3, Zn(OH)2, NH4OH и т.д.), реакция среды будет кислой (рН < 7):

Если минерал (соль) образован анионами слабой кислоты и слабого основания, гидролиз будет проходить до конца (а не только по первой ступени, как в предыдущих случаях), а реакция среды будет близка к нейтральной (рН 7):

Реакцию водной среды не изменяют также минералы (соли), образованные анионами сильных кислот и катионами сильных оснований (NaCl, K2SO4, NaNO3 и т.д.), поскольку они не подвергаются гидролизу. В данном случае рН 7.
Участие в химических процессах водорослей и бактерий. Водоросли (их около 30 тыс. видов) выделяют в водную среду органические вещества, а поглощают минеральные соединения и углекислый газ. Бактерии, наоборот, превращают органические вещества в минеральные, т.е. перерабатывают создаваемое в процессе фотосинтеза органическое вещество в доступную для усвоения живыми организмами (например, рыбами) форму. Численность бактерий в природной воде составляет 1 — 300 млн/мл, что в десятки раз меньше, чем в почве. Процесс разложения (окисления) с участием бактерий одного из видов фитопланктона (микроскопических водорослей, находящихся во взвешенном состоянии) упрощенно можно записать в виде химического уравнения:
(СН2О)106(NH3)16Н3РО4 + 138О2=106СО2+122Н2О +16НNО3+Н3РО4
В целом на окисление органического вещества в гидросфере в течение одного года требуется около 1,5 • 1011 т кислорода.
В гидросфере протекает ряд химических и физико-химических процессов. Рассмотрим некоторые из них.
1. Химические реакции в водных растворах в основном ионообменные и окислительно-восстановительные. Суммарное относительное содержание окислительно-восстановительных реагентов характеризует окислительно-восстановительный потенциал (редокс-потенциал). Поскольку в природной воде присутствует растворенный кислород, потенциал платинового электрода будет более положителен по сравнению с водородным электродом сравнения, т.е. такая среда будет иметь окислительный характер. Отрицательное значение редокс-потенциал имеет в анаэробной водной среде, например, когда вместо кислорода присутствует сероводород. Такая среда будет иметь восстановительный характер.
Типичным примером ионообменной реакции может служить реакция раствора хлорида цинка с гидроксидом натрия:

Примером окислительно-восстановительного процесса может служить реакция
Cl20 + H2O = HCl-1 + HCl+1O
где хлор выступает в качестве окислителя и восстановителя (реакция самоокисления—самовосстановления).
Напомним, что окислительно-восстановительными называют реакции, сопровождающиеся переходом электронов между участвующими в реакции частицами (атомами, ионами, молекулами). Процесс потери электронов частицей называют ее окислением, а саму частицу, отдающую электроны, — восстановителем. Процесс присоединения электронов частицей называют ее восстановлением, а принимающую электроны частицу — окислителем. Таким образом, в ходе окислительно-восстановительной реакции окислитель восстанавливается, а восстановитель окисляется.
Различают три типа окислительно-восстановительных реакций межмолекулярные, внутримолекулярные, самоокисления—самовосстановления. Примером первых могут служить реакции, происходящие в атмосфере:

примером реакций второго типа может служить
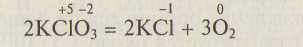
примером реакций третьего типа — приведенная выше реакция с участием хлора.
2. Испарение и растворение газов на поверхности раздела воздух — вода (например, растворение газов О2, N2, CO2, H2S, NH3 в природной воде). Кислород растворим в большей степени, чем азот, поэтому соотношение их объемных концентраций в природных водах составляет [N2]: [О2] = 65 : 35. Процесс растворения СО2 можно представить равновесными реакциями:
равновесие, соответствующее процессу растворения углекислого газа в природной воде:
СО2(атмосфера) = СО2(гидросфера)
равновесие, характеризующее образование угольной кислоты:
СО2(раствор) + Н2О = H2CO3
равновесие процессов диссоциации угольной кислоты:
Н2СО3 = Н+ + HCO3-
HCO3- = Н+ + CO32-
равновесие гидролиза гидрокарбонатов и карбонатов:
HCO3-+ H2O = H2CО3 + OH-
CO32- + H2О = HCO3- + ОН-
Суммарно обмен углекислого газа между атмосферой и гидросферой можно представить в виде следующей схемы:

Отметим, что количество углекислого газа, растворенного в гидросфере, примерно в 50 раз больше его общего содержания в атмосфере. Это следует учитывать при составлении прогнозов изменения климата на нашей планете.
3. Сорбционные процессы, т.е. процессы адсорбции, абсорбции и десорбции, обычно протекающие с участием органических соединений и способствующие самоочищению природных вод.
4. Фотолиз — фотохимические превращения, протекающие в природных водах под воздействием УФ излучения Солнца при участии свободных радикалов и возбужденных частиц. Толщина слоя воды, в котором осуществляется фотолиз, может доходить до не скольких метров. Фотолиз протекает с участием кислорода и свободных радикалов, играя важную роль в процессах самоочищения неглубоких водоемов, рек, прудов, прибрежных зон морей, озер, водохранилищ от загрязняющих веществ.
