
- •Химическая экология и экологическая химия
- •2. Загрязнение окружающей среды
- •3. Химические загрязняющие вещества, их источники и распространение в биосфере
- •Классификация веществ по характеру взаимодействия на живые организмы
- •Экологическое нормирование.
- •Основные понятия: пдк и индекс загрязнения.
- •3. Вида экологического стандарта пдк санитарной оценки разных сред
- •1. Химические элементы биосферы
- •1. Состав, изменение температуры атмосферы
- •2. Химические процессы в атмосфере
- •3. Проблема стратосферного озона
- •4.Воздух, которым мы дышим
- •1. Состав гидросферы
- •2. Свойства природных вод и их качество
- •3. Химические процессы в гидросфере
- •4. Вода в нашей жизни
- •1.Состав литосферы.
- •2. Химические процессы в литосфере
- •3. Почва: особенности состава и происходящих в ней процессов
- •4. Почва, удобрения, пестициды и наше здоровье
- •2. Состав биосферы
- •3. Процессы в биосфере
- •4. Внешняя, внутренняя и духовная среда человека
- •1. Сущность ноосферной концепции
- •2. О гармонизации сознания человека и общества
2. Химические процессы в атмосфере
В химических атмосферных процессах принимают участие атомные и молекулярные частицы разных видов (рис. 2).

Рис. 2. Атомные и молекулярные частицы в атмосфере
Химические процессы в атмосфере характеризуются рядом особенностей.
Большинство химических реакций инициируются не термически, а фотохимически, т.е. при воздействии квантов света, по лученных в результате излучения Солнца.
Атмосфера Земли — окислительная (за счет содержащегося в воздухе кислорода); в ней преобладают окислительно-восстановительные реакции с участием частиц в основном с ковалентным типом химической связи.
Для атмосферных процессов характерны цепные реакции, т.е. протекающие в несколько стадий с участием промежуточных продуктов — реакционноспособных радикалов (НО·, НО2·, О·, СН3·, Н·) и др.).
В химических и фотохимических превращениях образуются разнообразные неорганические и органические соединения, в ряде случаев токсичные.
Продукты реакций могут переноситься на дальние расстояния и длительное время сохраняться в атмосфере (например, в виде аэрозолей).
Начинаются химические реакции на высоте ~ 250 км, когда концентрация газов азота и кислорода достигает 109 см-3 и становится заметным поглощение жесткой УФ составляющей солнечной радиации.
Область атмосферы, где происходят химические реакции, часто называют хемосферой. К ней относятся тропосфера и нижняя часть стратосферы.
Одним из важных процессов, протекающих в верхних слоях атмосферы, является диссоциация:
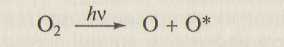
где О* — атом кислорода в возбужденном состоянии. В атмосфере также происходят следующие процессы:
• поглощение в коротковолновой ультрафиолетовой области спектра радиации с последующей ионизацией:
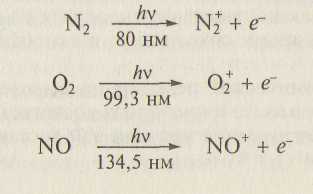
• реакции диссоциативной рекомбинации:

• реакции переноса заряда:
• реакции переноса заряда с разрывом связи (обмен атомов):
Реакции с участием ионизированных атомов, атомных и молекулярных радикалов экзотермические. Большинство реакций такого рода протекает безактивационно.
Основным процессом в стратосфере является процесс образования озона на высоте 30 — 50 км. На больших высотах образуется возбужденная молекула О32*:
О + О2 → О3*
Образование стабильной молекулы О3 происходит лишь в результате реакции О3* с любой другой газообразной частицей М:
О3* + М → О3 + М*
С понижением высоты скорость образования озона сначала увеличивается, затем начинает уменьшаться из-за поглощения излучения с длинами волн λ<240нм и распада молекул О3, что определяет наличие максимума содержания О3 на высоте 25 км (рис.3).
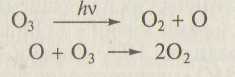
Зависимость концентрации озона, молекулярного и атомарного кислорода от высоты над поверхностью Земли приведена на рис. 3. Для сравнения здесь же показана зависимость содержания азота от высоты. Видно, что концентрация более прочно связанных молекул азота мало зависит даже от жесткого ультрафиолетового излучения и монотонно меняется с высотой.
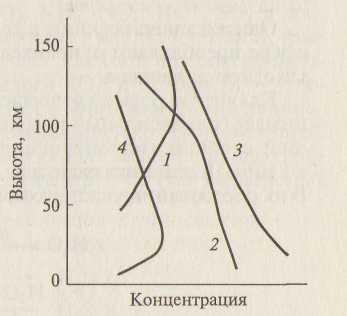
Рис.3. Изменение концентрации атомарного (1) и молекулярного (2) кислорода, азота (3), озона (4 по высоте слоя атмосферы).
Следует подчеркнуть, что сформировавшийся в атмосфере озоновый слой вместе с другими упоминавшимися компонентами атмосферы является эффективным защитником биоты Земли от жесткого, т.е. энергетически более мощного, коротковолнового солнечного излучения, пагубно действующего на растительный и животный мир, в частности на человека (1 квант излучения в ультрафиолетовой области спектра равен по энергии примерно 10 квантам в средней инфракрасной области).
Процессы фотодиссоциации молекулярного кислорода и озона приводят к почти полному поглощению солнечного излучения с длиной волны менее 300 нм на высоте тропопаузы. Поскольку основные компоненты атмосферы не взаимодействуют с излучением при λ > 300 нм, в тропосферных фотохимических реакциях участвуют менее распространенные компоненты атмосферы (малые добавки атмосферных газов) и загрязняющие вещества. Но при грозовых разрядах в атмосфере могут протекать реакции и с основными компонентами атмосферы:
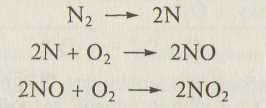
В результате взаимодействия оксида азота(ГУ) с атмосферной ! влагой образуются азотная и азотистая кислоты:

Однако такие реакции в тропосфере не доминируют. В тропосфере преобладают окислительно-восстановительные процессы с участием радикалов.
Ключевую роль в тропосферных химических превращениях занимает гидроксильный радикал НО· (время жизни - 1 с) и в меньшей степени гидропероксидный радикал НО2· (время жизни ~ 1 мин). В реакциях радикалы НО· и НО2· являются окислителями. В их образовании участвуют разные соединения:

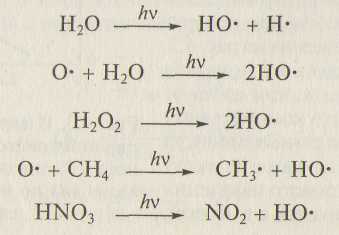
Концентрация НО· в атмосфере составляет (0,5 — 5,0) · 106см-3, концентрация НО2· — 107— 108 см-3.
Рекомбинация пероксидных радикалов — основной источник образования в тропосфере пероксида водорода:
![]()
Насколько существенна роль гидроксильного радикала, иллюстрирует схема процесса окисления углеводородов в атмосфере (например, метана):
![]()
Эти процессы являются каналом вторичного загрязнения атмосферы монооксидом углерода (II) (угарным газом), по объему сравнимым только с поступлением СО от неполного сгорания ископаемого топлива.
Большую роль в химических атмосферных процессах играет атмосферная влага. Реакции, происходящие в каплях влаги, достаточно эффективны, так как многие газовые компоненты обладают высокой растворимостью (Н2О2, NH3, NOх, HC1, SO2 и др.).
В химических реакциях, протекающих в каплях и облаках, важнейшую роль играют такие окислители, как озон и пероксид водорода, а также их органические аналоги RO2- и ROOH- (R — углеводородный радикал). Озон участвует в образовании пероксидного радикала с последующей его рекомбинацией до Н2О2.
Примером химических реакций в каплях является процесс образования дождевой влаги с показателем рН < 6 (так называемых «кислотных дождей»):

Большинство реакций такого рода экзотермические, вносящие свою лепту в изменение температуры атмосферы.
