
- •Белорусский государственный университет информатики и радиоэлектроники Кафедра химии
- •1. Установить химическую активность металлов в водных растворах
- •1.1. Ход и данные опыта.
- •1.2. Расчет, наблюдение и анализ данных.
- •2. Определение стандартной эдс химического гальванического элемента.
- •2.1. Ход и данные опыта.
- •2.2. Расчет, наблюдение и анализ данных.
- •2.3 Вывод: эдс гальванического элемента зависит от природы электродов, от концентрации потенциалопределяющих ионов, от степени поляризации и процессов связанных с её устранением.
- •3. Электролиз растворов солей на инертных электродах.
- •3.1. Электролиз сульфата меди.
- •3.1.1. Ход и данные опыта.
- •3.1.2. Расчет, наблюдение и анализ данных.
- •3.2. Электролиз хлорида натрия.
- •3.2.1. Ход и данные опыта.
- •3.2.2. Расчет, наблюдение и анализ данных.
- •3.3. Электролиз иодида калия.
- •3.3.1. Ход и данные опыта.
- •3.3.2. Расчет, наблюдение и анализ данных.
3.1.2. Расчет, наблюдение и анализ данных.
Схема электролиза раствора CuSO4:





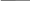 C
| CuSO4
, H2O
| C
C
| CuSO4
, H2O
| C
катод Cu2+, SO42-, H2O анод
pH=7
K


 (-) A
(+)
(-) A
(+)
Cu2+ Cu2+ + 2e = Cu SO42- 2H2O – 4e = O2 + 4H+
H2O H2O pH < 7
Медь выделилась на катоде, если pH < 7, значит
т.к. медь – малоактивный металл. выделился кислород.
Вторичные процессы
(в растворе)
 4H+
+ 2SO42-
2H2SO4
4H+
+ 2SO42-
2H2SO4
Суммарное уравнение электролиза:
2 CuSO4 + 2H2O 2Cu + O2 + 2H2SO4
Катод покрылся медью, т.к. ионы меди положительно заряжены, а катод - отрицательно. Ионы меди устремляются к катоду, присоединяют недостающие электроны и образуют атомы меди.
На аноде выделился кислород, т.к. pH раствора уменьшилось, что свидетельствует о увеличении концентации ионов H+.
Кислородсодержащие ионы SO42– на аноде в водном растворе не окисляются.
3.2. Электролиз хлорида натрия.
3.2.1. Ход и данные опыта.
Наполнили электролизер 0,5 М раствором NaCl (рH=7). Соединили графитовые электроды с источником постоянного тока: катод к минусу (–), анод к плюсу (+) и пропустили ток напряжением 20 В в течение 2 мин. На обоих катодах выделился газ. В катодное пространство добавили фенолфталеин, в анодное – йодокрахмальный раствор (KI + крахмал). Раствор в катодном пространстве стал малиновым, а в анодном – синим.
3.2.2. Расчет, наблюдение и анализ данных.
Схема электролиза раствора NaCl:
С | NaCl , H2O | C
катод Na+, Cl-, H2O анод
pH=7
K


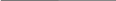 (-) A (+)
(-) A (+)
Na+ 2H2O + 2e = H2 + 2OH- Cl- 2Cl- - 2e = Cl2
H2O Вторичные процессы (в растворе) H2O
Na+ + OH- = NaOH
Фенолфтолеин в растворе малиновый,
значит pH > 7, следовательно выделившийся
газ – водород.
Суммарное уравнение электролиза:
 2NaCl
+ 2H2O
2NaOH
+ H2
+ Cl2
2NaCl
+ 2H2O
2NaOH
+ H2
+ Cl2
Натрий является активным металлом, поэтому он не может выделиться на катоде, на катоде выделяется водород. Увеличение концентрации ионов OH- обуславливает малиновую окраску фенолфтолеина в растворе и увеличение pH раствора.
На аноде окислились ионы Cl- , т.к. при добавлении йодокрахмального раствора раствор NaCl приобретает синюю окраску (2KI + Cl2 = 2KCl + I2 , а выделившийся йод, реагируя с крахмалом, окрашивает раствор в синий цвет, что подтверждает тот факт, что в растворе находится более активный галоген, чем йод, в данном случае хлор).
3.3. Электролиз иодида калия.
3.3.1. Ход и данные опыта.
Наполнили электролизер 0,5 М раствором KI (рH=7). Соединили графитовые электроды с источником постоянного тока: катод к минусу (–), анод к плюсу (+) и пропустили ток напряжением 20 В в течение 2 мин. На катоде выделился газ, а раствор в анодном пространстве окрасился в желтый цвет. В катодное пространство добавили фенолфталеин, в анодное – крахмал. Раствор в катодном пространстве стал малиновым, а в анодном – синим.
