
- •4. Атомно-кристаллическое строение металлов. Особенности кристаллического строения вещества.
- •7. Основы теории кристаллизации металлов.
- •8. Фазовые переходы. Диффузия в металлических материалах.
- •9. Размер зерна и его влияние на свойства материалов (металлов).
- •10. Обработка металлов резанием. Формообразование поверхности металлов.
- •12. Резцы и их геометрия.
- •13. Физическая сущность процесса резания. Стружки
- •14. Тепловые явления в процессе резания. Охлаждение резцов и деталей.
- •48. Виды термической обработки металлов и сплавов:
1. Материальный мир: его структура и методы преобразования. Материальный мир - это вещи которые нас окружают и которые можно потрогать. Например, стул, стол, ручка. В окружающем нас пространстве материя существует в форме вещества и поля. Вещество в природе находится в виде различных структур, которые определяют строение и свойства окружающего нас материального мира. Слово "строение" в данном случае отражает лестницу объектов, качественно отличающихся или характеризующихся степенью сложности. Окружающий нас мир современная наука разделяет на три области: микромир, макромир и мегамир Макромир — это область природы, доступная нам, т. е. область наших закономерностей. Мегамир нам труднодоступен; это область крупных объектов, больших размеров и расстояний между ними. Эти закономерности мы изучаем опосредованно. В этих областях имеется следующая иерархия объектов: микромир — это вакуум, элементарные частицы, ядра, атомы, молекулы, клетки; макромир — это макротела (твердые тела, жидкости, газы, плазма), индивид, вид, популяция, сообщество, биосфера; мегамир — это планеты, звезды, галактики, Метагалактика, Вселенная.
2. Естественнонаучные представления о материи. Материя – это философская абстракция, понятие, посредством которого обозначается многообразие природных явлений и процессов, обозначается объективная реальность, которая дана человеку в его ощущениях, существуя независимо от них. Современные естественно-научные представления о структуре материи базируются на следующих положениях: каждое материальное образование, отдельная вещь представляет собой единство вещества и поля. Главное отличие вещества от поля заключается в том, что вещество обладает массой покоя, механической массой, тогда как электромагнитное, гравитационное и другие поля, а также нейтрино массой покоя не обладают. Вещество относительно непроницаемо, скорость движения частиц вещества всегда меньше скорости света, в веществе – значительная концентрация массы и энергии. Поле не имеет массы покоя, легко проницаемо, обладает волновой природой, характеризуется f слабой концентрацией массы и энергии, а также скоростью света. Вещество и поле могут взаимно превращаться друг в друга: так, при столкновении электрона и позитрона, обладающих вещественными свойствами частиц, образуются два фотона (кванта света), т.е. вещественная форма превращается в полевую форму материи, при этом не происходит уничтожения материи как таковой. Вещество как одно из важнейших видов материи состоит из молекул и может находиться в пяти различных состояниях: твердом, жидком, газообразном, плазменном и нейтронном. Плазма – такое состояние вещества, когда в его атомах в результате нагревания до многих миллионов градусов деформируются электронные оболочки, возможны реакции ядерного синтеза. Нейтронное состояние вещества предполагает его уплотнение до такой степени, что структура атома нарушается, электронные оболочки «сминаются», а размеры атома оказываются практически размерами ядра (вещество таких нейтронных небесных тел в силу огромной гравитации не испускает даже электромагнитного излучения). Молекулы состоят из атомов, атомы, в свою очередь, состоят из ядра и вращающихся вокруг него электронов. Стабильность ядра, состоящего из нуклонов – положительно заряженных протонов и не обладающих электрическим зарядом нейтронов, поддерживается за счет быстрого обмена между ними пи-мезонами. Электроны удерживаются на своих орбитах, благодаря притяжению противоположных зарядов электрона и протона, а также за счет своеобразного обмена с ядром фотонами: таким образом компенсируются центробежные силы. Все элементарные частицы обладают корпускулярно-волновыми свойствами. В структурном отношении многие из них являются сложными системными образованиями, в составе которых обнаружены кварки и глюоны. Тем самым подтвердилось предсказание о том, что электрон также неисчерпаем, как и атом.
4. Атомно-кристаллическое строение металлов. Особенности кристаллического строения вещества.
Каждый металл (вещество) может находиться в четырех агрегатных состояниях: газообразном, жидком, твердом и в виде плазмы. В газообразном состоянии расстояние между атомами (частицами) велико, силы взаимодействия малы и атомы хаотично пере- мещаются в пространстве, отталкиваясь друг от друга. Атомы газообразного вещества обладают большой кинетической энергией. В жидком металле атомы сохраняют лишь ближний порядок, т.е. в небольшом объеме упорядоченно и закономерно расположено небольшое количество атомов. Ближний порядок неустойчив, он может возникать и исчезать под действием тепловых колебаний.
Общее свойство металлов и сплавов — их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах. Атомно-кристаллическая структура может быть представлена не рядом периодически повторяющихся объемов, а одной элементарной ячейкой. Так называется ячейка, повторяющаяся во всех трех измерениях. Трансляцией этого наименьшего объема можно полностью воспроизвести структуру кристалла (рис. 1.1). В кристалле элементарные частицы (атомы, ионы) сближены до соприкосновения. Для упрощения пространственное изображение принято заменять схемами, где центры тяжести частиц представлены точками. В точках пересечения прямых линий располагаются атомы; они называются узлами решетки. Расстояния a, b и c между центрами атомов, находящихся в соседних узлах решетки, называют параметрами, или периодами решетки. Величина их в металлах порядка 0,1–0,7 нм, размеры элементарных ячеек — 0,2–0,3 нм. На рис. 1.2 показаны три типа элементарных ячеек кристаллических решеток, наиболее характерные для металлов: объемноцентрированная кубическая (ОЦК); гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГП), а также схемы упаковки в них атомов.
6. Типы кристаллических решёток.
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические
решетки, состоящие из ионов,
называются ионными.
Их образуют вещества с ионной связью.
Примером может служит кристалл хлорида
натрия, в котором, как уже отмечалось,
каждый ион натрия окружен шестью
хлорид-ионами, а каждый хлорид-ион -
шестью ионами натрия. Такому расположению
соответствует наиболее плотная упаковка,
если ионы представить в виде шаров,
размещенных в кристалле . Очень часто
кристаллические решетки изображают,
как показано на рис 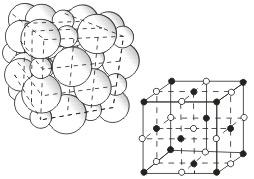 ,
где указывается только взаимное
расположение частиц, но не их размеры.
,
где указывается только взаимное
расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n - большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические
решетки, в узлах которых находятся
отдельные атомы, называются атомными.
Атомы в таких решетках соединены между
собой прочными ковалентными связями.
Примером может служить алмаз - одна из
модификаций углерода. Алмаз состоит из
атомов углерода, каждый из которых
связан с четырьмя соседними атомами.
Координационное число углерода в алмазе
4 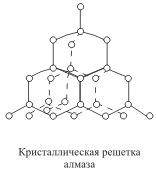 .
В решетке алмаза, как и в решетке хлорида
натрия, молекулы отсутствуют. Весь
кристалл следует рассматривать как
гигантскую молекулу. Атомная кристаллическая
решетка характерна для твердого бора,
кремния, германия и соединений некоторых
элементов с углеродом и кремнием.
.
В решетке алмаза, как и в решетке хлорида
натрия, молекулы отсутствуют. Весь
кристалл следует рассматривать как
гигантскую молекулу. Атомная кристаллическая
решетка характерна для твердого бора,
кремния, германия и соединений некоторых
элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Примерами
их являются лед, твердый оксид углерода
(IV) ("сухой лед"), твердые
галогеноводороды, твердые простые
вещества, образованные одно- (благородные
газы), двух- (F2, Сl2, Br2,
I2, Н2, О2, N2), трех-
(О3), четырех- (Р4), восьми-
(S8) атомными молекулами. Молекулярная
кристаллическая решетка йода показана
на рис 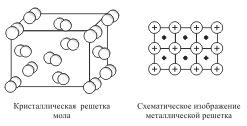 .
Большинство кристаллических органических
соединений имеют молекулярную решетку.
.
Большинство кристаллических органических
соединений имеют молекулярную решетку.
